大蒜素对大鼠心力衰竭模型心室肌细胞迟后除极和触发活动的作用
2019-05-29汪晶晶王蔚然董颖李彬李洁白婧刘传斌林琨陈韵岱李泱
汪晶晶,王蔚然,董颖,李彬,李洁,白婧,刘传斌,林琨,陈韵岱,李泱
(解放军总医院第一医学中心心血管内科,北京 100853)
心源性猝死(sudden cardiac death,SCD)最常见原因是恶性室性心律失常,其与慢性心力衰竭有非常紧密的关系。Framingham研究显示,心力衰竭患者猝死率是普通人群的6~9倍[1]。心力衰竭时心肌发生显著的电重构,在长期病理学因素作用下,心肌电活动出现多种形式的适应性改变,这在一定程度上能代偿和缓解心功能损害,但同时也成为致心律失常的因素[2]。已有研究证实,心力衰竭后迟后除极(delayed afterdepolarization,DAD)及其引起的触发活动(triggered activity,TA)在SCD发生中起着重要的作用[3]。大蒜素(allicin,All)是一种从大蒜鳞茎中分离提取的有效成分,是具有多种生物学活性的化合物。研究发现,All对多种离子流均有作用,可发挥抗心律失常的效应。我们的前期研究显示,All可减少原发性高血压大鼠血管平滑肌细胞和心力衰竭后心室肌细胞上的L型钙通道电流(L-type calcium current,ICa,L)[4-7]。但尚不可知其是否对心力衰竭后细胞内钙离子及DAD有作用,并进而引起TA。本文选择心力衰竭大鼠的心室肌细胞,用全细胞膜片钳技术观察All对大鼠心室肌细胞DAD和TA发生的影响,进一步探讨其可能的离子流机制,旨在寻找新的治疗心力衰竭后抗恶性心律失常的药物。
1 材料与方法
1.1 材料
Sprague-Dawley(SD)大鼠30只,体质量180~220 g,雌雄各半。胶原酶Ⅱ、胰蛋白酶、FBS胎牛血清、HEPES缓冲液、L-谷氨酸、4-氨基吡啶 (4-aminopyridine,4AP)、河豚毒素(tetrodotoxin,TTX)和CsCl购自美国Sigma公司;依他酸(Egtazic acid,EGTA)购自美国Fluka Biochemika公司。All购自索莱宝试剂公司。细胞分离液(mmol/L):CaCl21.5,KCl 5,NaCl 110.0,MgCl21.2,HEPES缓冲液10,葡萄糖10,pH值用NaOH调至7.4;无钙分离液为分离液中不加CaCl2但增加EGTA 10 mmol/L。细胞外液:同细胞分离液,为排除干扰电流,加入5 mmol/L的4AP阻断瞬时外向钾电流(transient outward potassium current,Ito),加入100 μmol/L的TTX阻断钠通道电流(INa)。细胞内液(mmol/L):氯化四乙基铵(tetraethylammonium chloride,TEA-Cl)20、CsCl 100、EGTA 10、Na2ATP 5、HEPES缓冲液10,pH调至7.2。KB液(mmol/L):L-谷氨酸50,KCl 30,KOH 80,KH2PO430,牛磺酸 20,HEPES 10,葡萄糖10,MgSO43,EGTA 0.5,KOH调pH值至7.4。
1.2 方法
1.2.1 心力衰竭模型制作 参考文献[8]采用腹主动脉结扎法选取SD大鼠20只,体质量180~220 g,雌雄各半。10%水合氯醛腹腔麻醉,于剑突下腹正中切口,分层打开腹腔,在肾动脉分支上方0.5 cm处钝性游离腹主动脉,将8号注射器针头磨钝平行置于腹主动脉上,用4号手术丝线将腹主动脉和注射器针头一同结扎,然后缓慢将注射器针头撤出,关腹,分层缝合(模型组)。另外取10只SD大鼠,除不结扎之外,其他步骤与模型组相同(假手术组)。2组大鼠于术后予青霉素4万U每只,腹腔注射6 d,预防感染。饲养至8周。
1.2.2 大鼠心室肌细胞的分离 采用改进的酶解法制备大鼠心室肌单细胞。每组大鼠首先肝素化(腹腔注射100 IU/ml),用20%乌拉坦(1.00 mg/kg)麻醉,后迅速取其心脏,在37℃和通氧条件下行Langendorff灌流:用无Ca2+Tyrode′s液灌流3~5 min,用含胶原酶Ⅱ 70 mg、胰蛋白酶12 mg的无Ca2+Tyrode′s液(50 ml)灌流20~25 min。沿房室间沟取心室肌,剪碎入KB液中并吹打使细胞脱落,-4℃保存,1 h后进行实验。
1.2.3 细胞分组 37℃环境下,取模型组细胞保存液加于1 ml灌流槽中,待细胞贴壁后,给予200.0 μmol/L终浓度的All,于倒置显微镜下选择边缘整齐、表面无颗粒、横纹清晰、无收缩的心室肌细胞进行检测(给药组)。其给药方式为:将All用二甲基亚砜溶解,并制备成储备液,细胞外液稀释成200.0 μmol/L终浓度;采用局部灌流装置于细胞外恒流灌流方式对给药组进行给药,为确保药物效应的一致性,待平衡5 min后方可记录电流[7]。同样取模型组细胞(不给药,心力衰竭组)或假手术组细胞(对照组)加于灌流槽中,除不加药外,其余步骤均与给药组一致。根据检测指标不同,分别选取不同个数细胞进行观察。
1.2.4 全细胞膜片钳记录 数据记录采用软件(pCLAMP 10.2)。采用全细胞膜片钳记录方法,在电压钳制下记录电流。将Axon-700B膜片钳放大器(Sunnyvale,美国)同计算机连接,刺激信号及电压输入信号应用Digidata 1440A数模转换器(Sunnyvale,美国)收集。GG-17玻璃毛坯经pp-83微电极拉制仪(Narishige公司,日本)拉制成电阻为2.0~5.5 MΩ的电极。调节三维操纵器进行封接,使封接电阻达1 GΩ以上,吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4 V/s的斜坡刺激,按方程Cm=I/(dV/dt)计算(Cm为膜电容,I为电流值,dV/dt即电压斜率)。为消除细胞间的误差,I值以电流密度(pA/pF)表示。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波,采样率为5 kHz。串联电阻补偿90%~95%以消除电压偏差,液接电位补偿校正至<2 mV,慢电容补偿约为85%~90%,以消除膜电容的充放电影响。
1.2.5 指标检测及参数设置 (1)DAD和TA。电流钳模式下,钳制电位0 mV,1 500 pA持续10 ms的20个串刺激,频率4.0 Hz,记录动作电位。DAD被定义为在4期紧接着正常动作电位后出现的去极化幅值>5 mV、持续时间>10 ms的自动去极化波形;TA被定义为在DAD的基础上出现的一个自发性动作电位,其特征是0相有明显自发性除极[9]。(2)ICa,L电流及门控机制。稳态激活曲线:保持电位-40 mV,施予150 ms,阶跃10 mV,-40 mV~+40 mV的系列去极化脉冲,记录ICa,L和ICa,L,max。标准化各电流幅值,以相对电流对各膜电位作图得稳态激活曲线(电流-电压图)。稳态失活曲线:保持电位-40 mV,施予500 ms,阶跃10 mV,-70 mV~+40 mV的系列去极化脉冲,在每一条件脉冲后紧跟一固定去极化至0 mV,150 ms的测试脉冲,记录ICa,L和ICa,L,max,用Boltzmann方程ICa/ICa,max=1/{1+exp[(Vm-V1/2)/k]}拟合求半数失活电压V1/2inact。(3)瞬时内向电流(transient inward current,Iti)。在电压钳方式下,给予20个方波预刺激,-80 mV~+50 mV,150 ms,每组刺激间隔100 ms,之后给予2 000 ms、-100 mV~+200 mV的测试刺激,引出Iti。Iti被定义为:波峰与电流基线之间的差值,按第一个出现的波形进行分析。(4)Na+/Ca+交换电流(Na+/Ca+exchange current,INCX)。在电压钳方式下,采用斜坡刺激的模式引出INCX电流。钳制电位为-60 mV,去极化至+80 mV,持续400 ms,以90 V/s的速率复极并超极化至-120 mV,此后恢复到-60 mV。(5)钙瞬变。取急性分离好的心室肌细胞500 μl于新的试管中,应用BSA混悬液稀释至1 ml,加入Fluo 4-AM钙荧光染料(1∶500稀释),水平摇床上反应20 min。试管中加入台式液至8 ml,离心机10 000转/min离心20~200 s,倾去上清液,应用BSA混悬液重悬细胞。取100 μl染色的心室肌细胞悬液加入备好的共聚焦小皿中,静置1 h,待细胞贴壁稳定后,将共聚焦小皿放置共聚焦显微镜上,刺激电极放置共聚焦小皿中,没入台式液,给予不同频率刺激,观察钙瞬变和钙离子浓度等指标。
1.3 统计学处理
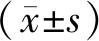
2 结 果
2.1 3组大鼠心室肌细胞DAD和TA发生率比较
每组选取15个细胞进行检测。对照组、心力衰竭组及给药组细胞上DAD和TA发生率依次为[13.3%(2/15),0.0%(0/15)]、[60.0%(9/15),26.7%(4/15)]和[40.0%(6/15),13.3%(2/15)]。与对照组比较,心力衰竭组细胞DAD和TA发生率显著增加;与心力衰竭组比较,给药组细胞上DAD和TA发生率显著下降,下降幅度分别为20.0%和13.4%,差异均有统计学意义(P<0.01;图1)。说明All对心力衰竭大鼠心室肌细胞的DAD和TA均有一定抑制效应。
2.2 3组大鼠心室肌细胞ICa,L变化比较
每组选取15个细胞进行观察。与对照组比较,心力衰竭组细胞膜上的ICa,L密度显著增大;与心力衰竭组比较,给药组ICa,L密度显著减小,差异均有统计学意义(P<0.01;图2A,B)。在刺激电位为0 mV时,与对照组(-11.5±0.4)pA/pF比较,心力衰竭组细胞ICa,L的电流密度增加至(-17.2±0.9)pA/pF;与心力衰竭组比较,给药组细胞电流密度则降低为(-13.5±1.0)pA/pF,差异均有统计学意义(P<0.01;图2C)。但3组稳态激活曲线比较差异无统计学意义(P>0.05)。与对照组[(-26.5±3.9)mV]比较,心力衰竭组细胞钙电流的V1/2,inact移向更正的电位为(-7.2±1.9)mV(P<0.01);与心力衰竭组比较,给药组细胞钙电流的V1/2,inact恢复至(-18.5±2.5)mV(P<0.01)。且3组稳态失活曲线比较差异有统计学意义(P<0.01;图2D)。以上结果提示心力衰竭时钙电流增加,主要可能通过稳态失活曲线向去极化电位移动,导致相同电位刺激时通道失活速率减慢,而应用All可以抑制此现象。
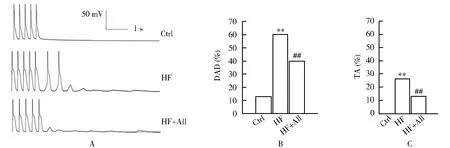
图1 3组大鼠心室肌细胞DAD和TA发生率比较Figure 1 Effects of allicin on DAD and TA in ventricular myocytes of heart failure ratsA:the original recording diagram of DAD and TA in ventricular myocytes;B:histogram of DAD incidence;C:histogram of TA incidence. Ctrl:control group;HF:heart failure group;All:allicin;DAD:delayed afterdepolarization;TA:triggered activity. Compared with control group,**P<0.01;compared with heart failure group,##P<0.01.

图2 3组大鼠心室肌细胞ICa,L变化比较Figure 2 Comparison of ICa,L in ventricular myocytes among three groupsA:original recording diagram of peak calcium current in ventricular myocytes;B:changes in peak ICa,L density;C:current-voltage curve of ICa,L; D:homeostasis inactivation curve of ICa,L.Ctrl:control group;HF:heart failure group;All:allicin.Compared with control group,**P<0.01; compared with heart failure group,##P<0.01.
2.3 3组大鼠心室肌细胞Iti变化比较
每组选取10个细胞进行观察。与对照组比较,心力衰竭组细胞Iti电流密度显著增加;与心力衰竭组比较,给药组细胞Iti电流密度又显著下降(P<0.01;图3A,B)。电流-电压图(图3C)显示,在-50 mV去极化时,对照组的内向峰电流密度为(-0.23±0.01)pA/pF,而心力衰竭组细胞显著增加至(-1.05±0.06)pA/pF;与心力衰竭组比较,给药组则又显著降低为(-0.53±0.05)pA/pF,差异均有统计学意义(P<0.01)。Iti电流在-50 mV去极化时最大,在更负或更正的刺激电位时,电流幅值均减少。其中心力衰竭组电流密度在-90 mV~+10 mV刺激下增加最为明显,而在+20 mV以上电位刺激时,Iti呈现出外向电流特征。
2.4 3组大鼠心室肌细胞INCX变化比较
每组选取10个细胞进行观察。INCX分为内向(顺向)和外向(逆向)电流。其中内向电流为3个钠离子内流及一个钙离子外排所致,外向电流反之。与对照组比较,心力衰竭组内向电流密度从(-3.2±0.1)pA/pF显著增加至(-5.8±0.7)pA/pF(P<0.01);而与心力衰竭组比较,给药组电流密度则显著恢复至(-4.2±0.4)pA/pF(P<0.01;图4)。外相电流变化不大。
2.5 3组大鼠心室肌细胞内钙瞬变和钙离子浓度比较
每组选取15个细胞进行观察。与对照组比较,心力衰竭组细胞静息态钙浓度、钙瞬变幅度和胞内钙峰值50%的时间等参数显著升高(P<0.01);与心力衰竭组比较,上述参数在给药组细胞中均显著降低(P<0.01;图5A,B,图6A,B,C)。心力衰竭后大鼠心室肌细胞内钙瞬变衰减率与对照组比较显著下降,而应用All后,得到显著恢复(P<0.05;图6D)。

图3 3组大鼠心室肌细胞Iti变化比较Figure 3 Comparison of Iti in ventricular myocytes among three groupsA:original recording diagram of Iti in ventricular myocytes;B:changes in peak Iti density;C:current-voltage curve of Iti.Ctrl:control group;HF:heart failure group;All:allicin.Compared with control group,**P<0.01;compared with heart failure group,##P<0.01.
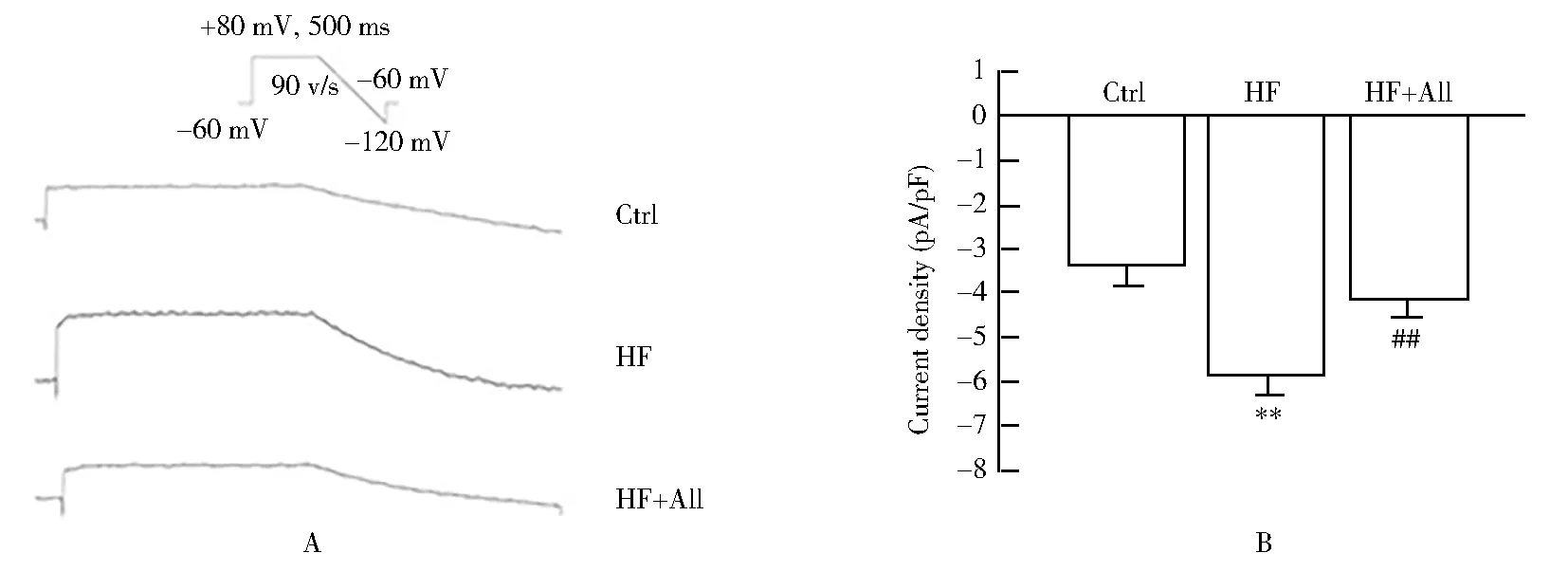
图4 3组大鼠心室肌细胞INCX变化比较Figure 4 Comparison of INCX in ventricular myocytes among three groupsA:original recording of INCX in ventricular myocytes;B:changes in peak INCX density.Ctrl:control group;HF:heart failure group;All:allicin. Compared with control group,**P<0.01;compared with heart failure group,##P<0.01.

图5 3组大鼠心室肌细胞内钙浓度的比较Figure 5 Comparison of calcium concentration in ventricular myocytes among three groupsA:fluorescence image of the calcium ions in ventricular myocytes;B:intracellular calcium ion concentration in resting state.Ctrl:control group; HF:heart failure group;All:allicin.Compared with control group,**P<0.01;compared with heart failure group,##P<0.01.
图6 3组大鼠心室肌细胞内钙瞬变的比较Figure 6 Comparison of intracellular calcium transients in ventricular myocytes among 3 groupsA:intracellular calcium waves change of ventricular myocytes in 3 groups;B:cell calcium transient amplitude changes;C:transient time of 50% peak calcium;D:changes in the transient decay rate of calcium.Ctrl:control group;HF:heart failure group;All:allicin.Compared with control group,**P<0.01;compared with heart failure group,#P<0.05,##P<0.01.
3 讨 论
心力衰竭致心律失常作用是电重构的不良后果,心力衰竭除心功能不全引起的血流动力学障碍外,还因心脏电重构引发恶性心律失常导致猝死。而心力衰竭后触发性心律失常则是猝死的主要原因[10,11]。本研究显示,All可以降低心力衰竭时心室细胞DAD和由此引起的触发性心律失常的发生,使其分别降低20.0%和13.4%,这可能为心力衰竭后心律失常的防治提供新的潜在药物。
窦房结的冲动产生动作电位使整个心脏出现节律性搏动。每一动作电位末期常伴有一个缓慢的除极波。正常情况下,该波随动作电位的恢复而消失。心力衰竭时,其可增大或产生若干除极波,即DAD或振荡后电位,该电位增高达到阈值时,则发出新的动作电位,从而形成期前收缩,如此产生连续冲动,则形成心动过速,产生TA而导致触发性心律失常[12]。DAD是诱发触发性心律失常的主要原因之一,其发生在4相复极后,主要由Iti引起。Iti电流的载流离子主要是钙离子和钠离子,直接受INCX和细胞内钙离子的调控,也有少部分受钙激活氯电流(ICl,Ca)和非选择性阳离子稳态电流(Isus)的影响[13-15]。其中,细胞内钙离子超载起着关键性作用,故凡是引起细胞内Ca2+超载的因素都可促发这一离子流,从而产生DAD或TA。反之,抑制细胞内Ca2+超载,降低Iti电流,则可减少DAD和TA的发生[16,17]。本研究结果显示,All可减少心力衰竭时细胞内钙瞬变,降低钠钙交换体内向电流的增加,直接或间接降低Iti电流,特别是内向电流的增加,同时缓解ICa,L的升高。因此,All通过抑制多个离子流和细胞内钙离子的改变,减少了心力衰竭DAD及由此引发的TA的发生,为缓解心力衰竭时SCD的干预提供了可能,也为该药物的研发提供了部分实验依据。
然而,All是否影响参与心力衰竭时细胞内钙离子改变的蛋白尚未可知,也无法得知其对细胞内钙作用的分子基础,同时也未在整体动物层面就All对心力衰竭后触发性心律失常的效应进行探究,因此,本课题下一步工作需要对上述问题进行探究。
