直面异常现象,探究现实问题
2019-05-28陈潇潇
陈潇潇


摘要:从化学必修2“化学能与电能”一节教学中出现的科学性问题和异常实验现象出发进行了教学设计的反思与改进,对原电池的形成条件进行了细化的解读,借助物理知识将原电池的形成条件修正为有氧化还原反应等电子转移过程的反应、形成闭合回路、两极形成电势差。
关键词:原电池;形成条件;异常现象;电势差
文章编号:1008-0546(2019)05-0075-03
中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.05.023
人教版化学必修2“化学能与电能”一节的教学难点在于,让学生从电子转移的角度去理解化学能向电能转化的本质,并学会设计简单单液原电池的方法。在常规教学中,老师们总结的形成原电池的条件一般都是:(1)要有能自发进行的氧化还原反应;(2)两个活泼性不同的电极;(3)电极与电解质溶液接触;(4)形成闭合回路。而这四个条件经过科学证实存在科学性错误,比如原则上任何氧化还原的半反应都可以设计成半电池,两个半电池连通,都可以形成原电池。而两个氧化还原半反应的总反应可能是氧化还原反应,也可能是非氧化还原反应;再比如:氢氧燃料电池中的两极都为石墨棒,并不存在“活泼性不同的两极”。徐敏主张将电极电势的概念引入原电池教学,让学生认识原电池中电子转移的本质,使学生习得真实、科学的知识。基于此,本文站在科学性的角度,不回避实验中产生的异常现象,对必修2“化学能与电能”一节第一课时的教学进行了反思与改进,总结原电池形成的条件为:有氧化还原反应等电子转移过程的反应、形成闭合回路、两极形成电势差。
一、以氢氧燃料电池引入从能量转化角度认识原电池
人教版必修2教材中以铜片、锌片为素材引导学生设计的铜锌原电池简单易行,但容易给学生带来以下迷思概念:(1)zn失去电子,Cu得到电子,是因为zn比cu活泼,而恰恰锌片和铜片作为导体,直接将其作为两极,所以学生产生了“用活泼性不同的两极来设计原电池”的错误认知,导致学生在随后设计原电池的过程中都在寻找“活泼性不同的两极”;(2)zn为什么会失去电子?学生往往是从金属活泼性的角度去思考,认为“活泼的金属会失去电子,作负极”,而不是从氧化剂和还原剂的角度去考虑,当设计的原电池中不涉及有金属单质参与的反应时,学生往往显得无所适从;(3)铜锌原电池中涉及到的是氧化还原反应,学生会以为“只有氧化还原反应才可以设计成为原电池”,不利于今后学习“浓差电池”等不存在氧化还原反应的电池。
基于此,在教学中我们可以通过2017年11月份“丰田研发的氢燃料电池车在中国开始实证实验”这一新闻报道为情境线索,向学生介绍将氢气和氧气反应过程中产生的化学能转化为电能不需要通过“化学能一热能一机械能一电能”多个环节,借助氢氧燃料电池的巧妙设计可以实现化学能到电能的高效率转化。再通过自制“简易氢氧燃料电池”的小实验,将新闻报道中高端的工业设计在课堂中变成看得见的实验现象,激发起学生对原电池的研究兴趣。
[演示实验:自制“简易氢氧燃料电池”]预先将两根石墨棒淬火,后插入带橡胶塞的u型管中电解硫酸钠溶液,一段时间后石墨棒两极储存了氢气和氧气,将两极与检流计或小功率用电器相连,发现产生了电流。
[引入阶段的驱动性问题](1)氢氧燃料电池中的能量转化形式是怎样的?相比火力发电有何优点?(2)氢氧燃料电池中的电子从何而来?(3)能否将其他反应设计成原电池?
[学生认识发展脉络]氢气和氧气只有点燃才能发生化学反应一不点燃氢气和氧气,也可以让二者发生化学反应,实现化学能到电能的一步转化一若一个反应中有电子转移,可以尝试依托该反应设计原电池。
二、聚焦铜锌原电池中的错误设计与异常现象物理知识协同教学
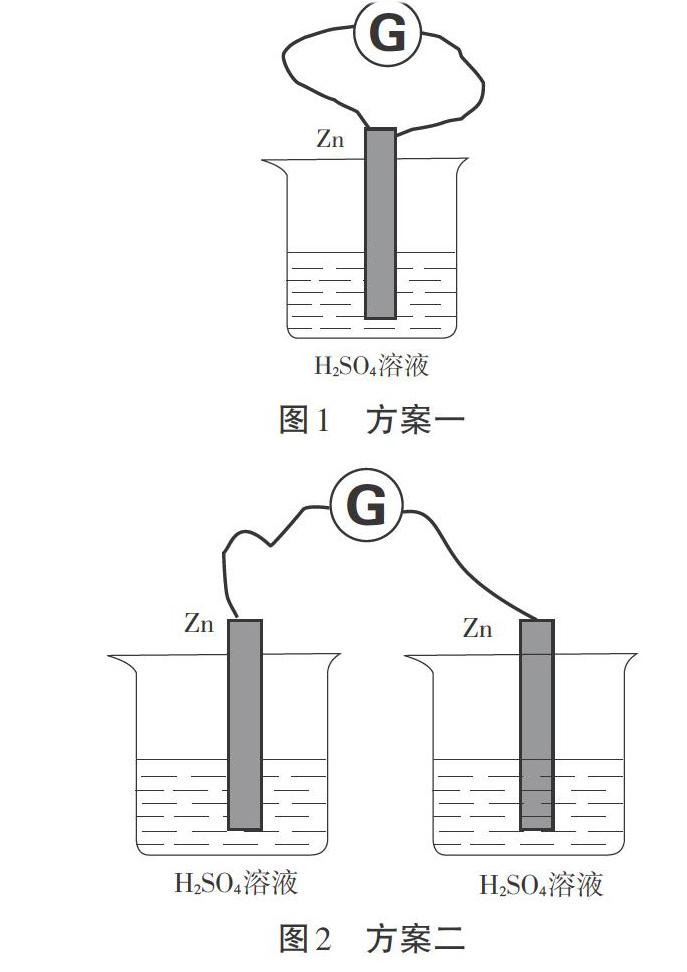
经过前面对氢氧燃料电池的认识,老师给学生抛出了一个原电池设计的任务:给定反应zn+H2SO4=ZnSO4+H2↑设计一个原电池。这个时候学生的设计未必完美,可能有方案一和方案二两种错误设计(图1、图2)。
方案一与方案二的失败设计中检流计不能检出电流,我们将问题回归到电流产生的基本条件上来,人教版九年级物理第15章第二节中讲到:“导线中电子的定向移动形成电流,”具体到原电池的设计,我们将问题聚焦到“从哪儿可以获得电子?”和“如何让电子定向移动?”两个驱动性问题上来。学生很容易想到氧化还原反应中存在电子转移,借助氧化还原反應可以获得电子,同时,也有部分同学想到了物理中学习过的电子定向移动的条件——闭合回路中存在电势差。就此引导学生得到了原电池形成的条件:有电子得失的过程、形成闭合回路、两极有电势差。这种从物理中“电流的产生条件”出发来探究原电池形成条件的设计看似难度比较大,但在实际教学中,我们发现学生其实是很容易接受的。反而是避而不谈“电动势”、“半反应”的问题,会让学生对电子定向移动的“原动力”产生疑惑。
1.Zn-Zn-H2SO4(aq)原电池一定是失败设计吗?
有学生受到“形成闭合电路”的启发,却未考虑电势差的问题,会设计出第三种方案(图3),很多老师认为这种方案中不会检测得到电流,是一种失败设计。
事实上,如果两侧锌片纯度不同,是会形成浓差电池而产生电流的,学生在实验中也发现检流计的指针是可以发生轻微偏转的(1mol/L稀硫酸,约为7mA)。如果此刻我们粗暴地断定这种设计不可能成功,那学生在学习Ag,AgCll HCl(α1) HC1(α2) AgCl,Ag这种经典溶液浓差电池时会产生相当大的困惑。在教学中我们可以不回避这个异常现象,而是让学生讨论产生电流的原因:在方案三中两个电极处发生的半反应虽然相同,但锌片不纯等因素会导致在导线两端产生电势差,从而形成了微弱的电流。这种设计满足了“有电子得失的过程”“形成闭合回路”“两极有电势差”的要求,但电流太小,说明这种电势差并不大,化学能转化为电能的效率并不高。老师借机抛出下一个驱动性问题:“如何增大两侧电极的电势差?”学生经过尝试,给出了方案四(图4)铜锌原电池的设计,检测出了比较大的电流。Zn-Zn-H2SO4(aq)原电池的成功看似是受实验材料纯度影响的一种失败设计,但在课堂教学中,老师如果可以将其作为解决“电势差较小,电流较小,如何获得较大电流?”这一问题的一个过渡,将会加深学生对电势差与原电池产生的电流强度之间关系的理解,为之后设计电势差较大的铜锌原电池做好铺垫。
学生在方案四(图4)中检测到了比较大的电流,分析电子流向,我们发现得失电子不再是“同时同地”的,而是“同时异地”进行,这是增大导线两端电势差的关键方法。至此,很多老师在教学中会说“锌片失去了电子,氢离子在铜片处得到了电子,所以在铜片处我们可以看到大量气泡”。然而在实际教学中发现:不仅在铜片处产生了气泡,在锌片处也产生了非常大量的气泡。锌与稀硫酸直接接触,除去锌片不纯的原因,氢离子在金属锌表面反应的电极电位为0.7V,而该反应的AE=E(H+/H2)-E(Zn2+/Zn)=0-(-0.76V)=0.76V,仍存在一定的电极电位差(0.76V-0.7V=0.06V),所以从理论上来讲不管锌片纯净与否,锌片处产生气泡都是非常正常的现象。很多老师避而不谈这个实验现象,或者简言之是“锌片与稀硫酸直接反应了,是因为锌片不纯的缘故”,实际上并没有真正从科学性的角度打消学生心中的疑惑。
针对这个异常现象,老师在上课过程中不妨大大方方的拿出来探讨,虽然不必介绍电极电位的相关理论,但却可以理直气壮地告诉学生:“锌片上产生大量气泡说明锌并没有将电子全部通过导线传递给H+,而是直接与其反应了。这是一个“副反应”或“我们不愿意其发生的反应”,但这个反应在这种设计中不可避免。我们该如何改良我们的设计,使电子转移的效率更高,从而获得更多的电能?”双液双池原电池刚好可以解决这个问题,我们在此处埋下伏笔,为学生在选修4中学习盐桥和双液双池原电池打下了基础,形成了关于原电池的整体设计。
[驱动性问题](1)初中物理中所介绍的导线中形成电流的条件是什么?(2)方案三中,形成原电池的条件满足了哪些?(3)电解质溶液为什么会导电?(4)电极两侧的电势差是如何产生的?(5)如何使得方案三中原电池产生的电流更强?(6)方案四中较大的电势差是如何形成的?
[学生认知发展脉络](1)结合物理知识,知道电子在导线中的定向移动会形成电流,电子可以来自于氧化还原反应;定向移动需要两个条件:闭合回路和电势差。
(2)如何形成闭合回路?内电路溶液中离子的移动起到传递电荷的作用,协助形成闭合回路,外部导线要与导体相连。
(3)如何形成电势差?锌片与稀硫酸反应时的两个半反应的电极电位不同存在电势差,但二者直接接触时得失电子“同时同地”进行,没有创设电子移动的条件,让得失电子在不同区域“同时异地”进行,促使电子在导线中进行移动,电子在导线中定向移动,形成了电流。
三、回归科学本质细化原电池的形成条件
借助物理知识,我们在分析方案一、二的失败原因时已经总结出原电池的形成條件为:有电子得失的过程、形成闭合回路、两极有电势差。再结合我们中学所学知识,我们将抽象的理论知识细化为操作性强的形成条件:(1)有电子得失的过程——可以依托氧化还原反应来设计原电池。虽然部分非氧化还原反应也可以设计成为原电池,但高中阶段不予讨论。(2)形成闭合回路——用可以导电的物质作电极、有电解质提供可移动的离子并创设离子定向移动的条件(水溶液或熔融状态),用导线连接形成闭合回路。(3)两极有电势差——让得失电子的过程在不同区域进行。本质是借助不同物质转化时的电极电位不同形成电势差,电子在定向移动过程中形成电流。
四、反思
课本当中的知识点和实验有它的局限性,它仅仅是起到“抛砖引玉”的作用,老师备课应该站在更高的视角来分析简单原理背后的深刻内涵,才能在教学中深入浅出。在涉及到交叉学科知识点时,更应该运用多学科知识协同教学,让学生形成“理科综合体”的意识。从必修到选修,课程内容上的升华也促使老师们认真解读课本,形成关于知识体系的整体教学,必修阶段的教学如果能够串联选修知识的学习,甚至激发起学生进一步深入研究大学化学的兴趣来,才算真正实现了目前所提倡的深度学习。