大鼠骨骼肌挫伤后TGF-β1及EⅢA-FN的表达与损伤时间推断
2019-05-28刘冉葛鲁邹张海东赵东侯伟良鄂晓霏于天水
刘冉 ,葛鲁邹 ,张海东 ,赵东 ,侯伟良 ,鄂晓霏 ,于天水
(1.司法文明协同创新中心,北京 100088;2.中国政法大学 证据科学教育部重点实验室,北京 100192;3.威海市公安局高区分局,山东 威海 264200)
骨骼肌分布广泛,是暴力损伤中极易受累的器官,因而在实践中骨骼肌损伤发生率较高,是鉴定实践中常见的损伤类型。骨骼肌损伤修复机制、骨骼肌损伤形成时间以及骨骼肌损伤程度判断一直受到法医学工作者重视。其中骨骼肌损伤形成时间推断对刑事案件侦查具有重要意义,然而,准确地推断骨骼肌损伤时间一直是法医学鉴定中的难题。本课题组前期相关研究[1]未考虑死后环境因素(温度与湿度)对所研究指标的影响,亦未考虑所研究指标分别在生前伤和死后伤中的表达情况。鉴于以上问题,本课题组将寻找参与骨骼肌损伤修复过程、死后表达具有良好的时间相关性以及可以鉴别生前伤与死后伤的指标,拟建立推断骨骼肌损伤时间相关参考指标的数据库,利用多指标对法医学实践中的骨骼肌损伤时间进行准确推断。
转化生长因子β1(transforming growth factor β1,TGF-β1)是成纤维细胞的主要趋化因子,是直接诱导成纤维细胞(fibroblast)向肌成纤维细胞(myofibroblast)转化最重要的细胞因子[2]。在正常损伤愈合和病理状态下,粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)通过刺激TGF-β1的产生来诱导α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)在肌成纤维细胞中合成,导致富含该细胞的肉芽组织形成[3]。但TGF-β1发挥作用还受到细胞外基质条件和细胞表面受体的限制。其中,纤连蛋白EⅢA片段(EⅢA-fibronectin,EⅢA-FN)是TGF-β1诱导成纤维细胞向肌成纤维细胞转化的关键分子[4]。选择性封闭EⅢA会阻碍TGF-β1诱导α-SMA的产生,但EⅢA及FN自身并不能诱导α-SMA的表达。EⅢA序列能引起FN构象的改变,增加FN与其细胞表面黏附受体整合素结合的机会,后者激发基质信号的转导途径,可增加细胞对TGF-β1的敏感性[5]。总之,TGF-β1和EⅢA-FN参与了骨骼肌损伤后纤维化级联反应的起始阶段,与损伤时间具有良好的相关性。
因此,本研究拟在上述研究成果的基础上,通过大鼠骨骼肌挫伤动物模型的建立,应用免疫组织化学染色和实时荧光定量PCR技术,分别研究生前损伤、生前损伤死后以及死后损伤不同时间点TGF-β1和EⅢA-FN的分布与动态表达,旨在为法医病理学损伤时间推断提供参考依据。
1 材料与方法
1.1 动物分组
健康成年雄性SD大鼠180只,体质量390~410g,随机分为正常对照组(5只)、生前挫伤组(40只)、生前挫伤死后表达组(110只)和死后挫伤组(25只)。
正常对照组大鼠不予致伤。
生前挫伤组于8个时间点取材,分别为伤后6h、12 h、24 h、3 d、5 d、7 d、10 d、14 d,在预设的时间处死大鼠,当即取材,每个时间点5只大鼠。以正常对照组大鼠为对照。
生前挫伤死后表达组中,将55只伤后3d和55只伤后5d的大鼠处死后置于温度为(25±2)℃、相对湿度为(60±5)%的台式高低温交变湿热箱(多禾试验设备有限公司)内,分别于死后0 h、3 h、6 h、12 h、24 h、2d、3d、4d、5d、6d、7d进行取材,每个时间点5只大鼠,以死后0h大鼠为对照。伤后3d大鼠提取的所有死后组织均用于TGF-β1的实时荧光定量PCR检测,伤后5 d大鼠提取的所有死后组织则用于EⅢA-FN的实时荧光定量PCR检测。
死后挫伤组分别于大鼠死后0.5 h、1 h、3 h、6 h、12h对其致伤,伤后立即取材,每个时间点5只大鼠,以正常对照组以及生前挫伤后6h、10d和14d处死的大鼠为对照。
1.2 大鼠骨骼肌挫伤模型的制作
本课题组前期已成功建立了大鼠骨骼肌挫伤模型[1]。2%戊巴比妥钠溶液腹腔注射(30 mg/kg)麻醉,于右下肢剪毛备皮。将大鼠后肢置于伸膝、踝背屈90°位置,用自制打击器(质量为500 g)打击大鼠右下肢距跟骨2.5 cm处。此时,皮肤仍保持完整,胫腓骨无骨折,损伤后不给予任何处理,每只大鼠分笼饲养并给予饲料及水,保持垫料清洁及空气通畅。
各挫伤组大鼠按预设时间点颈椎脱臼处死,取右下肢损伤区肌肉进行检验。正常对照组和生前挫伤组大鼠样本一部分立即用4%多聚甲醛中性溶液固定1 d,常规脱水、透明、浸蜡、包埋及制作5 μm厚切片,用于免疫组织化学染色;另一部分立即提取RNA溶液3 μL,-80℃冰箱保存,用于实时荧光定量PCR检测。生前挫伤死后表达组和死后挫伤组大鼠样本仅进行实时荧光定量PCR检测,处理同生前挫伤组。
1.3 免疫组织化学染色
切片脱蜡、水化,水煮修复后用3%过氧化氢溶液灭活,正常非免疫山羊血清孵育,兔抗大鼠TGF-β1多克隆抗体(1∶100,sc-146,美国Santa Cruz公司)和小鼠抗大鼠 Fibronectin[IST-9]单克隆抗体(1∶200,ab6328,英国Abcam公司)分别作为一抗,应用免疫组织化学染色技术(SP法)进行染色,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素核复染。以磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作为空白对照。
1.4 逆转录反应
按PrimeScriptTMRT试剂盒[DRR037S,宝生物工程(大连)有限公司]操作说明书,将1μg RNA逆转录为cDNA。20 μL反应体系如下:已配好的RNA工作液(0.5 μg/μL) 2 μL、5×PrimeScriptTM缓冲液 4 μL、PrimeScriptTM逆转录混合酶Ⅰ 1μL、寡聚胸腺嘧啶引物1μL、随机的六核苷酸引物1μL、去RNA酶蒸馏水11 μL。放入2 mL薄壁PCR反应管中,瞬时离心混匀,置于PTC-100型PCR仪(美国MJ Research公司)中,37℃孵育15min(逆转录反应),85℃孵育5s(逆转录酶失活反应)。
1.5 实时荧光定量PCR检测
应用PRISM®7500 Real-Time PCR System(美国AB公司),以逆转录所得cDNA为模板在96孔板内进行PCR扩增。按照SYBR®Premix Ex TaqTMⅡ[DRR081S,宝生物工程(大连)有限公司]试剂盒要求配制20 μL反应体系:SYBR®Premix Ex TaqTMⅡ10μL、上游引物0.8μL、下游引物0.8μL、ROX Reference Dye Ⅱ 0.4 μL、cDNA溶液2 μL、蒸馏水6 μL。所有引物均由宝生物工程(大连)有限公司设计,内参基因RPL13、TGF-β1基因(Tgfb1)和EⅢA-FN基因(Fn1)的引物序列见表1。两步法PCR扩增标准程序:95℃ 30s预变性;95℃ 5s,60℃ 34s,40个循环;95℃ 15s,60℃ 30s,95℃ 15s,采集荧光信号,绘制熔解曲线。为了排除潜在污染,每次上机都用蒸馏水代替cDNA作为阴性对照。阴性对照未见扩增产物。
1.6 统计学处理
实时荧光定量PCR结果由PRISM®7500 Real-Time PCR System自动采集给出目的基因和内参基因的Ct值,基因表达量采用 2-ΔΔCt进行计算,其中ΔΔCt=ΔCt实验组(Ct目的基因-Ct内参基因)-ΔCt对照组(Ct目的基因-Ct内参基因)。采用SPSS 13.0软件进行单因素方差分析,检验水准α=0.05。

表1 引物序列
2 结 果
2.1 正常对照组与生前挫伤组大鼠骨骼肌TGF-β1和EⅢA-FN的免疫组织化学染色结果
正常对照组大鼠骨骼肌胞质及间质血管内皮细胞表达TGF-β1,骨骼肌胞质内弱表达EⅢA-FN。
伤后6 h,少量多形核白细胞(polymorphonuclear leukocyte,PMN)和单个核细胞(mononuclear cell,MNC)分别微弱表达TGF-β1和EⅢA-FN。伤后12~24 h,大量PMN和MNC强表达TGF-β1和EⅢA-FN。伤后3~14 d,挫伤区开始出现成纤维样细胞(fibroblastic cell,FBC)、新生血管及新生多核肌管,并且表达TGF-β1。而EⅢA-FN主要分布于细胞外基质,并于伤后3~7d表达逐渐增多,之后表达减少。TGF-β1和EⅢA-FN的蛋白表达变化见图1~2。

图1 生前挫伤组大鼠骨骼肌不同时间点TGF-β1的表达(SP×400)
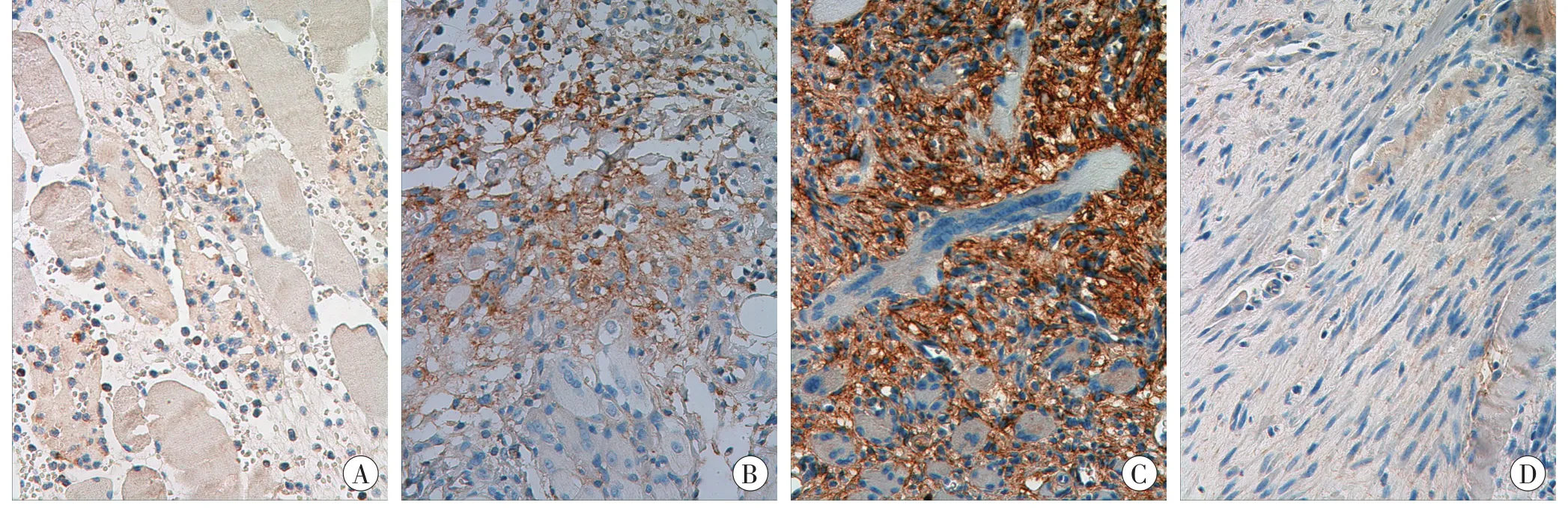
图2 生前挫伤组大鼠骨骼肌不同时间点EⅢA-FN的表达(SP×400)
2.2 生前挫伤组大鼠骨骼肌TGF-β1和EⅢA-FN mRNA的表达
与正常对照组比较,生前挫伤组大鼠骨骼肌TGF-β1 mRNA的表达于伤后6 h轻微减少,而后逐渐增加,至3d达到峰值,再逐渐下降,至伤后10~14d接近正常对照组水平。其中,伤后3d,TGF-β1 mRNA的表达平均值为12.91,表达值范围为11.84~14.03,高于其他时间点TGF-β1 mRNA的表达值(P<0.05)。结果见表2。
与TGF-β1 mRNA的表达趋势相似,EⅢA-FN mRNA的表达亦于伤后6h减少,然后快速升高,于伤后5 d到达高峰,随后下降,并于伤后10 d开始略低于对照组水平。其中,伤后5 d,EⅢA-FN mRNA的表达平均值为5.34,表达值范围为4.26~6.21,其他时间点EⅢA-FN mRNA的表达值均低于4.26。经统计,伤后5 d、7 d EⅢA-FN mRNA的表达与其他时间点之间差异均具有统计学意义(P<0.05)。结果见表2。
2.3 生前挫伤死后表达组大鼠骨骼肌TGF-β1和EⅢA-FN mRNA的表达
生前挫伤死后表达组中,和死后0h相比,TGF-β1和EⅢA-FN mRNA的表达值分别于死后3h和6h开始增加,并分别于死后6h和12h达到峰值,然后逐渐下降至死后7 d。经统计,死后不同时间点TGF-β1 mRNA的表达与死后0h之间差异均具有统计学意义(P<0.05);除死后3h、24h和2d外,其他时间点EⅢAFN mRNA的表达与死后0h之间差异均具有统计学意义(P<0.05)。结果见表3。
2.4 死后挫伤组大鼠骨骼肌TGF-β1和EⅢA-FN mRNA的表达
死后挫伤组中,死后0.5~12h TGF-β1和EⅢAFN mRNA的表达情况见表4。死后不同时间点TGF-β1和EⅢA-FN mRNA的表达值均明显低于正常对照组及生前挫伤后6h、10d和14d处死的大鼠,而在死后不同时间点之间TGF-β1或EⅢA-FN mRNA的表达差异无统计学意义(P>0.05)。
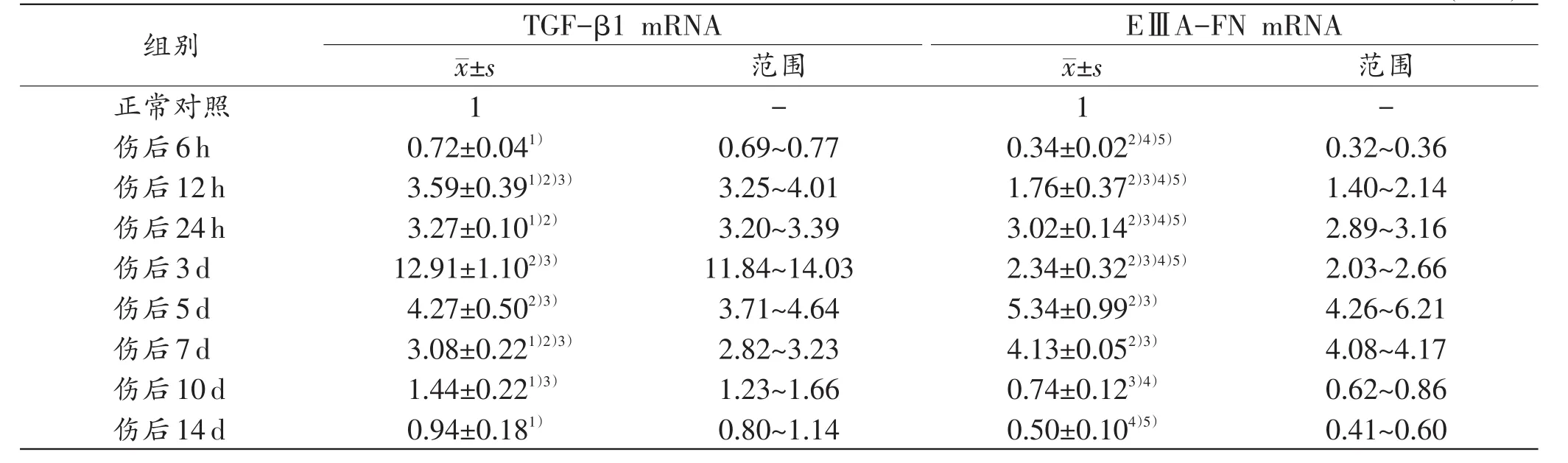
表2 生前挫伤组大鼠骨骼肌不同时间点TGF-β1和EⅢA-FN mRNA的表达平均值及范围 (n=5)
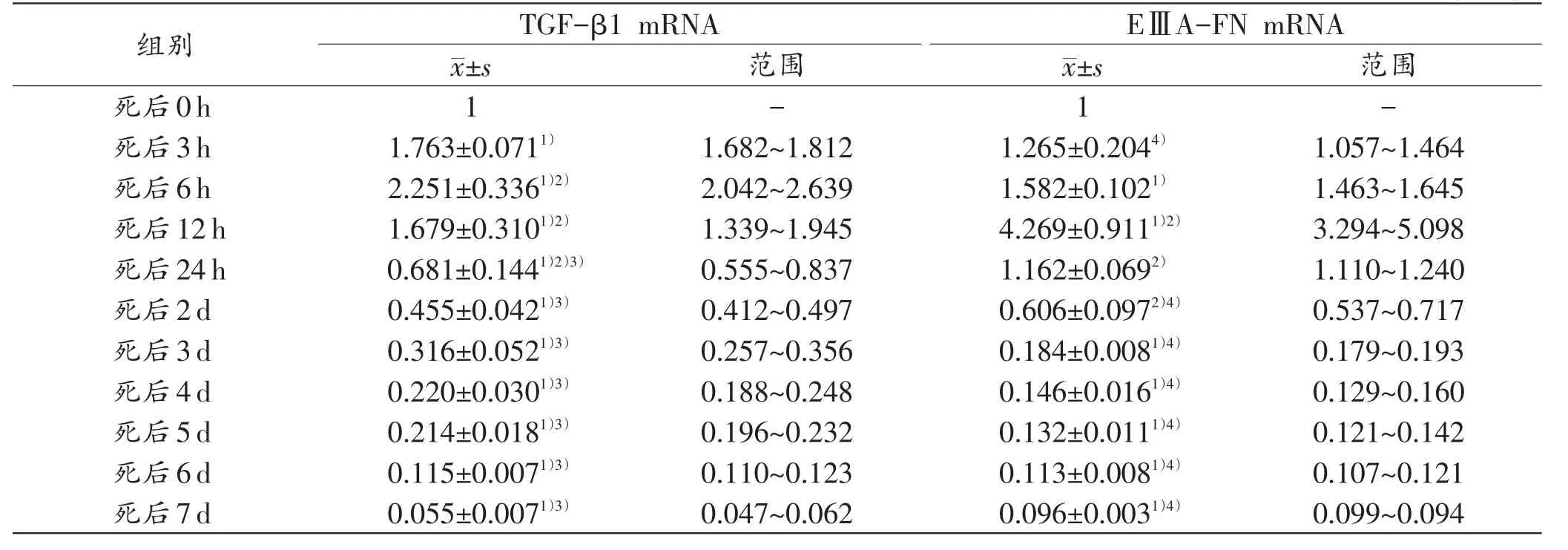
表3 生前挫伤死后表达组大鼠骨骼肌不同时间点TGF-β1和EⅢA-FN mRNA的表达平均值及范围(n=5)

表4 死后挫伤组大鼠骨骼肌不同时间点TGF-β1和EⅢA-FN mRNA的表达平均值及范围 (n=5)
3 讨 论
本研究报道了大鼠骨骼肌生前挫伤后不同时间点TGF-β1和EⅢA-FN的蛋白表达及mRNA动态变化趋势,并探讨了大鼠死后骨骼肌挫伤后不同时间点TGF-β1和EⅢA-FN mRNA的表达趋势,研究了死后环境因素对于TGF-β1和EⅢA-FN mRNA表达的影响,为法医学损伤时间推断的研究提供了全新的视角。
本研究免疫组织化学染色结果显示,TGF-β1蛋白主要定位于MNC和FBC,与大鼠皮肤切创肉芽组织中表达[6-7]一致。TGF-β1可以使巨噬细胞产生白细胞介素-1β(interleukin-1β,IL-1β),再通过IL-1β的继发作用,参与局部炎症反应。活化后的TGF-β1主要通过整合素(integrin)/黏着斑激酶(focal adhesion kinase,FAK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、Smad3蛋白和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)通路诱导肌成纤维细胞分化[8-10]。肌成纤维细胞具有发达的粗面内质网和高尔基体,可以分泌大量的细胞外基质,包括Ⅰ~Ⅵ型胶原等。但是EⅢAFN蛋白表达明显不同于TGF-β1蛋白,除了损伤早期其位于炎症细胞的胞质内,伤后3~7d主要表达于细胞外基质,也与大鼠皮肤挫伤后EⅢA-FN蛋白的表达[11]基本相同。细胞外基质表达EⅢA-FN具有趋化作用,促进炎症细胞、成纤维细胞附着和游走,从而达到再生和修复作用[12]。此外,EⅢA-FN作为细胞外基质对于肌成纤维细胞的形成具有关键性作用。
根据实时荧光定量PCR检测结果,大鼠骨骼肌生前挫伤后TGF-β1和EⅢA-FN mRNA的表达均呈现先增高后降低的变化趋势,分别于伤后3d和5d达到峰值,其表达值范围为11.84~14.03和4.26~6.21,而其他伤后不同时间点TGF-β1和EⅢA-FN mRNA表达值均低于11.84和4.26。因此,如果TGF-β1和EⅢAFN mRNA表达值分别大于11.84和4.26,则可以提示骨骼肌伤后时间为3d和5d。此外,如果不能确定某一指标是否可以区分生前伤与死后伤,那么该指标的实际应用价值则会降低。因此,本研究不仅观察了TGF-β1和EⅢA-FN与骨骼肌伤后存活时间的关系,还重点研究了其是否可以鉴别生前伤与死后伤。由于生物学死亡的早期阶段组织细胞和器官对刺激尚能产生超生反应,故本研究中死后挫伤组不同时间点均可以检出TGF-β1和EⅢA-FN mRNA,但是表达值均明显低于正常未致伤大鼠以及生前挫伤后6 h、10d和14d处死的大鼠,这表明TGF-β1和EⅢA-FN在死后早期骨骼肌超生反应中表达甚微,具有大鼠骨骼肌生前伤与死后伤的鉴别能力。
目前人们对于基因表达通路在人体死亡后发生的变化知之甚少。POZHITKOV等[13]应用基因芯片分别对死后0~96h斑马鱼和死后0~48h小鼠的脑及肝组织进行1 063个基因的mRNA转录谱检测,其中大多是在死后0.5 h内增加。FERREIRA等[14]则从基因型-组织表达(genotype-tissue expression,GTEx)项目中获得36种器官组织的死后数据,研究发现:人体骨骼肌大多数基因在死后早期(小于1 h)表达改变,并且超过600个基因在死后不同时间内具有显著性变化,数量仅次于横结肠。本研究亦观察到大鼠骨骼肌生前损伤后TGF-β1和EⅢA-FN mRNA分别于死后早期(3 h和6 h)表达即增加。死后样本中不同种类细胞的存活可能是死后转录增加的因素之一,如成纤维细胞[15]、嗜酸性粒细胞、单核细胞、中性粒细胞及淋巴细胞[16]在死后短时间内不会消失,可以存活56~86 h,小鼠骨骼肌干细胞甚至可以在死亡后14~17 d保持休眠状态并保留再生能力[17]。这些存活的细胞会主动和持续的转录调控,尤其是参与生存和应激的调控基因会被激活[13]。为了研究TGF-β1和EⅢA-FN mRNA的死后表达情况,本研究设定的死后环境温度为(25±2)℃、相对湿度为(60±5)%。由于温度和湿度均为固定值,尚不能完全模拟实际情况。因此,下一步工作将在动态变化的温度和湿度环境中研究伤后骨骼肌基因谱的死后表达。
