磁性氧化石墨烯/二氧化钛光催化降解甲基橙的影响因素研究
2019-05-27焦琳娟张家伟石玉敏
焦琳娟,张家伟,石玉敏
(韶关学院 化学与环境工程学院,广东 韶关512005)
光催化技术是处理有机废水的一种有效方法.二氧化钛(TiO2)光催化剂由于无毒无害、性质稳定、耐磨损且价廉等优点,备受研究者的青睐[1-4].但TiO2属于宽禁带n型半导体化合物,在可见光范围利用率低,同时存在光生电子和空穴易复合、催化效率不高、难回收、难重复利用等缺点.针对上述问题,科学工作者已作了大量探索,其中之一就是将TiO2负载在磁性碳基材料上[5-8].氧化石墨烯(GO)是一种由碳原子构成的单层片状结构的新型纳米材料,其碳层上富含的环氧基、羟基、羧基等官能团不仅为GO提供了反应活性点,而且这些含氧官能团的亲水性使其能在水中形成稳定的胶状分散体系,对于提高GO复合材料在水中的分散性极其有利[9].同时,以GO材料负载TiO2等半导体复合材料能有效分离光生电子和空穴,提高复合材料的光催化性能,实现染料废水的高效处理[10].关于以磁性氧化石墨烯(Fe3O4@GO)为负载材料,前人[11-12]已较详细地研究了制备条件对磁性氧化石墨烯/二氧化钛(Fe3O4@GO@TiO2)催化活性的影响,但是复合光催化材料在实际应用中,往往还有很多其他因素的影响,如光照时间、溶液初始浓度、溶液pH值和光催化材料的投放量等.为此,本课题组先根据前期工作中确定的最佳制备条件合成出Fe3O4@GO@TiO2,然后以甲基橙溶液模拟染料废水,定量研究这些变量对光催化反应的影响.
1 材料与方法
1.1 药品与仪器
KMnO4、浓 H2SO4、FeCl2·4H2O、FeCl3·6H2O、甲基橙等购于天津市百世化工有限公司.钛酸四丁酯(TBT)、石墨粉、锐钛型TiO2,购于上海阿拉丁生化科技股份有限公司,所有试剂均为分析纯.
Ultima IV X-射线衍射仪(日本理学公司),Zeiss Gemini500扫描电子显微镜(德国卡尔蔡司公司),BL-GHX-Ⅳ光化学反应仪(上海比朗仪器制造有限公司),722s分光光度计(上海精科实业有限公司).
1.2 光催化剂的制备
采用改进的Hummers法制备氧化石墨[13],称取0.3 g氧化石墨加入到40 mL无水乙醇中,超声振荡60 min,得GO溶液A.将11.9 mL TBT加入到35 mL无水乙醇中,匀速搅拌20 min,再将0.2 mL浓盐酸、3 mL去离子水和35 mL无水乙醇的混合液逐滴加入到上述溶液中,快速搅拌至溶胶状物质B.一边搅拌,一边缓慢将溶液A加入到B溶胶中,搅拌均匀至凝胶状后再在80℃下搅拌12 h.将反应液冷却至室温、过滤、用去离子水洗涤至滤液呈中性,滤饼在80℃下真空干燥24 h,研细,接着在450℃马弗炉中煅烧3.5 h,冷却,得GO@TiO2光催化剂.
将1.0 gGO@TiO2加入到200 mL去离子水中,超声振荡20 min,加入0.3 g参照文献[14]制备的Fe3O4,匀速搅拌60 min后用永磁铁将黑色产物分离、洗涤,50℃真空干燥24 h即得Fe3O4@GO@TiO2复合光催化剂.
1.3 光催化剂的表征
采用日本理学公司生产的Ultima IV(全自动多功能)X-射线衍射仪(XRD)对光催化剂的晶相结构进行分析,辐射源为Cu靶.用德国卡尔蔡司公司生产的Zeiss Gemini500扫描电子显微镜(SEM)对光催化剂的形貌进行观察.
1.4 甲基橙标准曲线的绘制
将0.250 g甲基橙溶解于适量去离子水中,定量转移至1 L容量瓶后,定容,摇匀,即得250 mg·L-1的甲基橙储备溶液.用去离子水将储备溶液逐级稀释为2.50~12.5 mg·L-1范围内的标准溶液,以去离子水为参比溶液,于464 nm处测定吸光度,绘制标准曲线,得到回归方程.
1.5 光催化性能实验
将一定量的光催化剂添加到50 mL一定浓度的甲基橙标准溶液中,然后置入光催化反应仪的暗箱中搅拌30 min,达到吸附-脱附平衡.接着以1 000 W汞灯为光源,进行光催化降解实验.按照设定的时间取样、离心、过0.22 μm的滤膜后,在464 nm处测定滤液吸光度,根据1.4的回归方程得到对应浓度,并以此计算甲基橙溶液的降解率Dr:

式中,c0为暗处放置30 min后溶液中甲基橙的浓度;ct为光照 t min后溶液中甲基橙的浓度.
2 结果与讨论
2.1 表征测试结果
2.1.1 X-射线衍射分析
图 1 在 2θ=10.46°处没有出现氧化石墨特征衍射峰[15-16],说明氧化石墨已经被完全剥离开,形成了片层结构的氧化石墨烯.图 1 中 2θ=25.38°、37.96°、48.12°、53.88°、55.12°、62.7°处出现了锐钛型 TiO2的(101)、(004)、(200)、(105)、(211)、(204)特征衍射峰,说明本实验制备的复合光催化剂Fe3O4@GO@TiO2中 TiO2为锐钛型.2θ=30.5°、35.6°、43.5°、62.7°为 Fe3O4(311)、(400)、(422)和(440)晶面的特征衍射峰,说明Fe3O4@GO@TiO2中各物质为共存状态.
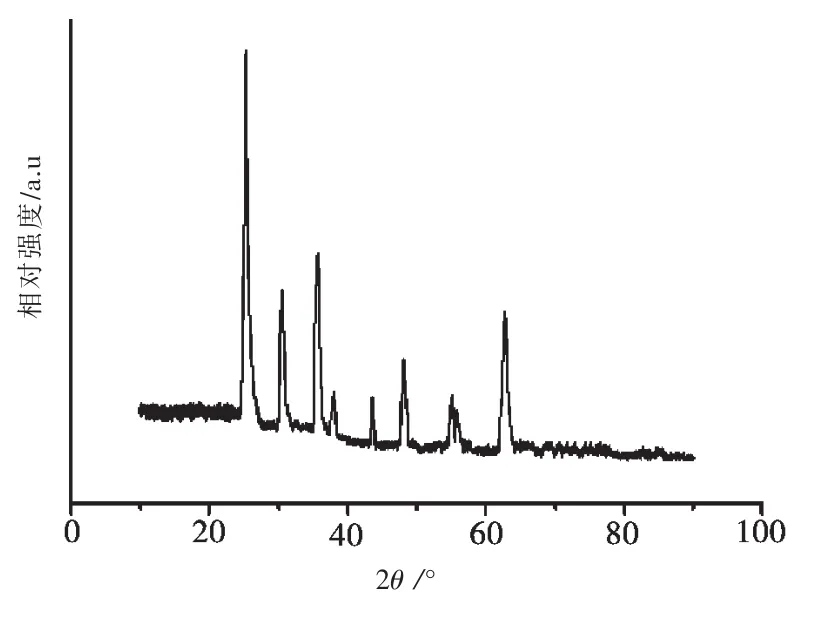
图1 Fe3O4@GO@TiO2的XRD
2.1.2 扫描电镜及EDS分析
氧化石墨电镜扫描见图2(a),可以清楚地看到氧化石墨为表面光滑的片层结构.图2(b)为GO@TiO2的电镜扫描图,可知TiO2纳米粒子分散在GO的片层结构上.图2(c)是Fe3O4@GO@TiO2的电镜扫描图,随着负载颗粒的增多,氧化石墨烯表面颗粒的分布越来越均匀,粒径变小,表面积有所增加.图2(d)是图2(c)的EDS能谱表征图,图谱中出现了C、Fe、O、Ti元素的对应峰.Fe、O、Ti元素的出现以及结合扫描电镜图、XRD图可以证明Fe3O4和TiO2粒子成功附着在氧化石墨烯上.

图2 电镜扫描图及EDS分析图
2.2 标准曲线的绘制
相同浓度的甲基橙标准溶液按照1.4的步骤平行测定3次,以浓度为横坐标,以平均吸光度为纵坐标,在0.0~12.5 mg·L-1的浓度范围内,甲基橙浓度与平均吸光度成良好的线性关系,回归方程为y=0.066 74x+0.002 86,相关系数 R=0.999 8.
2.3 光催化降解甲基橙的影响因素
2.3.1 光催化剂用量
在 pH=5 的 10.0 mg·L-1的甲基橙溶液中分别加入 20.0、30.0、40.0、50.0、60.0、70.0 mg Fe3O4@GO@TiO2复合光催化剂,按照1.5的方法光照70 min后,考查光催化剂用量对复合光催化剂活性的影响.由图3可知,随着Fe3O4@GO@TiO2用量的增多,降解率不断升高,当Fe3O4@GO@TiO2加入量为40.0 mg时,降解率达到最大,之后随着光催化剂用量的增加,降解率反而下降.这是由于光催化剂用量控制在一定范围内时,产生光生电子和空穴的数量随着光催化剂加入量的增加而增加,降解率也逐渐增加;而当光催化剂用量超过某一值时,由于光催化剂颗粒对光有散射现象,溶液的透光性变差,导致光催化剂未被充分激发,产生的光生电子和空穴的量也随之减少,使得催化效果下降.因此,对于50 mL浓度为10.0 mg·L-1的甲基橙溶液,最佳Fe3O4@GO@TiO2用量是40.0 mg.

图3 催化剂加入量对甲基橙降解率的影响
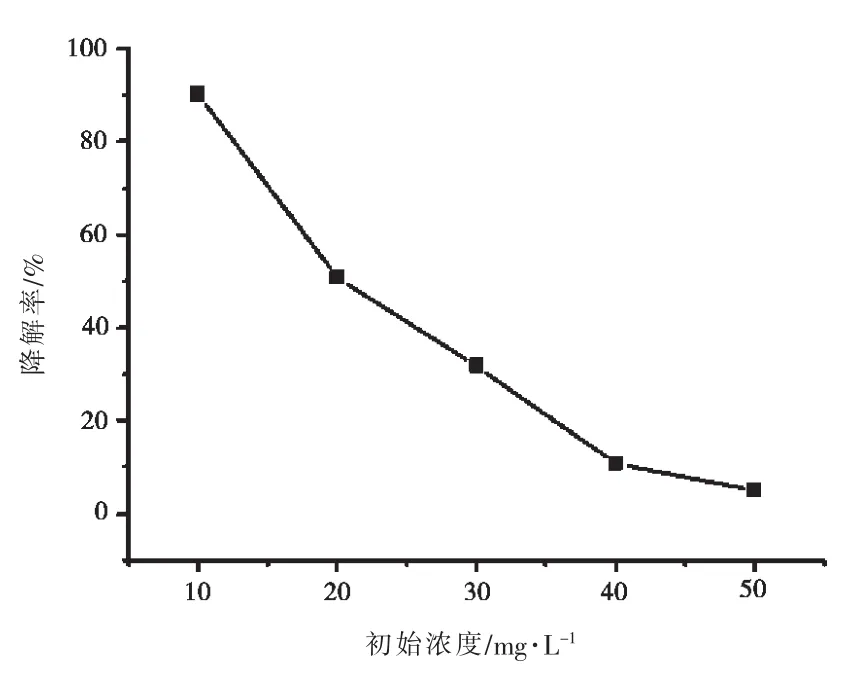
图4 初始浓度对甲基橙降解率的影响
2.3.2 甲基橙初始浓度
在 pH=5、浓度分别为 10.0、20.0、30.0、40.0、50.0 mg·L-1的甲基橙溶液中,均准确加入 40.0 mg Fe3O4@GO@TiO2复合光催化剂,按照1.5的方法光照70 min后,考查甲基橙初始浓度对复合光催化剂活性的影响.由图4可知,随着甲基橙浓度的增加,Fe3O4@GO@TiO2复合光催化剂的降解率逐渐下降.这是因为相同质量的光催化剂,在相同时间的紫外光照射下,TiO2产生的光生电子和空穴数也几乎相同,所以甲基橙浓度越高,降解率越低.因此对于40.0 mg Fe3O4@GO@TiO2复合光催化剂,甲基橙最佳初始浓度是10.0 mg·L-1.
2.3.3 溶液pH值
用10%HCl或NaOH溶液将5份10.0 mg·L-1甲基橙溶液的pH值分别调节为3、5、7、9、11,均加入40.0 mg Fe3O4@GO@TiO2复合光催化剂,按照1.5的方法光照70 min后,考查pH值对复合光催化剂活性的影响,结果如图5所示,当pH为5时,光催化剂的降解率最大.究其主要原因是:溶液的pH值不仅影响光催化剂表面所带电荷的性质,而且还影响污染物的存在形式以及污染物在光催化剂表面的吸附行为.锐钛型TiO2的等电点为6.67,当pH>6.67时,TiO2带负电荷,当pH<6.67时,TiO2带正电荷.甲基橙有偶氮式和醌式结构,当pH>4.4,甲基橙为带负电的偶氮式结构;pH<3.3,甲基橙为不带电的醌式结构.因此,pH=5时,带正电荷的TiO2与带负电荷的甲基橙产生静电吸引,增大了甲基橙分子与光催化剂的碰撞几率,有利于甲基橙的电子向催化剂表面转移,提高降解效果.pH≥7,TiO2与甲基橙都显负电性,两者产生排斥作用,降低甲基橙在光催化剂表面的吸附量,从而减弱光催化降解作用.pH=3,TiO2带正电荷,甲基橙几乎不带电,所以光催化剂对甲基橙的降解率介于pH=5和pH≥7之间.通过这个实验也说明甲基橙的醌式结构比偶氮式结构易降解,得到与文献[17]一致的结果.
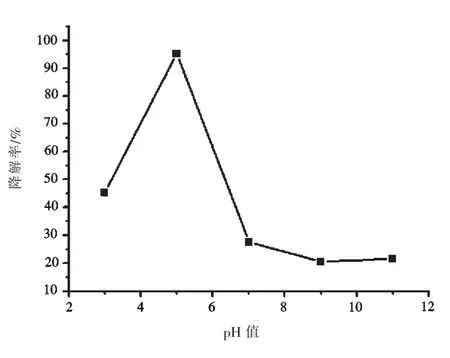
图5 pH值对甲基橙降解率的影响
2.3.4 光照时间
将40.0 mg的Fe3O4@GO@TiO2复合光催化剂加入到 pH=5的10.0 mg·L-1甲基橙溶液中,按照1.5在暗箱中搅拌30 min后,每隔10 min取一次样测定吸光度,考查光照时间对复合光催化剂活性的影响.从图6可以看出,随着光照时间的延长,Fe3O4@GO@TiO2降解率逐渐增大,光照70 min,降解率达到94.5%.本实验还对比了Fe3O4@GO@TiO2复合光催化剂与纯TiO2的光催化效果,结果表明:在相同光照时间,Fe3O4@GO@TiO2光催化能力强于纯TiO2,这是因为复合光催化剂较纯TiO2有大的比表面积和大量吸附位点,同时又可以促进光生电子和空穴的分离,进而提高催化性能.
利用Langmiur-Hinshelwood模型,采用积分法将图6中Fe3O4@GO@TiO2光催化剂的数据进行拟合,得到图7 ln(c0/ct)与time的关系曲线,回归方程 ln(c0/ct)=-0.071 67+0.040 08 t,R=0.995 2,说明Fe3O4@GO@TiO2光催化降解遵循一级动力学方程.
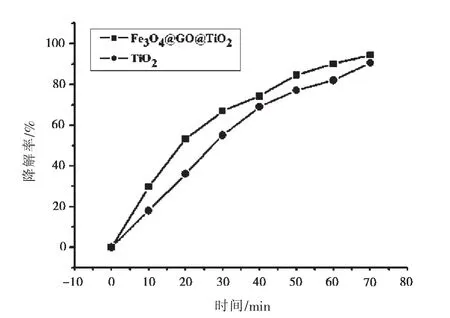
图6 光催化降解曲线
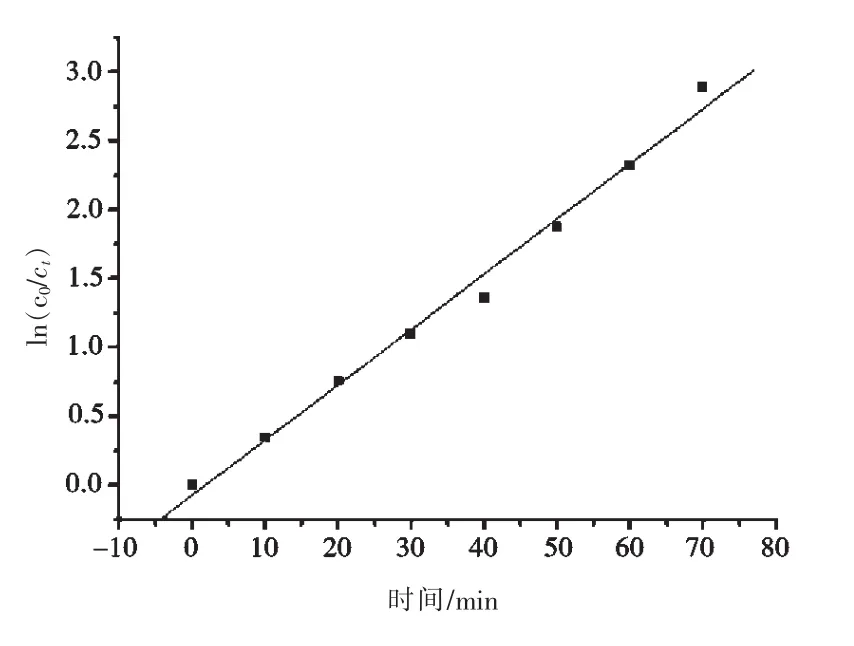
图7 ln(c0/ct)与time的线性回归方程
3 结论
采用溶胶-凝胶法成功制得Fe3O4@GO@TiO2复合光催化材料,并分析了甲基橙溶液的初始浓度、Fe3O4@GO@TiO2的用量、光照时间、溶液pH值等因素对该复合光催化材料降解甲基橙的影响.研究表明:Fe3O4@GO@TiO2在光照条件下可以对甲基橙进行有效的降解,在光照时间为70 min,40.0 mg Fe3O4@GO@TiO2对50mL、pH为5的10.0 mg·L-1甲基橙溶液的降解率达到94.5%.通过数据拟合,Fe3O4@GO@TiO2光催化降解遵循一级动力学方程.
