二氧化锆纳米颗粒荷载阿霉素经不同途径给药治疗兔VX2肝移植瘤
2019-05-27赵璠
赵 璠
(中国医科大学附属盛京医院超声科,辽宁 沈阳 110001)
对无法手术切除的中晚期肝癌或术后复发肝癌患者,目前临床常采用传统化疗法或经肝动脉化疗方法[1]。因多数抗癌药物不能很好地区别肝癌细胞与正常细胞,导致系统性毒性和负面影响,使得传统化疗方法受到一定局限。阿霉素(doxorubicin, DOX)为蒽环类抗肿瘤抗生素,是较常用的传统化疗药物,广泛用于治疗各种肿瘤,包括乳腺、肺和甲状腺等部位恶性肿瘤,但具有较强的心脏毒性[2-4],用于全身及局部化疗可引起心肌病变和充血性心力衰竭。另外,传统介入治疗将化疗药物直接经肝动脉注入,因血流供应不稳定及血管内流体静脉压较高,使得仅有小部分化疗药物可有效到达肿瘤部位。
作为一种新型靶向化疗药物载体,中空纳米颗粒具有较高的比表面积和介孔结构,且空隙率高,可将大量化疗药物装载于纳米颗粒内部或附着于其表面,通过主动靶向或被动靶向的方式使药物进入细胞,提高化疗效果[5-6]。近年来,二氧化锆作为新型纳米材料已在牙科学和骨科领域广泛应用,但少见以其作为药物载体治疗肿瘤的报道[7-8]。本研究采用装载化疗药物DOX的二氧化锆纳米颗粒及游离DOX治疗兔VX2肝移植瘤,比较经肝动脉及传统外周静脉途径给药对肿瘤的靶向性及抑瘤效果,并探讨二氧化锆纳米颗粒载DOX是否可因二氧化锆的药物靶向性而降低DOX的心脏毒性。
1 材料与方法
1.1 动物模型的建立 纯种新西兰大白兔26只[批准号:(2013)2013-112-2号],雌雄不拘,体质量2.0~2.5 kg。将VX2荷瘤瘤株置于37℃恒温水浴箱20 min进行复苏。在无菌条件下将瘤株剪碎,而后任选1只实验兔,以20 ml注射器吸取剪碎的瘤株组织块,直接注射至其双侧后腿肌肉内。10~15天后,待实验兔后腿内生长出实性肿块后,取出瘤块,选取周围新鲜、生长较为旺盛的鱼肉样组织,以外科剪制成1~2 mm瘤块,用于建立兔VX2肝移植瘤模型[9-10]。
建模时,采用Philips iU22型号超声扫描仪,腹部探头(频率3.0~5.0 MHz),进行定位并引导穿刺。将实验兔全身麻醉后仰卧保定于自制操作台,剑突下备皮、消毒,超声实时引导下,将18G穿刺针送至预定种植部位,取1或2个瘤块种植于兔肝内。瘤块种植后10~15天,经CT扫描证实25只兔建模成功。
1.2 分组处理 将25只VX2肝移植瘤模型兔随机分为5组,每组5只。A组经肝动脉给予载DOX二氧化锆纳米颗粒,B组外周静脉给予载DOX二氧化锆纳米颗粒,C组经肝动脉给予游离DOX,D组经外周静脉给予游离DOX,E组为空白对照组。其中A、B组载DOX二氧化锆纳米颗粒剂量为3.7 mg/kg体质量(所含DOX剂量相当于1.75 mg/kg体质量),C、D组游离DOX剂量为1.75 mg/kg体质量;E组不做任何处理。
1.2.1 经肝动脉给药 采用Siemens Artis DTA DSA数字减影血管造影机,对A、C组经肝动脉途径给药。将模型兔全身麻醉后仰卧保定于自制操作台,确定其右侧股动脉搏动部位,并对右侧后腿内侧区域备皮、消毒、铺巾。沿股动脉搏动部位钝性分离,剥离股动脉。以18G穿刺针穿刺股动脉,而后引入5F导管鞘,行腹腔干造影显示肝内血管,将微导丝超选择至肿瘤供血动脉,造影明确供血动脉,经导管分别注入载DOX二氧化锆纳米颗粒及游离DOX。术毕加压包扎并缝合[11]。
1.2.2 经外周静脉给药 对B、D组经耳缘静脉分别注入载DOX二氧化锆纳米颗粒及游离DOX。
1.3 影像学评价 采用Toshiba Aquilion 64排螺旋CT扫描仪,给药后1、3、6天对各组行CT检查,观察肿瘤生长情况及载DOX二氧化锆纳米颗粒影像学表现,选取肝内肿瘤最大层面测量病灶长径及短径,计算肿瘤体积,体积=0.5×长径×短径2,并分别计算3天与1天、6天与3天、6天与1天肿瘤体积比。
1.4 组织学检查 于末次CT检查后处死模型兔,取出心脏组织,固定后沿轴位方向切成5 mm薄片,将标本于4%甲醛溶液中浸泡2天后取出,进行石蜡包埋。采用Nikon Eclipse TS100-F显微镜,对比观察各组心脏标本组织学表现。
1.5 统计学分析 采用SPSS 17.0统计分析软件,计量资料以±s表示,多组间比较采用单因素方差分析比较各组间肿瘤体积比的差异,两两比较采用LSD或SNK法。P<0.05为差异有统计学意义。
2 结果
给药后各时间点CT检查均显示载DOX二氧化锆纳米颗粒在肝肿瘤病灶内呈略高密度影(图1)。各组兔VX2肝移植瘤模型6天内肿瘤体积持续增大,但增大程度不同,见表1。各组间给药后3天与1天肿瘤体积比、6天与3天肿瘤体积比差异均无统计学意义(F=2.056、1.906,P=0.125、0.149),给药后6天与1天肿瘤体积比差异有统计学意义(F=4.230,P=0.012);两两比较显示,A组与B组间(P=0.012)、A组与C组间(P=0.019)、A组与D组间(P=0.024)、A组与E组间(P=0.001)及B组与E组间(P=0.029)差异均有统计学意义,而B组与C组间(P=0.358)、B组与D组间(P=0.420)、C组与D组间(P=0.907)、C组与E组间(P=0.176)及D组与E组间(P=0.143)差异均无统计学意义。
组织学检查显示, E组心肌细胞结构正常(图2A),与之相比,A组心肌细胞几乎无损伤(图2B),B组仅见心肌轻度扩张(图2C),C组可见心肌纤维断裂,心肌细胞变形,出现明显细胞水肿,细胞核位于一侧(图2D),D组可见明显心肌扩张及细胞核变形(图2E)。
3 讨论
近年来,联合应用载药纳米颗粒与介入治疗方法(如肝动脉化疗灌注、肝动脉栓塞、微波消融、射频消融等)治疗肿瘤的研究报道[12]逐渐增多。纳米颗粒可作为靶向化疗药物的载体,利用其良好的靶向性、缓释性、生物相容性及生物降解性,提高化疗药物的靶向性,以达到更有效地抑制肿瘤生长的目的[13]。
载DOX二氧化锆纳米颗粒经肝动脉给药后到达肿瘤部位,并释放DOX,使DOX在局部动脉血中达到较高的药物浓度,可提高其抗肿瘤作用[14]。本研究结果显示,载DOX二氧化锆纳米颗粒CT呈略高密度(图1),经肝动脉给药后6天,兔VX2肝移植瘤虽然仍持续生长,但肿瘤内高密度的载DOX二氧化锆纳米颗粒周围出现近似环形低密度区(图1),为肿瘤坏死区。
表1 各组VX2肝移植瘤模型兔不同时间肿瘤体积及体积比(±s)

表1 各组VX2肝移植瘤模型兔不同时间肿瘤体积及体积比(±s)
组别肿瘤体积(mm3)1天3天6天肿瘤体积比3天与1天6天与3天6天与1天A组5 471.86±4.356 758.34±2.279 988.37±7.331.27±0.081.46±0.401.85±0.45B组5 497.35±4.1610 335.51±6.6117 498.40±1.312.05±0.461.64±0.233.32±0.72C组3 090.66±2.008 132.92±6.3410 820.87±6.302.39±0.821.54±0.434.18±0.98D组5 329.43±3.3010 513.74±8.4220 258.65±1.292.12±0.852.30±1.353.88±0.91E组4 900.73±2.6113 853.18±1.1928 445.97±1.692.62±1.122.51±0.794.76±1.56
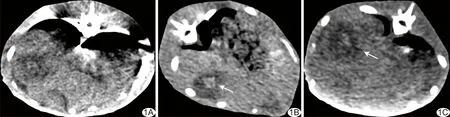
图1 载DOX二氧化锆纳米颗粒经肝动脉注入兔VX2肝移植瘤后不同时间CT图像 A、B.给药后1天(A)及3天(B),载DOX二氧化锆纳米颗粒在病灶内呈略高密度影(箭); C.给药后6天,病灶内载DOX二氧化锆纳米颗粒周围出现近似环形低密度区(箭)

图2各组兔VX2肝移植瘤模型经不同处理后6天心脏标本病理图(HE,×200) A.E组,为空白对照,不做任何处理; B.A组,经肝动脉注入载DOX二氧化锆纳米颗粒; C.B组,经外周静脉注入载DOX二氧化锆纳米颗粒; D.C组,经肝动脉注入游离DOX; E.D组,经外周静脉注入游离DOX
表面被修饰后的纳米颗粒可通过被动-主动靶向作用及受体-配体作用,在体内实现对肿瘤的趋向,但易聚集于网状内皮系统丰富的组织器官。通过外周静脉给药后,载DOX二氧化锆纳米颗粒经全身血液循环到达肝内[15],在此过程中,部分纳米颗粒被其他脏器的网状内皮系统吞噬并释放DOX,影响肝内病灶局部的药物浓度,使其治疗效果不及经肝动脉给药。本研究中,A组给药后6天与1天肿瘤体积比明显低于B组。游离DOX经肝动脉及外周静脉给药后,因其药物靶向性较差,随血液循环分布于全身各组织器官,无法实现肝内局部化疗目的,治疗效果不佳。本研究中A组和B组给药后6天与1天肿瘤体积比均明显低于E组,而C组和D组均与E组间差异无统计学意义。通过介入手段,经肝动脉将化疗药物超选择性靶向注入肿瘤供血动脉,有利于提高化疗药物的靶向性。
DOX具有较强的心脏毒性。本研究组织学检查发现,C组和D组心肌损伤程度相对于A组和B组更为严重,可见明显的细胞水肿、心肌纤维断裂及心肌扩张,而A组心肌细胞几乎无损伤,提示载DOX二氧化锆纳米颗粒无论是通过肝动脉途径还是外周静脉给药均较游离DOX更有利于降低DOX的心脏毒性;此外,载DOX二氧化锆纳米颗粒经肝动脉给药引起的心肌细胞损伤较经外周静脉给药更轻微。
总之,本研究通过在体动物实验发现,纳米药物载体与传统介入超选择性肝动脉化疗相结合,可更好地延缓肿瘤生长,提高药物靶向性,并有效降低DOX造成的荷VX2肝移植瘤兔心脏毒性。
