微血管表面通透性预测急性缺血性脑梗死自发性出血性转化
2019-05-27江岷芮童海鹏冉启胜张伟国
江岷芮,童海鹏,邓 洋,冉启胜,张伟国
(陆军军医大学大坪医院野战外科研究所放射科,重庆 400042)
出血性转化(hemorrhagic transformation, HT)指缺血性脑梗死患者合并继发性脑出血的现象[1],是缺血性脑梗死常见的并发症之一,根据CT表现可将分为出血性梗死和脑实质出血[2-3],根据患者是否接受溶栓治疗可分为自发性HT和继发性HT[4]。已有研究[5]证实,溶栓治疗会增大HT发生风险,是继发性HT的危险因素。预测HT对临床评估预后、治疗选择有重要意义。目前对于继发性HT的研究报道较多,而鲜见自发性HT相关研究,尤其是对自发性HT进行评估、预测的报道。本研究回顾性分析发生HT与未发生HT的脑梗死患者的CT灌注成像(CT perfusion imaging, CTPI)资料,探讨以微血管表面通透性(permeability surface, PS)预测急性缺血性脑梗死患者自发性HT的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月—2018年9月我院收治的43例急性缺血性脑梗死患者的CTPI资料,男24例,女19例,年龄50~88岁,平均(69.8±10.7)岁。纳入标准:①符合中华医学会于2014年发布的急性缺血性脑卒中诊治指南中的诊断标准[6];②首诊颅脑CT检查排除颅内出血;③未接受静脉溶栓或血管内介入治疗;④脑梗死发病2周内,经CT或MR检查明确是否发生HT。排除标准:①接受溶栓治疗;②患有动脉畸形、动脉瘤等疾病;③既往有颅内出血史、颅脑外伤史;④严重心、肺、肝肾功能不全;⑤影像学检查资料不全。43例中,20例发生HT(HT组),23例未发生HT(对照组)。HT组中,男13例,女7例,年龄50~88岁,平均(70.5±11.1)岁;对照组中,男11例,女12例,年龄53~86岁,平均(69.3±10.6)岁。
1.2 仪器与方法 采用Philips Brilliance iCT扫描仪行CT平扫及CTPI。CT平扫以听呲线扫描定位覆盖全脑。在平扫基础上行CTPI,对比剂为碘海醇(300 mgI/ml),以Ulich高压注射器经肘静脉注入,流率6.5 ml/s,剂量50 ml;扫描范围8 cm,管电压80 kV,管电流200 mA,视野220 mm,层厚5 mm,层间隔5 mm,时间分辨力2 s,扫描层数16层,扫描时间60 s,共获得480帧CTPI图像。
1.3 图像后处理及参数采集 采用Kinetics灌注成像定量分析软件对CTPI数据进行后处理与分析。在CTPI中选取大脑前动脉作为输入动脉,以同层面上矢状窦作为输出静脉,将ROI放置于目标区域,软件自动生成PS、脑血容量(cerebral blood volume, CBV)及脑血流量(cerebral blood flow, CBF) 等参数图。在PS参数图中,将3个直径10 mm的ROI放置在异常区域,分别测量PS值后取平均值,并以脑中线为基线进行镜像反转,测量并记录3个ROI对侧区域的PS值,取平均值。同时测量CBF及CBV值,测量方法同PS。
1.4 统计学分析 采用SPSS 17.0统计分析软件。计量资料以中位数(上下四分位数)表示,计数资料以百分率表示。HT组患侧与对侧间、HT组患侧与对照组患侧间CTPI参数比较采用Mann-WhitneyU检验。通过ROC曲线分析获得PS值预测自发性HT的敏感度、特异度及准确率。以P<0.05为差异有统计学意义。
2 结果
2.1 CTPI参数比较
2.1.1 HT组患侧与对侧比较 HT组患侧PS值、CBV值较对侧明显升高,而CBF值较对侧明显降低,见表1、图1。
2.1.2 HT组患侧与对照组患侧比较 HT组患侧PS值、CBV值较对照组明显升高,而2组患侧间CBF值差异无统计学意义,见表2。
2.2 ROC曲线分析 以PS值0.032 4 ml/(100 ml·min)为临界值,诊断急性缺血性脑梗死患者自发性HT的ROC曲线见图2,AUC为0.952,敏感度为90.00%,特异度为82.60%,准确率为86.05%。
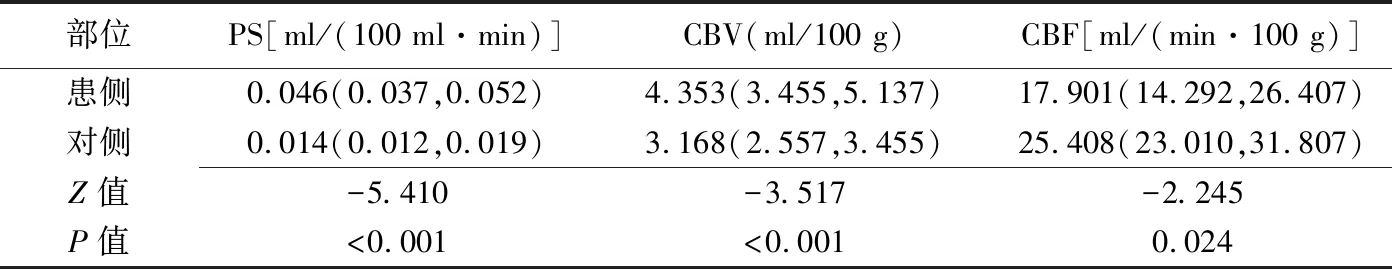
表1 HT组患侧与对侧CTPI参数比较[中位数(上下四分位数),n=20]
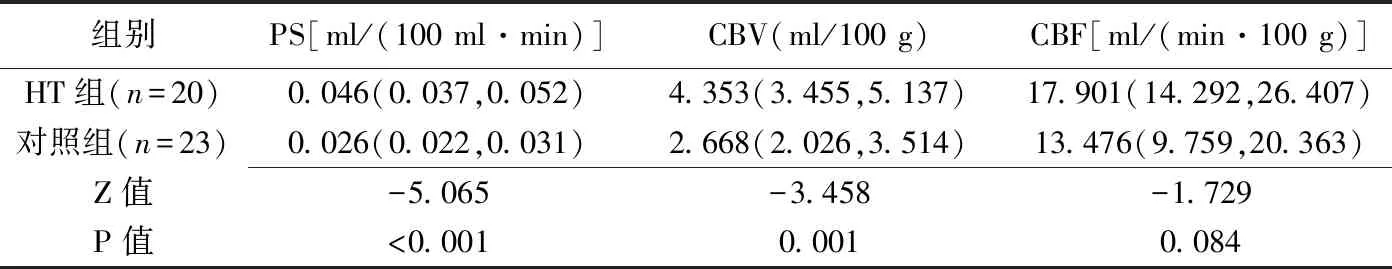
表2 HT组患侧与对照组患侧CTPI参数比较[中位数(上下四分位数)]
图1患者女,75岁,突发言语含糊、左侧肢体乏力8hA.CT平扫示右侧大脑半球体积较对侧稍增大,脑沟变浅,右侧侧脑室前角及后角变窄,右侧颞叶可见斑片状低密度影;B~D.CTPI示右侧大脑半球PS增高,以右侧颞叶较为显著(B),右侧颞叶CBV局限性轻度增高(C)且CBF减低(D);E.发病后未接受静脉溶栓或血管内介入治疗,入院第3天复查头颅CT平扫发现HT
3 讨论
1991年Miles等[7]首次提出CTPI,其成像原理是在静脉快速团注一定量对比剂后,对选定大脑层面进行连续快速动态CT扫描,获得该层面脑组织所有体素的时间-密度曲线,通过CT值的动态变化,采用不同数学模型和图像处理技术,获得PS、CBV及CBF等灌注参数,以这些参数反映脑组织生理和病理状态下血流动力学改变。CTPI时间分辨力越高,动脉输入函数越准确,对各参数的定量计算也更为精确,但也会带来辐射剂量增加的弊端。本研究采用Philips Brilliance iCT扫描仪,原始扫描参数设置时间分辨力为4 s,覆盖全脑,为尽可能地在不增加辐射剂量的前提下获得更为准确的灌注参数,检查时采用2 s的时间分辨力,获得半脑的灌注参数图,同时采用Kinetics灌注成像定量分析软件进行图像后处理。
CTPI参数可反映脑组织缺血的程度,对评估及预测溶栓治疗后脑梗死患者HT具有重要临床意义[8-9]。缺血导致脑组织CBF值下降超过65%时,HT的发生风险明显增加[10];对于大脑中动脉闭塞患者,缺血脑组织平均CBF<0.18时即可认为HT高危[11]。Hamann等[11]报道,发生在微血管水平的HT主要是血脑屏障完整性破坏和渗透性改变所致。血脑屏障被破坏的主要机制如下[12]:基质的蛋白水解酶降解了血脑屏障的层黏连蛋白、纤维链接蛋白等成分,使得血脑屏障被破坏;缺血再灌注后,脑磷脂分解产生花生四烯酸,构成的自由基破坏了细胞中的蛋白质、脂质、核酸,启动细胞信号传导,从而破坏血脑屏障。此外,缺血再灌注后产生的活性氧可激活一系列细胞因子,促进白细胞聚集炎症反应,最后导致局部微血管通透性改变。脑梗死后,脑组织血流动力学发生变化,血脑屏障被破坏,血管通透性增高,可导致HT发生。HT是缺血性脑梗死患者常见的并发症;国外研究[13-14]报道,急性缺血性脑梗死后自发性HT的发生率为10%~43%,且经药物溶栓后HT的发生率提高2~3倍。溶栓治疗是HT的危险因素之一,其发生率与溶栓治疗时间、药物种类、剂量及给药途径均密切相关[15]。本研究中43例均接受溶栓治疗,HT发生率为46.51%(20/43)。Kassner等[16]研究报道,血脑屏障破坏所致局部微血管PS改变是导致HT的主要原因。本研究中HT组患侧PS值明显高于对照组患侧PS值(Z=-5.065,P<0.001),与Aviv等[17]的研究结果一致。为排除溶栓治疗对HT的影响,本研究分析应用PS早期预测自发性HT的价值,ROC曲线分析显示,以0.032 4 ml/(100 ml·min)为临界值,诊断敏感度、特异度及准确率分别为90.00%、82.60%及86.05%,提示PS升高与自发性HT发生有关,检测PS值可为临床制定个性化治疗方案提供参考依据,也有助于评估预后。

图2 以PS值0.032 4 ml/(100 ml·min)诊断急性缺血性脑梗死患者自发性HT的ROC曲线
本研究的局限性:①样本量较少,有待增大样本量进一步分析;②CTPI扫描范围有限,时间分辨力2 s条件下仅能扫描8 cm范围16层图像,包含前循环或后循环,不能显示灌注范围以外的病灶。
综上所述,利用CTPI定量分析PS值可对急性缺血性脑梗死患者自发性HT的发生进行预测,有助于临床制定有针对性的治疗方案,提高疗效。
