立位血浆醛固酮浓度与血浆肾素浓度的比值对原发性醛固酮增多症的诊断价值*
2019-05-25韩桂艳陈笑瑜许宏秀
张 婷,韩桂艳,陈笑瑜,许宏秀
(承德医学院附属医院内分泌科,河北承德 067000)
原发性醛固酮增多症(原醛)主要表现为醛固酮水平升高、血浆肾素水平减低,是继发性高血压的常见病因[1]。目前,国内外主要应用立位血浆醛固酮浓度(plasma aldosterone concentration,PAC)与血浆肾素活性(plasma rennin activity,PRA)的比值(ARR)筛查原醛,PRA检测过程操作复杂,且操作过程中有多种因素可以影响PRA检测结果的准确性。使用化学发光法直接检测血浆直接肾素浓度(plasma direct rennin concentration,PDC)具有操作简单、重复性好的优点,且能避免放射性污染,在临床上逐渐受到关注[2]。但目前临床上应用立位PAC与PDC的比值(ADRR)筛查原醛仍较少,ADRR筛查原醛的诊断界值国内仍不统一。为此,本研究拟应用受试者工作特征曲线(receive operating characteristic curve,ROC)确定ADRR筛查原醛的最佳诊断界值,以期为临床原醛的筛查提供依据。
1 资料与方法
1.1 研究对象 收集2015年6月至2018年7月于承德医学院附属医院住院的高血压原因待查患者80例,男、女各40例。依据2008年美国内分泌学会发布的《原醛患者的病例检测、诊断和治疗:内分泌学会临床实践指南》,符合原醛筛查标准的患者进一步行卡托普利试验,卡托普利试验阳性的患者行肾上腺增强CT扫描。最终确诊为合并原醛的高血压患者20例(原醛组),原发性高血压患者60例(高血压组)。
排除标准:急性脑血管病,急性心血管病,肝、肾功能不全,合并急、慢性感染,妊娠,各种病因导致长期需应用激素治疗,恶性肿瘤病史。
1.2 研究方法 记录所有研究对象性别、年龄等一般资料,测量血压、身高、体重,计算体质指数(body mass index,BMI,kg/m2),完善血生化检查。所有患者平衡饮食,在实验开始前2周停止应用对肾素和醛固酮分泌和测定有影响的药物,醛固酮受体拮抗剂需停用4周以上。对于血压升高有症状的患者,可给予α受体阻断剂。
抽血当日晨06:00嘱患者站立或行走2h,静坐15min后抽血,由北京一安医疗科技有限公司采用放射免疫法协助检测PRA,采用化学发光免疫法测PDC、PAC,并计算ADRR、ARR。
1.3 统计分析 数据应用软件SPSS 19.0进行统计分析。计量资料符合正态分布采用(均数±标准差)表示,组间比较采用独立样本t检验;非正态分布用中位数(第一四分位数~第三四分位数)表示,组间比较用非参数检验。同时绘制ROC曲线,以约登指数最大时作为最佳诊断界值。P<0.05为有统计学差异。
2 结果
2.1 两组患者临床数据资料 原醛组患者血钾水平显著低于高血压组,差异具有统计学意义(P<0.05);两组年龄、血压、BMI、血钠、总胆固醇、甘油三酯、血糖、血肌酐比较,差异无统计学意义(P>0.05)。见表1:
表1 两组患者临床数据资料比较(±s )

表1 两组患者临床数据资料比较(±s )
指标 高血压组(n=60) 原醛组(n=20) t P年龄(岁) 43.35±15.08 50.75±11.19 -1.47 0.15收缩压(mmHg) 144.73±16.72 156.89±25.63 -1.94 0.06舒张压(mmHg) 92.62±14.82 100.11±25.21 -1.60 0.11 BMI(kg/m2) 27.11±3.21 25.44±4.26 1.52 0.14血钾(mmol/L) 3.82±0.38 3.14±0.84 3.44 0.00血钠(mmol/L) 139.61±2.95 140.42±5.58 0.38 0.41胆固醇(mmol/L) 4.62±1.20 4.57±0.81 0.16 0.88甘油三酯(mmol/L) 2.01±1.66 1.49±0.91 1.31 0.19血糖(mmol/L) 7.88±5.14 6.08±2.05 1.45 0.15肌酐(umol/L) 70.02±20.83 67.15±18.90 0.54 0.59
2.2 两组患者的PAC、PDC、PRA、ADRR及ARR 原醛组患者PAC、ADRR、ARR显著高于高血压组,差异具有统计学意义(P<0.05);原醛组PDC、PRA显著低于高血压组,差异具有统计学意义(P<0.05)。见表2:

表2 两组患者PAC、PDC、ARR及ADRR比较
2.3 ROC曲线 ARR的ROC曲线下面积为0.698(图1),ARR诊断界值在63.77(pg/ml)/(μg/L/h)时,诊断原醛的敏感性和特异性分别92.9%和60.0%。ADRR的ROC曲线下面积为0.882(图1),ADRR在2.55(pg/ml)/(pg/ml)时,约登指数最大,诊断原醛的敏感度和特异度分别80.0%和90.0%(表3)。说明ADRR筛查原醛的价值优于ARR。

图1 ARR筛查原醛的ROC曲线
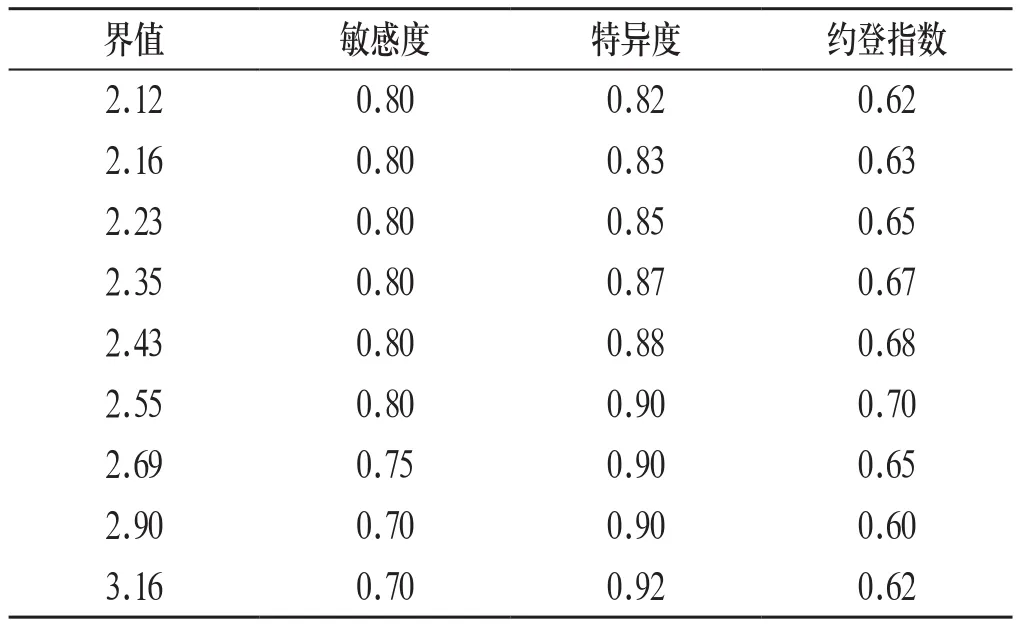
表3 不同ADRR界值诊断原醛的敏感度、特异度和约登指数
3 讨论
原醛是一组代谢紊乱综合征,表现为醛固酮合成异常增多,以血压升高、血钾减低为主要临床表现。随着ARR用于原醛的筛查,原醛的检出率明显升高,使原醛受到了广泛关注[3]。2008年美国内分泌学会发布的《原醛患者的病例检测、诊断和治疗:内分泌学会临床实践指南》建议[4],符合以下情况之一者应进行原醛症的筛查:①收缩压>160mmHg、舒张压>100mmHg或难治性高血压;②高血压伴自发性或利尿剂诱导的低钾血症;③高血压伴肾上腺偶发瘤;④高血压伴早发高血压或早发(小于40岁)脑血管意外家族史;⑤有一级亲属患有原醛症。并且,早在1976年既有学者提出建议,同时测量PAC和PRA,然后计算ARR,以有效筛查原醛[5]。
PRA需要先测定血管紧张素原转换为血管紧张素Ⅰ(AI)的速率,然后间接测定PRA。检测过程繁琐,且在操作过程中有很多因素都可以影响PRA的检测结果,因此导致了PRA检测结果的不确定性[6]。全自动CLIA可直接检测PDC[7],能避免检测PRA过程中的不足。目前国内外已经有许多研究表明,通过检测PDC计算的ADRR与通过检测PRA计算的ARR呈正相关,而临床检测PDC的方法更加便捷,因此提示ADRR可用于临床原醛的筛查[8-10]。
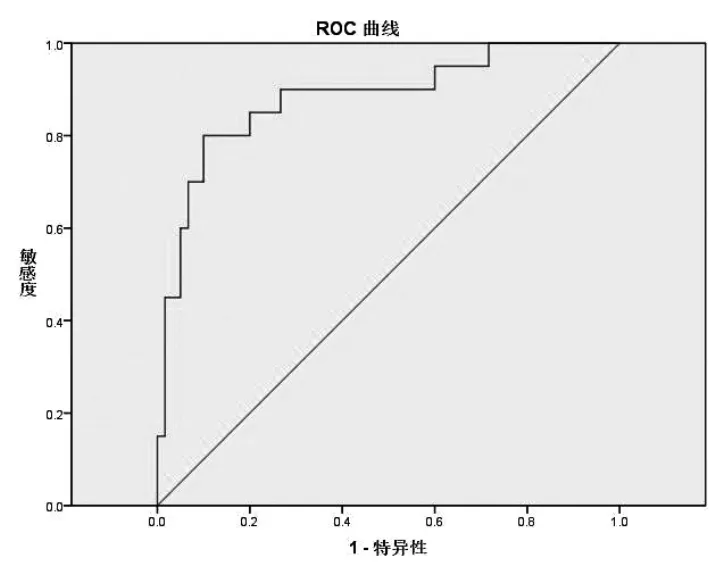
图2 ADRR筛查原醛的ROC曲线
本研究采用立位PAC与PDC计算ADRR,结合ROC曲线,当ADRR的最佳诊断界值为2.55(pg/ml)/(pg/ml)时,其筛查原醛的敏感性和特异性分别为80.0%和90.0%,虽然诊断的敏感性低于ARR,但特异度高于ARR,同时ADRR的ROC曲线下面积大于ARR,提示ADRR诊断原醛的价值高于ARR。本研究ADRR的诊断界值与UNGER等[11]的研究结果近似。目前,许多研究确定的筛查原醛的ADRR最佳诊断界值仍不一致,美国内分泌学会临床实践指南中推荐的ADRR的界值为3.7(ng/dl)/(mU/L)[4],有学者研究认为立位ADRR>30(pg/ml)/(pg/ml)为适宜的诊断界值[9],而国内有学者研究发现ADRR的最佳诊断界值为4.3(ng/dl)/(mU/L)[12]。不同研究ADRR筛查原醛的诊断界值不同可能与研究纳入人群、研究人种、盐摄入水平及对照组的选择不同有关。在筛查原醛前应调整饮食习惯,按要求停用相关药物、纠正电解质紊乱,从而减少相关因素对结果的影响。
综上所述,本研究确定ADRR筛查原醛的最佳诊断界值为2.55(pg/ml)/(pg/ml),敏感性和特异性分别80.0%和90.0%,诊断价值高于ARR。但本研究纳入的样本量较少,研究结果还需要加大样本量进一步证实;另外,后续研究还应确定卧位ADRR筛查原醛的最佳诊断界值及灵敏度、特异度。
