NLRP3炎性小体表达下调对卒中后抑郁大鼠的作用
2019-05-25李芳芳
刘 柳 蒋 超 李芳芳
郑州大学第五附属医院神经内科,河南 郑州 450052
卒中后抑郁(post stroke depression,PSD)是脑卒中患者最常见的一种精神障碍,约1/3的脑卒中患者遗留有卒中后抑郁,特别是在卒中后早期[1-2],其累计发病率为55%[3]。研究表明,卒中后约85%的患者会在卒中后5 a内出现至少5次抑郁状态[4]。而且PSD与患者较差的神经功能康复、认知恢复和生活质量相关[5-8],并对患者接受康复治疗起到负面影响作用,为家庭及社会带来沉重的负担。虽然卒中增加了PSD的患病风险,但PSD也反过来影响卒中后的康复锻炼及功能康复,由此形成恶性循环。因此,积极研究PSD的发病机制、寻找有效的治疗靶点,从而指导临床治疗,提高患者生活质量尤为重要。
近年来,已有越来越多的学者关注并研究PSD的病理发展过程。目前认为神经生物学因素(如卒中涉及的脑区[9]、卒中发生的原因[10])是影响PSD的主要因素,而不是患者残疾后的心理反应。PSD与基因具有相关性,如5-羟色胺转运体、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和5-HT2A受体的基因多态性[11-13]。由小胶质细胞和星形胶质细胞的激活、促炎因子(如IL-1、IL-6、IL-18、TNF-)表达上调引起的神经炎症在急性缺血性脑卒中和抑郁症[14]的病理过程中均有重要作用,而IL-18可能参与了卒中后抑郁的病理发展过程[15-16]。核苷酸结合寡聚化结构域样受体家族含pyrin结构域蛋白3炎性小体(nucleotide-binding oligomerization domain-like receptor family,pyrin domain-containing protein 3,NLRP3)是由多种蛋白质组成的复合体,在动脉粥样硬化、阿尔茨海默症、脑出血等疾病中均有重要作用,MA等[17]研究表明,脑出血后线粒体通过其膜通透性转运孔调节线粒体活性氧的产生,启动NLRP3的活化,促进半胱氨酸天门冬氨酸酶-1的活化和IL-1成熟,进而增强炎症反应,且ATP-P2x7R-NLRP3信号通路参与了应激导致的抑郁症发病过程[18],但NLRP3能否影响PSD的病理过程仍然不明。因此,本研究探讨NLRP3在PSD大鼠中的作用,以期为临床PSD预防及治疗提供基础理论支持。
1 材料与方法
1.1 主要试剂和材料 0.24~0.28 mm的MCAO线栓(北京西浓科技有限公司),特异性NLRP3 siRNA序列为5'-CCAGGAGAGAACUUCUU-AUTT-3',对照组siRNA序列为5'-UUCUCCGAACGUGUCACGUTT-3',均购自上海吉玛生物有限公司。大鼠IL-1ELISA试剂盒(联科生物),大鼠IL-18 ELISA试剂盒(联科生物)。
1.2 实验动物及分组 144只清洁级雄性SD大鼠(260~280 g)均购自河南省实验动物中心,饲养于郑州大学第五附属医院中心实验室清洁级动物房,给予充足的水和饲料,控制室内温度为(25±1)℃,昼夜比例为12∶12。按照随机数字表法将大鼠随机分为4组:假手术组(sham组,n=36)、卒中后抑郁+溶剂对照组(PSD+vehicle组,n=36)、卒中后抑郁+对照siRNA组(PSD+control siRNA,n=36)和卒中后抑郁+NLRP3 siRNA治疗组(PSD+NLRP3 siRNA,n=36)。每组分为4个时间点,每个时间点n=12/组。本实验经过郑州大学动物伦理委员会批准。
1.3 NLRP3 siRNA的应用 CUMS第21天向大鼠左侧脑室注射NLRP3 siRNA或等体积对照片段、无菌生理盐水。具体方法如下:将30 μL无菌双蒸水加入含2 OD干扰片段的Ep管中混匀备用。10%水合氯醛以250 mg/kg腹腔注射麻醉大鼠,牵拉后肢无反应后,将大鼠固定于脑立体定位仪上,于头部正中剃毛备皮、消毒,用无菌手术刀沿矢状位做一长约1.5 cm切口,充分暴露颅骨。以前囟为原点,定位前囟后0.9 mm,向左旁开1.9 mm并标记,颅骨钻垂直钻孔。用微量进样器吸取10 μL NLRP3 siRNA溶液(PSD+NLRP3 siRNA组)或对照siRNA(PSD+control siRNA组)、无菌生理盐水(PSD+vehicle组),调整微量进样器针尖至颅骨孔,刚好看不到针尖时即认为深度为0,垂直进针3.5 mm时开始注射,10 min内匀速注射完毕后停针10 min,缓慢拔出进样器,骨蜡封孔,缝合。
1.4 卒中后抑郁模型的制作 术前12 h禁食不禁水,用10%水合氯醛经腹腔注射麻醉大鼠(250 mg/kg),刺激大鼠后肢无反应后,肌注8万U青霉素预防感染。颈前区备皮、消毒,在左侧颈前区做一长约2 cm纵切口,钝性分离软组织,游离左颈总动脉及颈内、外动脉,结扎颈总动脉近心端和颈外动脉远心端。将颈内动脉用动脉夹暂时阻断远心端,在颈总动脉分叉处、用眼科剪剪一小口,将直径0.18 mm的尼龙线栓沿此口插入颈内动脉,打开颈内动脉的动脉夹,使线栓进入颈内动脉约12 mm时,固定线栓。用无菌生理盐水湿润的无菌纱布覆盖手术区域,60 min后将线栓缓慢拔出,结扎颈总动脉,缝合,碘伏消毒。假手术组不放置线栓,其余操作与PSD组相同。待麻醉苏醒后,对各组大鼠进行Longa评分,1~<4分为模型成功,否则剔除实验。MCAO成模1周后,开始对大鼠进行慢性轻度不可预见性应激(CUMS)处理联合单笼饲养的单居处理,连续进行21 d,以诱导卒中后抑郁。CUMS为随机接受以下处理中的一种:黑白昼夜节律颠倒;禁食或禁水20 h;鼠笼倾斜45°或使用潮湿垫料20 h;短时间高温环境(45 ℃,5 min/次,2次);短时间足底电击(100 V,1 min/次,3次);束缚应激(将大鼠置于狭小、带透气孔的半密闭环境中2 h)。
1.5 行为学检测 CUMS联合单居处理结束后第1、7、14天对各组大鼠进行蔗糖水试验、悬尾试验以评价PSD情况,用Longa评分、足错误试验评价神经功能恢复情况(n=12/组)。Longa评分:0分为无神经功能缺损症状;1分为提尾时右前肢不能完全伸直;2分为向右侧旋转;3分为向右侧倾倒;4分为不能自发行走,意识不清。
1.6 ELISA 在CUMS联合单居处理结束后的第1、7、14天,各组大鼠进行行为学检测后,用10%水合氯醛腹腔注射麻醉(250 mg/kg),断头、取梗死侧(同侧)大脑半球组织,按照脑组织(mg)∶无菌PBS(μL)=1∶10的比例,将脑组织匀浆、混匀,4 ℃、3 000 r/min下离心25 min,取上清液待测。按照大鼠IL-1、IL-18试剂盒的说明书操作(n=6/组)。

2 结果
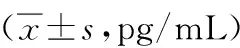
表1 各组脑组织IL-1β、IL-18在各时间点含量比较
注:1、2、3、4分别为sham组、PSD+vehicle组、PSD+control RNA组、siRNA PSD+NLRP3 siRNA组;F值、P值为在各个时间点,PSD+control RNA组与siRNA PSD+NLRP3 siRNA组比较
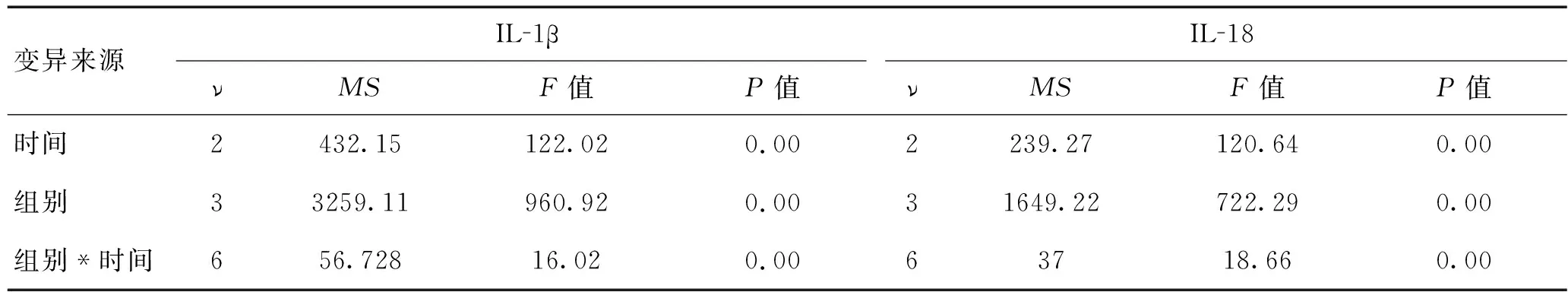
表2 脑组织IL-1β、IL-18在各时间点含量的重复测量方差分析
注:ν为自由度,MS为均方
2.2 抑制NLRP3可减轻PSD大鼠抑郁行为 PSD后第1、7、14天对各组大鼠进行糖水偏好试验和悬尾试验以评价大鼠的抑郁情况。重复测量方差分析显示,PSD后4组大鼠间糖水偏好比例、悬尾时静止不动时间随时间变化趋势差异有统计学意义。时间对大鼠卒中后抑郁行为有影响,且分组与时间之间有交互作(表4)。单因素方差分析和Bonferroni校正进行两两比较发现,PSD后各组大鼠在第1、7、14天5 min内静止不动时间均延长、糖水偏好比例均降低,与PSD+control siRNA组相比,PSD+vehicle组在各时间点的静止不动时间、糖水偏好比例与之无明显差异,而PSD+NLRP3 siRNA组在PSD后第1、7、14天悬尾时静止不动时间均降低、糖水偏好比例升高,差异有统计学意义(悬尾试验中F值分别为2.33、2.33、2.89,n=10-12/组,P<0.05;糖水偏好试验中F值分别为0.042、0.039、0.048,P值分别为0.016、0.048、0.024,P<0.05,表3)。
2.3 抑制NLRP3可促进PSD后小鼠神经功能恢复重复测量方差分析显示,Longa评分的Mauchly球形检验近似χ2=11.97,P=0.003,足错误次数的球形检验近似χ2=9.20,P=0.01,因此用Greenhouse-Geisser调整自由度,各组Longa评分在PSD后随时间变化趋势差异有统计学意义,且时间对Longa评分有影响,但时间与组别间无交互作用(表6)。用Kruska-Wallis检验对各组间Longa评分进行两两比较,与PSD+control siRNA组相比,PSD+vehicle组在各时间点的Longa评分与之无明显差异,而PSD+NLRP3 siRNA组在PSD后第1、7、14天Longa评分均较低,差异有统计学意义(n=10-12/组,H值分别为10.769、10.769、8.571,P值分别为0.006、0.006、0.02,表5)。各组足错误次数在PSD后随时间变化趋势无显著性差异(表6)。用多参数重复测量和Bonferroni校正对每个时间点4组间足错误次数进行两两比较,与PSD+control siRNA组相比,PSD+vehicle组在各时间点的足错误次数与之无明显差异(F值分别为1.38、1.17、1.14,P值为0.774、0.61、1.0,而PSD+NLRP3 siRNA组在PSD后第1、7、14天足错误次数均升高,差异有统计学意义(n=10-12/组,F值分别为1.38、1.17、1.14,P<0.001)。
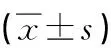
表3 各组大鼠PSD后抑郁行为检测比较
注:1、2、3、4分别为sham组、PSD+vehicle组、PSD+control RNA组、siRNA PSD+NLRP3 siRNA组;F值、P值为在各个时间点,PSD+control RNA组与siRNA PSD+NLRP3 siRNA组比较
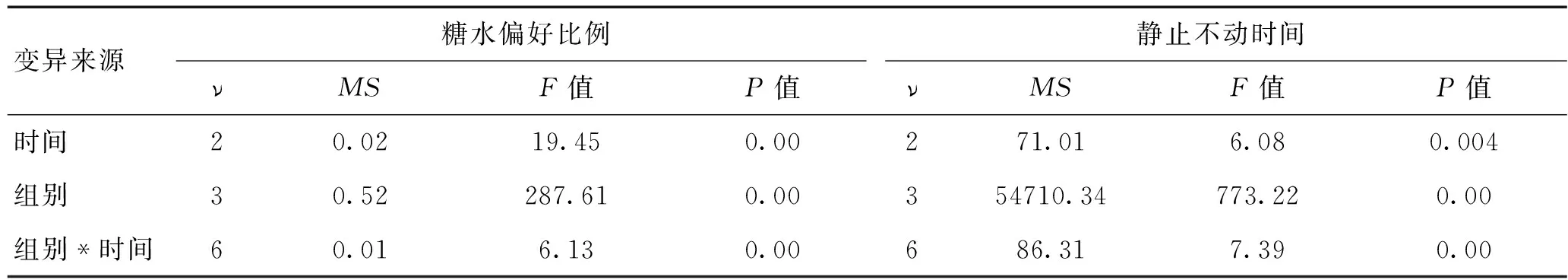
表4 各组大鼠PSD后第1、7、14天抑郁行为检测的重复测量方差分析
注:ν为自由度,MS为均方

表5 各组大鼠PSD后神经功能检测比较
注:1、2、3、4分别为sham组、PSD+vehicle组、PSD+control RNA组、siRNA PSD+NLRP3 siRNA组;F/H值、P值为在各个时间点,PSD+control RNA组与siRNA PSD+NLRP3 siRNA组比较

表6 各组间Longa评分、足错误次数的重复测量方差分析
注:ν为自由度,MS为均方
3 讨论
卒中后抑郁(PSD)是脑卒中后最常见的一种精神障碍,影响患者的神经功能康复和生活质量。卒中后5 a内抑郁症的累计发病率为35%~52%,并且在10 a内任何时候的合并患病率为29%[3],这些加剧了医疗卫生资源的浪费,家庭、社会的负担。PSD目前俨然已成为一种公共卫生问题,因此,深入研究其发病机制及病理过程,积极寻找有效的治疗方法及靶点,已成为大势所趋。
PSD的发病机制比较复杂,其中一种为类似于抑郁症的单胺能假说。研究表明,脑干向左侧大脑皮质上行的氨基化轴突的缺血性损伤使得联系中断,引起额叶、颞叶和基底节区边缘系统的5-HT和去甲肾上腺素合成减少,而这些可能与PSD的发生有关[19-21]。研究表明,PSD的发病与5-羟色胺转运体(5-HTTLPR)、5-HT2A受体和BDNF的基因多态性相关;一项临床研究[22]表明,有卒中前抑郁症病史的老年卒中患者更容易接受SSIR预防性治疗,但是KIM等[23]的大样本量RCT研究并未发现艾司西酞普兰与安慰剂治疗效果之间的显著性差异,因此,该假说仍需进一步研究证实。
近年研究发现,抑郁症的病程发展过程中可能有炎症反应的参与。重度抑郁症患者外周血和脑脊液中炎症因子、趋化因子和可溶性粘附分子水平均上升,且IL-1β、IL-6、TNF能够反映抑郁症患者的炎症水平[24]。经颅磁刺激治疗可通过升高脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)水平或激活BDNF/ERK信号通路、促进大脑海马区细胞分化[25-26],提高大脑皮质及特殊神经网络的葡萄糖代谢水平而改善卒中后抑郁[27-28]。炎性小体是固有免疫反应的重要组成部分,能够识别外来入侵的病原体并启动免疫反应[29-30]。炎性小体主要由T淋巴细胞、巨噬细胞和NK细胞等免疫细胞产生,并启动针对病原体的免疫反应[31-32],其中NLRP3炎性小体是近年研究比较多的。NLRP3炎性小体是由凋亡相关微粒蛋白、NLRP3和半胱氨酸天门冬氨酸酶-1前体组成的一种蛋白复合物,是固有免疫的重要组成部分[34-35]。NLRP3炎性小体活化后,可通过NF-B、MAPK途径活化半胱氨酸天门冬氨酸酶-1,进而切割IL-1β、IL-18前体,产生成熟的IL-1β、IL-18,促进炎症反应[36-38]。本研究中使用NLRP3 siRNA抑制NLRP3炎性小体表达后,大鼠脑组织中IL-1β、IL-18表达均降低,与既往研究结果一致[39]。
既往研究表明,阿尔茨海默病与激活的与硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP)相关的炎性小体,及脑组织中升高的IL-1β与IL-18水平相关[40],而抑制NLRP3炎性小体的表达,可缓解糖尿病大鼠缺血性卒中后灌注再损伤[41-42]。YANG等[43]的研究表明MicroRNA-223可通过下调NLRP3炎性小体表达而对出血性卒中产生神经保护作用。另有研究表明,缺血再灌注损伤后,线粒体功能障碍可引起小胶质细胞和神经元上的NLRP3炎性小体相继被激活,促进脑损伤[44],而抑制NLRP3炎性小体可对卒中大鼠产生神经保护作用[45]。ASHRAF等[46]研究表明,水飞蓟素和水飞蓟素纳米颗粒可通过参与神经发生和抑制NLRP3炎症,预防应激诱导的小鼠抑郁样行为。而且,抑制NLRP3炎性小体可降低半胱氨酸天门冬氨酸酶-1和IL-1β的表达,减轻脑卒中小鼠脑梗死体积和脑水肿程度[47]。MA等[17]的研究表明,NLRP3可通过促进IL-1β成熟而促进脑出血后炎症反应,下调NLRP3可促进脑出血小鼠的神经功能恢复、降低脑水肿程度,减少中性粒细胞向血肿周围渗透。LIANG等[48]的研究表明,P2X7R基因沉默抑制了NLRP3炎性小体的激活,抑制IL-1β/IL-18释放,减轻了脑出血小鼠的脑水肿程度,促进神经功能恢复。本研究中抑制NLRP3炎性小体后,PSD大鼠的Longa评分降低,重复测量方差分析中各组间Longa评分随时间的变化趋势有显著性差异,但时间与组别之间具有交互作用。足错误次数试验中,各组间大鼠足错误次数随时间的变化趋势无显著差异,但在相同时间点,4组间大鼠足错误次数间有显著性差异,且NLRP3 siRNA处理组较对照组的足错误次数高,且差异有统计学意义,这可能是因时间本身对大鼠神经功能有一定的影响。但总的来说,本研究结果与既往研究结果不冲突。
SU等[49]研究表明,敲除NLRP3基因可抑制CUMS诱导的MAPK信号通路的激活,而且基因敲除鼠并未表现出抑郁行为。远志皂苷元可以通过抑制NF-B调节NLRP3信号通路,从而在轻度慢性不可预见性应激诱导的抑郁小鼠模型中发挥抗抑郁作用[50]。刘富群等[51]研究表明,银杏酮酯可增加抑郁大鼠的糖水消耗量、强迫游泳的挣扎时间,这可能是通过调节TLR4/NF-B信号通路,抑制NLRP3炎性小体活性而发挥作用。CHU等[52]研究表明,Nrf2/NLRP3通路可能参与了空气中PM2.5引起大鼠抑郁的病理过程。这与本研究中抑制NLRP3炎性小体后,PSD大鼠糖水偏好比例增加、悬尾时静止不动时间减少的结果一致。
PSD的发病机制非常复杂,包括免疫系统的激活、下丘脑-垂体-肾上腺轴的异常、线粒体氧化应激损伤、BDNF以及基因多态性等遗传学因素。虽然目前已经发现NLRP3炎性小体在抑郁症、缺血性脑卒中、出血性脑卒中及动脉粥样硬化、阿尔茨海默病等疾病中均有作用,但在PSD中的作用仍然研究较少,其中具体机制仍然不明确。本研究运用NLRP3 siRNA下调NLRP3表达,发现抑制NLRP3炎性小体可改善PSD大鼠抑郁症状、促进神经功能恢复,同时降低脑组织中炎症因子表达,但未进行脑组织组织学检测和蛋白质水平检测,未进一步深入探讨NLRP3炎性小体的具体作用机制,存在一定的不足,仍需进一步研究。
