多指标评价美拉德反应产物的抑菌性能
2019-05-25章银良蔡亚玲
章银良 李 鑫 蔡亚玲
1.郑州轻工业学院 食品与生物工程学院 河南郑州 450001 2.食品生产与安全河南省协同创新中心 河南郑州 450001
随着食品行业迅猛发展,一些食品安全问题浮出水面,怎样有效防止食品腐败变质成为食品企业首要解决的问题[1]。
在现代食品工业中最常使用的食品保鲜技术有低温保鲜、气调保鲜,涂膜保鲜和化学保鲜。其中化学保鲜是使用化学药剂对食品进行处理来达到防止食品腐败变质的目的,这些用于食品保鲜作用的化学制剂皆可称之为防腐剂,食品防腐剂一般按照原料来源的不同可划分为化学合成防腐剂和天然防腐剂两种[2,3]。
为防止或减少食品腐败、变色和风味恶化,在食品中常使用人工合成防腐剂(如山梨酸钾、苯甲酸钠等),其使用有一定的限量,并且化学合成抗菌防腐剂均有一定的毒副作用[4],因此对合成防腐剂的担忧使得人们去寻找能发挥同样作用的替代品。美拉德反应在食品加工和储藏过程中是自然发生的一类非酶褐变反应[5],由于其MRPs中含有大量的具有抑菌活性的物质[6],所以将其应用在食品中替代一些合成防腐剂成为日后研究工作的重点。
随着人们安全意识不断提高,天然防腐剂受到国内外的关注,Einarsson[7](1983)等人曾发现美拉德产物的抑菌效果与微生物的种类有关。因此,本文通过对L-赖氨酸和D-果糖MRPs、L-精氨酸和D-葡萄糖MRPs进行抑菌试验来探索其对多种菌生长状况的影响,研究其是否能够抑制不同种菌的生长,为开发营养健康并具有独特MRPs风味的食品提供了一定的理论依据和试验数据,以期为延长食品的货架期提供保障。
1 材料与方法
1.1 材料与试剂
L-赖氨酸、D-果糖、L-精氨酸、D-葡萄糖:Solarbio试剂公司。
生化试剂,蛋白胨、氯化钠、酵母粉、琼脂:北京奥博星生物技术有限公司。
无水乙醇,分析纯,国药集团有限公司。
去离子水。
1.1.1 指示菌
枯草芽孢杆菌(BNCC188080 Bacillus subtilis)、大肠杆菌(Trans·T1、Top10、BL21)、酵母菌(MQ3-23、MQ3-11、MQ1-23、MQ3-21、MQ3-18、MQ2-6)、酿酒酵母(ACCC20032 Saccharomyces carlsbergensis),11种受试菌株来自于本实验室保藏。
菌悬液:细菌在37℃下摇床培养约2h和真菌在28℃下摇床培养约4.5h得到的浓度为(1.0~5.0)106CFU/mL菌液[8]。
1.1.2 指示菌培养基
YPD培养基:蛋白胨2%,酵母粉1%,葡萄糖2%,琼脂2%。
LB培养基:Nacl 1%,蛋白胨1%,酵母粉0.5%,琼脂1.5%~2%。
1.2 仪器与设备
牛津杯(内径6.0mm,外径8.0mm,高10.0mm);检测专用培养皿(内径90mm,高15mm);美国Rainin瑞宁Pipet-Lite XLS移液枪:梅特勒-托利多仪器(上海)有限公司;YZJ-SCT121超净工作台:东莞市华旗净化工程有限公司;SQP电子天平:赛多利斯科学仪器(北京)有限公司;DNP-9162BS电热恒温培养箱:上海新苗医疗器械制造有限公司;HJ-3恒温磁力加热搅拌器:常州国华电器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:广州越特科学仪器有限公司;pH计:瑞士梅特勒-托利多公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;HH-1智能型数显恒温油浴槽:巩义市予华仪器有限责任公司;101-2电热鼓风干燥箱:天津市泰斯特仪器有限公司;DNP-9162BS恒温震荡培养箱:上海新苗医疗器械制造有限公司。
1.3 试验方法
1.3.1 抑菌效果最佳的MRPs制备
依据前期均匀试验中优化得出的制备MRPs的最佳反应条件。准确称取D-葡萄糖3.6032g和L-精氨酸10.4520g(摩尔比1∶3),溶解于90mL的去离子水中,置于恒温磁力搅拌器上搅拌至溶液清澈,再用3mol/L的HCl和3mol/L的NaOH调整溶液pH值至12.0,最后用事先调好的pH值为12.0的溶液定容到100mL,混合均匀后,取10mL反应液转移到25mL具塞试管中,密封严实后,置于120℃恒温油浴锅中反应210min。反应结束后置于冰水中冷却。再准确称取D-果糖10.8096g和L-赖氨酸2.9238g(摩尔比3∶1)溶解于90mL的去离子水中,制备条件为加热时间90min、反应初始pH值调至10.0、温度120℃,余下制备步骤同上。
1.3.2 MRPs抑菌效果的研究
1.3.2.1 牛津杯法测定抑菌活性
按照Huang TH(2012)[9]、李冬梅[10](2006)等的方法稍作改动,在无菌条件下,将经过高压蒸汽灭菌的固体培养基(酵母用YPD培养基,枯草芽孢杆菌和大肠杆菌用LB培养基)冷却温度至40~45℃之间,倒平板。取200μL浓度为(1.0~5.0)×106CFU/mL的菌液转移至固体培养基平板表面并涂布均匀,将涂布棒灼烧杀菌然后冷却,用于均匀涂布菌液。用经灭菌的镊子夹取已灭菌的牛津杯摆放于中央,用移液枪吸取200μLMRPs加入牛津杯内(细菌加入果糖和赖氨酸MRPs,酵母菌加入葡萄糖和精氨酸MRPs),同时做试剂空白和阳性对照。酵母阳性对照试剂用乳酸,枯草芽孢杆菌和大肠杆菌用氯霉素,放入恒温培养箱中培养。测量抑菌圈直径,并计算3次平行试验的平均值。
1.3.2.2 菌落总数的测定
参考GB4789.2-2016《食品微生物学检验菌落总数测定》进行。用100μL微量移液枪分别吸取培养好的菌液100μL,沿管壁缓慢注于盛有900μL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管使其混合均匀,制成1∶10的样品菌液。然后按照以上步骤制备10倍系列稀释菌液。每种菌液分别得到以下七个浓度梯度:10-1、10-2、10-3、10-4、10-5、10-6、10-7。之后通过预试验选择适宜稀释度(酵母菌稀释10-4、细菌稀释10-5)的菌液,分别吸取40μL菌液和200μLMRPs(细菌加入果糖和赖氨酸MRPs,酵母菌加入葡萄糖和精氨酸MRPs)混合后加入两个培养基,用涂布棒涂布均匀。同时取40μL菌液分别加入另两个培养基,涂布均匀作阴性对照。再分别取200μLMRPs加入两个无菌培养基作空白对照。涂布结束后,将平板翻转,细菌移至37℃恒温培养箱培养12h,酵母菌移至28℃恒温培养箱培养36h。培养完成后,观察菌的生长情况,进行菌落计数。
1.3.2.3 抑菌率的测定
参照黄国文[11](2017)、雷欢[12](2017)等的方法。取100mL液体培养基和100mL混合液体培养基(10mL MRPs+90mL液体培养基)分别作为A1、A2的空白对照组。然后用紫外分光光度计分别测试其吸光度(酵母菌培养液在560nm处测量,细菌培养液在600nm处测量),并记录。取22支试管分成两组(各11只),第一组每管加入5mL含有MRPs的液体培养基和40μL菌液,第二组每管加入5mL液体培养基与40μL菌液,分别贴上标签,塞上塞子用报纸包裹,放入恒温震荡培养箱里细菌37℃培养4h,酵母菌28℃培养8h,培养完成后分别用紫外分光光度计测量其吸光度,每对试管做3组平行(细菌组加入果糖和赖氨酸MRPs,酵母菌组加入葡萄糖和精氨酸MRPs)。
抑菌率计算公式如下:
抑菌率=(A1-A2)/A1
式中:
A1为不加MRPs组培养菌液的吸光度;
A2为加入MRPs培养的菌液吸光度
1.3.2.4 最小抑菌浓度(MIC)的测定
参照Anis Ben Hsouna[13](2011),Sweetie R.Kanatt[14](2008)等的方法。采用二倍连续稀释法测定[15]MRPs的最小抑菌浓度。取10支无菌试管编号,每支试管各加入5mL的液体培养基。无菌移液枪吸取5mLMRPs至1号试管,混匀后从1号试管吸取5mL至2号试管,以此类推,直至9号试管(弃去5mL),分别将MRPs稀释2、4、8、16、32、64、128、256、512倍,除9号试管外各加入40μL制备好的菌悬液,9号作为阴性对照,10号作为阳性对照。摇床培养后,从每支试管各吸取40μL至营养琼脂培养基表面,并用无菌涂布棒涂布均匀,每支试管做3个平行。上述操作完毕后,将所有平板放置于(细菌37℃,真菌28℃)恒温培养箱中培养24h后,查看各平板内各菌落的生长情况,其中完全没有菌生长的平板对应的最低稀释浓度即为最小抑菌浓度(MIC)[16]。
2 结果与分析
2.1 MRPs对不同菌种的抑菌活性的比较
2.1.1 牛津杯法测定抑菌活性
以抑菌圈直径为测试指标,美拉德反应产物对不同菌种的抑制效果分别用SPSS 19.0软件处理数据,试验结果如表1和表2所示。
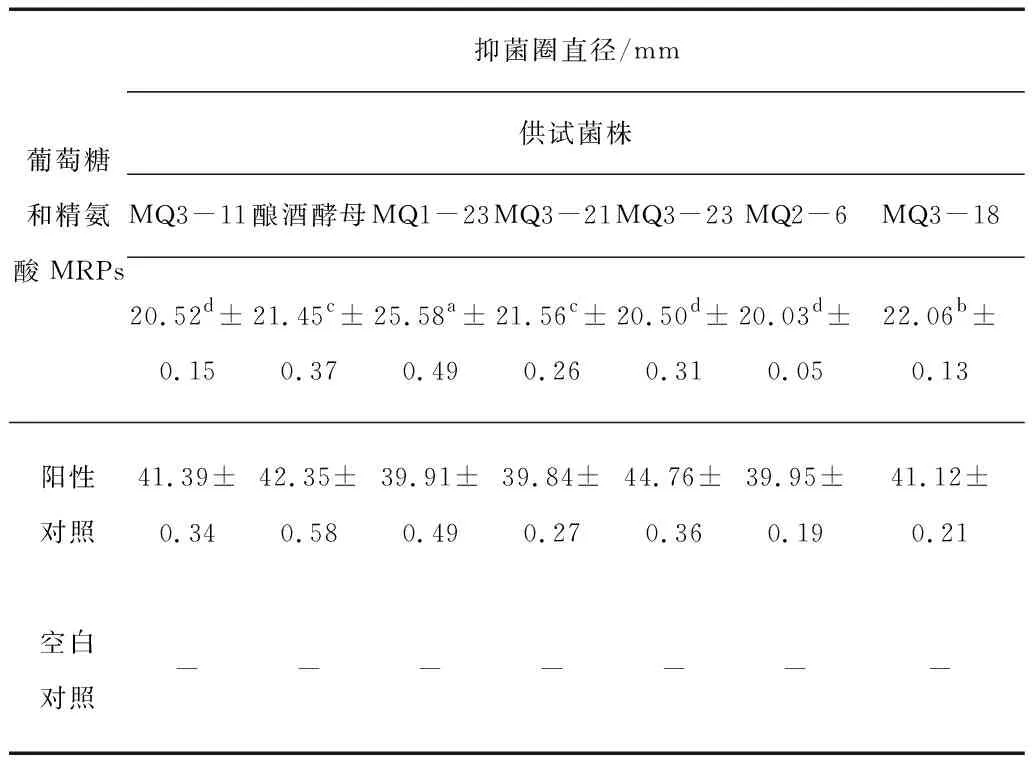
表1 MRPs对不同真菌的抑菌作用
如表1所示,通过方差分析和多重比较,得出葡萄糖和精氨酸MRPs对所测酵母菌均有不同程度的抑制,抑菌作用从大到小为MQ1-23>MQ3-18>MQ3-21>酿酒酵母>MQ3-11>MQ3-23>MQ2-6,其中对MQ1-23的抑制效果最好。因为牛津杯直径为8mm,如果抑菌圈直径小于8mm则代表无明显的抑菌效果,所以从表2我们可以得出,果糖和赖氨酸MRPs对BL21抑制作用比较弱。同一浓度的MRPs对不同菌种的抑菌效果也不相同,其中抑菌作用从大到小为Trans·T1>TOP.10>枯草芽孢杆菌>BL21。
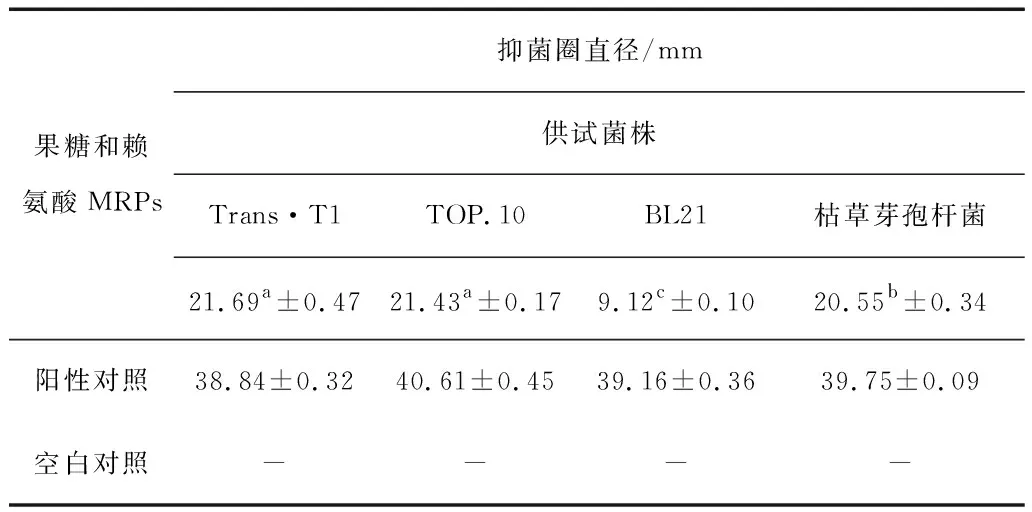
表2 MRPs对不同细菌的抑菌作用
注:1.表中“-”表示抑菌圈直径≤8mm,无明显抑菌作用。
2.同一行中,具有不同字母的表示差异显著(p<0.05),具有相同字母的表示差异不显著(p>0.05)。
从试验结果中可以看出美拉德反应产物对真菌和细菌均有一定的抑菌效果。其中葡萄糖精氨酸MRPs对MQ1-23酵母菌的抑制作用最强,抑菌圈直径为25.58±0.49mm;果糖赖氨酸MRPs对大肠杆菌Trans·T1的抑制作用最强,抑菌圈直径为21.69±0.47mm。
2.1.1 菌落总数法测定结果分析
以菌落总数为指标,美拉德反应产物对不同菌种的抑制效果如图1所示。
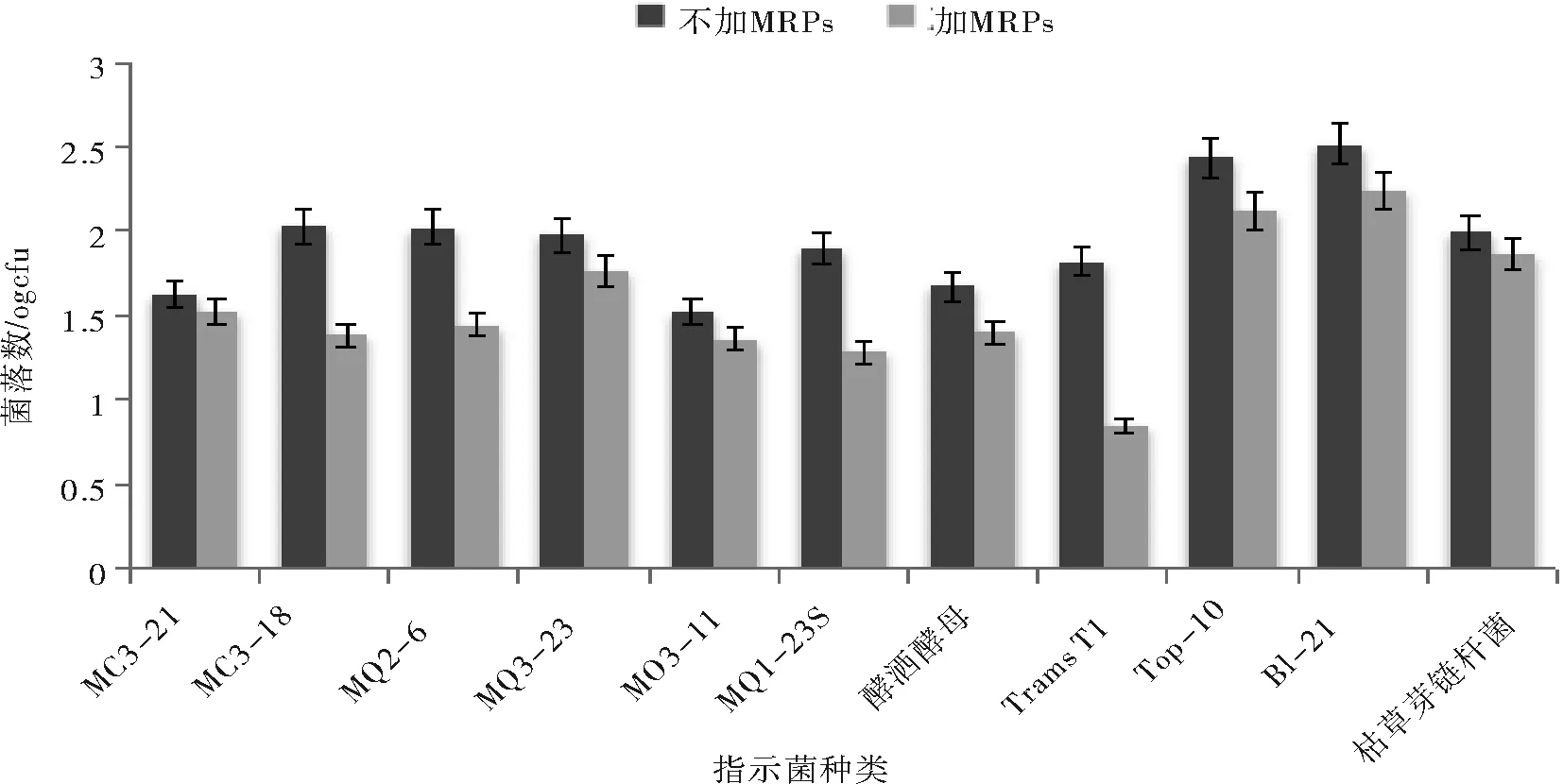
图1 不同MRPs对细菌和真菌的抑菌作用Fig.1 The bacteriostatic effects to bacereia and fum juus from
从图1中我们可以看到在加入美拉德反应产物后大肠杆菌Trans·T1从66减少到7,酵母菌MQ3-18从107减少到24,这两种菌的菌落总数减少的幅度最大分别为89.39%和77.57%,酵母菌MQ1-23加入MRPs后菌落总数从79下降至19,减少幅度也很可观为75.95%且仅次于MQ3-18位居第二。从图1中我们还可以看出MRPs对这11种指示菌皆有不同程度的抑制作用,这与Einarsson[7](1983)等人曾提出的美拉德产物的抑菌效果与微生物的种类有关这一发现相符。
2.1.2 抑菌率法测定结果分析
以吸光度为指标,美拉德反应产物对不同菌种的抑制效果如图2所示。
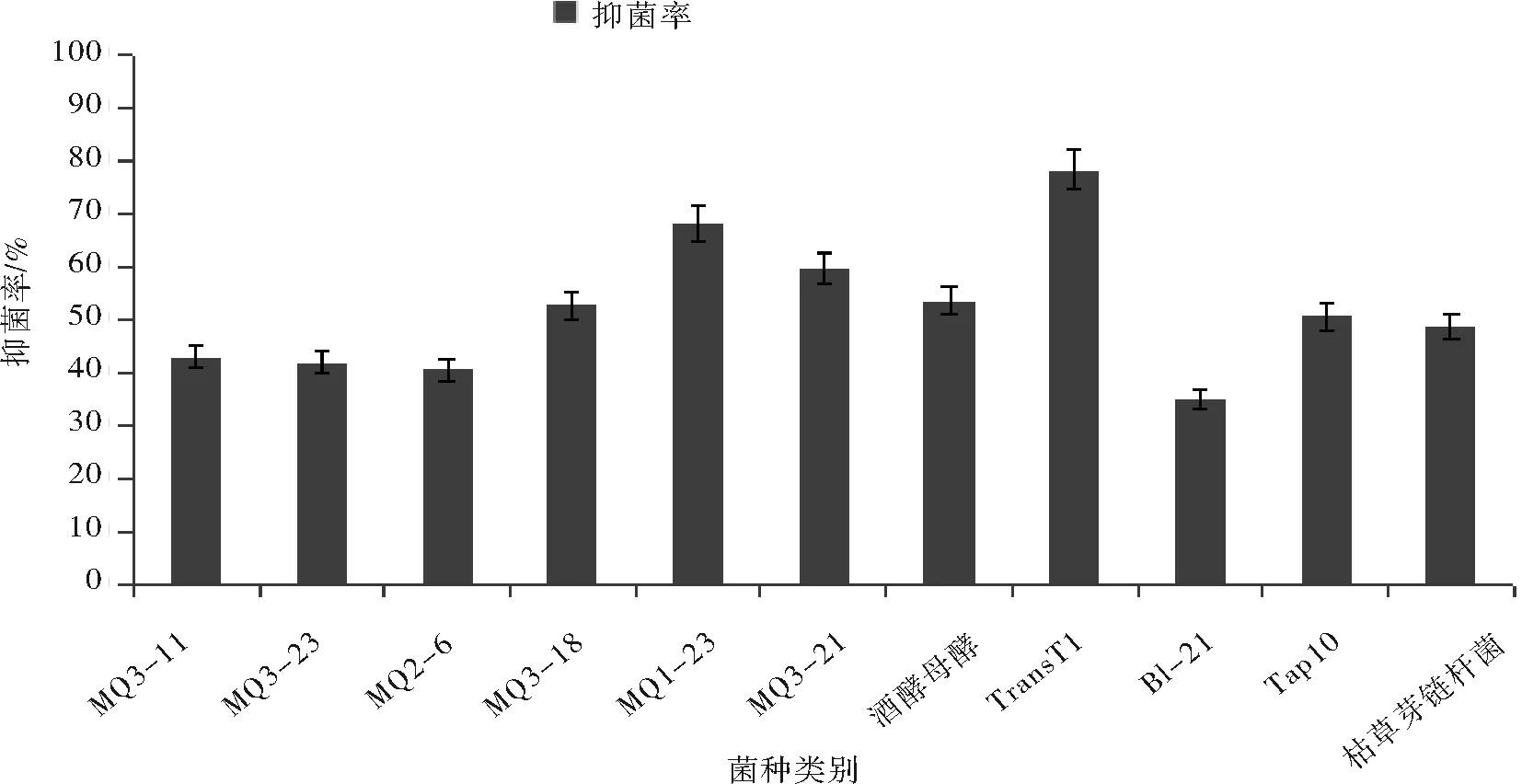
图2 不同MRPs对细菌和真菌的抑制效果Fig.2 The bacteriostatic effests to bacreria and fum jus from differemt MRPs
由图2可得不管是细菌还是真菌,抑菌培养完成后,不添加美拉德反应产物时菌液的吸光度均高于添加美拉德反应产物时菌液的吸光度,说明MRPs对这些菌的生长是有抑制作用的。从图2中我们可以得出如下结论:美拉德反应产物对以上11种菌抑制强度存在差异,其中葡萄糖精氨酸对MQ2-6、MQ3-23、MQ3-11的抑菌率偏小,可能是因为在菌液培养的开始阶段MRPs中未反应完全的葡萄糖促进了酵母菌的生长[17]。另外葡萄糖精氨酸MRPs对MQ1-23抑制作用最强,抑菌率为68.15%;果糖赖氨酸MRPs对大肠杆菌Trans·T1的抑制效果最好,抑菌率为78.60%。
2.1.3 最小抑菌浓度(MIC)法测定结果分析
按照1.3.2.4所述试验方法及步骤,采用二倍连续稀释法测定MRPs对11种常见腐败菌的最小抑菌浓度(MIC)结果见表3。
如表3所示,MRPs对这11种指示菌均有不同程度的抑制作用。当MRPs浓度在稀释16倍以下时,Trans·T1、TOP.10、枯草芽孢杆菌均不生长;当MRPs浓度在稀释倍数在4倍以下时,BL21、MQ3-11、MQ3-23、MQ3-18、MQ3-21、酿酒酵母均不生长;其中抑制酵母菌MQ1-23所需MRPs最小抑菌浓度最小为稀释倍数在32倍时。
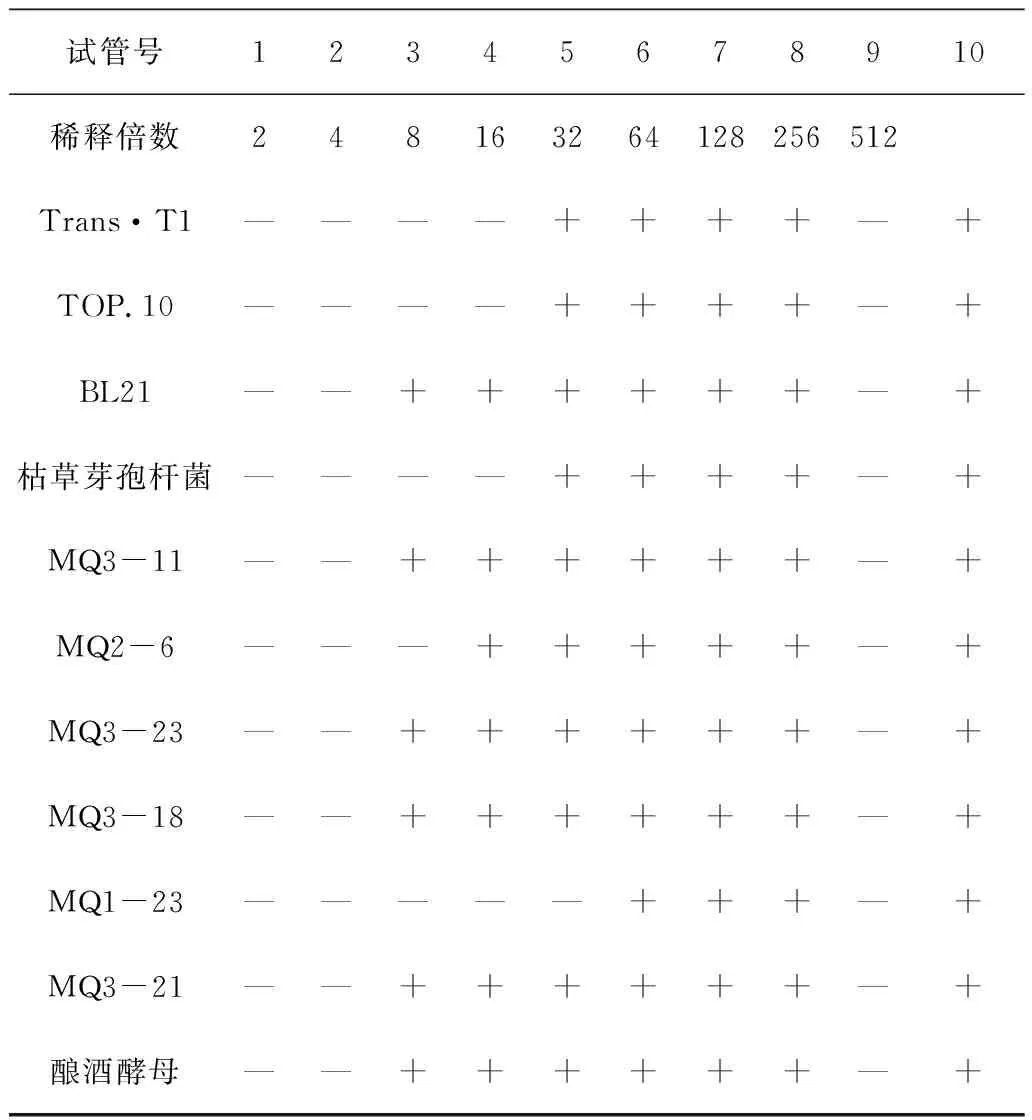
表3 MRPs对供试菌的最小抑菌浓度
注:“—”表示无供试菌生长;“+”表示有供试菌生长;9号试管为阴性对照;10号试管为阳性对照。
3 结论
我们用抑菌圈、菌落总数、抑菌率、最小抑菌浓度四个指标来检测MRPs对食物中常见细菌和真菌的抑制效果,并从4组数据中可以得出MRPs对大肠杆菌BL21的抑制效果比较弱,但对其它十种供试菌均有不同程度的抑制作用,并且综合分析四个指标可以得出MRPs对酵母菌MQ1-23和大肠杆菌Trans·T1的抑制效果是最明显的。此外,由最小抑菌浓度分析可知,随着MRPs添加量的增大,抑菌作用会逐渐增强。因此可以考虑MRPs作为一种防腐剂添加入食品中,提高其抑菌能力、保持其感官特性并延长货架期。
