藻蓝蛋白及其水解物促进玉米直支链淀粉回生机理研究
2019-05-24王雪青蒋荣霞郭志鹏连喜军郭俊杰
王雪青,蒋荣霞,郭志鹏,连喜军,郭俊杰
藻蓝蛋白及其水解物促进玉米直支链淀粉回生机理研究
王雪青,蒋荣霞,郭志鹏,连喜军※,郭俊杰
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
藻蓝蛋白是螺旋藻中对人体具有多种保健功能的蛋白,初步发现其具有明显促进玉米淀粉回生的作用。为了进一步探索其促进玉米淀粉回生的机理,该文将1%和10%藻蓝蛋白及其水解物添加至玉米直链、支链及其混合淀粉中,测定其对淀粉回生的影响,通过X-射线衍射、差示扫描量热、红外和固体核磁分析藻蓝蛋白及其水解物促进玉米淀粉回生机理。研究结果表明,添加1.0%藻蓝蛋白对直链淀粉回生率没有影响,使支链淀粉回生率提高了61.4%;而添加量为10%的藻蓝蛋白使直链淀粉回生率提高了60.4%,使支链淀粉回生率提高了69.6%。藻蓝蛋白水解肽低的添加量(1.0%)对玉米直链的回生率影响不显著,但使支链淀粉的回生提高了28.1%;水解肽高添加量(10.0%)使玉米直链淀粉的回生率提高了184.7%,使玉米支链淀粉的回生率提高了47.0%。紫外可见扫描显示碱性蛋白酶水解可使处于藻蓝蛋白结构中心的藻蓝素外露出来。X射线结果表明藻蓝蛋白与玉米直链支链淀粉混合回生后分别产生一个衍射角为2为16.44º 、16.60º尖锐衍射峰。差热结果显示,藻蓝蛋白与玉米支链淀粉混合、藻蓝蛋白水解物与玉米直链淀粉混合后,所得回生淀粉均失去结晶峰,而出现唯一重结晶峰。红外和13C固体核磁结果表明,藻蓝蛋白通过精氨酸氨基与玉米支链淀粉还原端醛基形成氢键,利用藻蓝蛋白中疏水性氨基酸驱离玉米支链淀粉侧链末端水分子,促使支链淀粉末端双螺旋解旋,加快了支链淀粉末端链间氢键形成,提高了其回生率;而藻蓝蛋白水解物中半胱氨酸巯基和玉米直链淀粉还原端醛基在与直链淀粉混合回生过程形成氢键,通过分子甩动使直链淀粉双螺旋解开,大大促进了玉米直链淀粉间形成氢键,提高了其回生率。该研究提供了一种提高玉米淀粉回生率的新技术。
农产品;淀粉;水解;回生淀粉;藻蓝蛋白;回生机理
0 引 言
作为一种膳食纤维,回生抗性淀粉具有通便、控制体质量、辅助控制糖尿病、通过促进盲肠乳酸菌繁殖来提高人体免疫力等功效[1]。但低的产率是限制其产业化的瓶颈。为了提高回生淀粉制备率,国内外研究人员在淀粉乳浓度、贮藏温度和时间、干燥和挤压工艺、微波、超声波处理、酶处理、添加生物大分子有机物等方面做了大量的研究。质量分数为1%和10%的荞麦淀粉乳在0 ℃贮藏回生率较高,达到30.0%以上,而5%、15%和20%浓度下2和6 ℃下贮藏淀粉回生率高[2]。在-18 ℃下冷冻贮藏条件下,糯米淀粉浓度由1%增加到25%,冷冻1 d糯米淀粉的最低回生率由4.5%增加到15.7%;10%~15%的糯米淀粉乳在此条件下贮藏7 d,糯米淀粉的回生率会大于40.0%[3]。在真空干燥温度30 ℃,真空度0.08 MPa时,老化98 h,甘薯淀粉回生率达到20.9%[4]。挤压处理及次数也能影响回生率,重复挤压处理可以使玉米淀粉回生率提高到40%以上[5],3次重复回生和高低温循环老化也能明显促进淀粉的回生[6-7]。超声波处理可以使甘薯淀粉的回生率提高2.28倍[8],而电解和微波联合处理可以使甘薯淀粉的回生率提高1倍[9]。普鲁兰酶和高压湿热处理可以使黑豆淀粉回生率提高到41.3%[10],而中温α-淀粉酶处理可以将甘薯淀粉的回生率提高1.68倍[11]。由于普鲁兰酶和淀粉酶使淀粉侧链断裂而产生更多的直链淀粉,从而增加淀粉回生淀粉的成核与结晶速率[12]。根据晶体形成理论,添加晶种也能增加回生淀粉的生成,课题组曾经采用草酸侵蚀马铃薯回生淀粉制备晶种促进玉米淀粉的回生,使得玉米淀粉的回生率由7.37%提高至11.46%[13]。虽然上述的物理方法和化学酶法可以在一定程度上提高回生淀粉的制备率,但未超过45%,规模化生产竞争力不强。因此,寻找更有效快捷的提高淀粉回生率方法及相关机制的研究一直是该领域的研究热点之一。近年来,一些有机大分子多糖和蛋白通过添加至淀粉中与其共回生,可以对回生率有显著的影响。Luo等[14]研究发现,添加淀粉量5%~7.5%菊糖会促进玉米支链淀粉回生,课题组前期研究也发现[15],添加醇溶蛋白可使玉米淀粉的回生率由9.4%增加到29.3%。最近课题组进一步通过分析核磁、红外等提出了这种含有醇溶蛋白回生淀粉的一种可能结构[16]。为了寻找能更加有效提高淀粉回生率的有机大分子,课题组尝试利用藻蓝蛋白及其水解物促进玉米淀粉回生,发现藻蓝蛋白及其水解物均可促进玉米直支链淀粉的回生,添加淀粉质量分数 为10.0%的藻蓝蛋白水解物可以使玉米直链淀粉的回生率提高到50%以上。通过固体核磁和红外分析,提出了藻蓝蛋白及其水解物促进玉米直支链淀粉回生的可能 机制。
1 材料与方法
1.1 材料与仪器
玉米淀粉、螺旋藻(程海湖牌)为市售;PBS(phosphate buffer saline)磷酸盐缓冲液购自上海哈灵生物科技有限公司、NaCl、NaOH、(NH4)2SO4、BaCl2和CH3CH2OH购自天津鑫桥化工贸易有限公司;高温淀粉酶、脂肪酶、碱性蛋白酶由天津市诺奥科技发展有限公司提供。
YXQG02手提式电热压力蒸汽消毒器,山东安德医疗科技有限公司;DH-101-3BS电热恒温鼓风干燥箱,天津市中环实验电炉有限公司;BCD-229KB海尔冰箱,青岛海尔股份有限公司;L535-1离心沉淀机,湖南湘仪离心机仪器有限公司;Bio-Rad FES135红外分光光度计,美国Bio-Rad公司;岛津UV-2450/2550紫外可见分光光度计;DSC204C 型差示扫描量热分析仪(德国Netzach 公司);D8 ADV ANCE型X 射线衍射仪(德国Bruker AX S公司);Varian Unity 300 MHz 核磁共振谱仪(美国Varian公司)。
1.2 试验方法
1.2.1 藻蓝蛋白的提取
藻蓝蛋白的提取参照课题组前期的试验方法[17]。1)细胞破碎:取400 g螺旋藻粉溶于4 000 mL的10 mmol/L磷酸缓冲盐溶液(0.01 mmol/L pH值为6.8 PBS缓冲液)中浸泡4 h,于-20~4 ℃之间反复冻融4次,每次融化后用超声波辅助破碎,功率400 W超声6 s间隔15 s,超声次数60次。然后在转速10 000 r/min、温度4 ℃条件下下冷冻离心30 min,弃沉淀取上清液。2)盐析:离心后的蓝色上清液样品,在4 ℃条件下缓慢加入(NH4)2SO4直至浓度为28%饱和,继续搅拌使(NH4)2SO4充分溶解,4 ℃静置过夜。而后在10 000 r/min,4 ℃下冷冻离心30 min除去少量杂蛋白,收集上清液。其上清液再由浓度为55%饱和硫酸铵沉淀,4 ℃下静置4 h后以10 000 r/min离心30 min,收集蓝色蛋白沉淀。3)透析:用PBS溶液收集盐析所得沉淀,装入透析袋中透析除去(NH4)2SO4盐(截留分子量8~14 kD)。将装有样品的透析袋置于0.01 mol/L pH值为6.8的PBS缓冲液中透析,多次更换缓冲液,用BaCl2检测无沉淀即为透析终点。透析后,所得样品可用聚乙二醇进行浓缩,冷冻干燥后4 ℃保存备用。对冻干的藻蓝蛋白经过适量稀释后,分别测定其波长为620和280 nm的吸光度值,以吸光度620/280比值来表示纯度,经此法制备的藻蓝蛋白纯度为1.35。
1.2.2 藻蓝蛋白酶水解
将纯化后的藻蓝蛋白用碱性蛋白酶水解制备藻蓝蛋白水解物,碱性蛋白酶水解条件:蛋白液pH值为8.0、酶解温度40 ℃、酶解时间60 min加酶量为蛋白质质量的0.1%。酶解完的水解液冷冻干燥后备用。
1.2.3 玉米直支链淀粉制备
依照课题组方法制备的玉米直支链淀粉[18]。将质量分数10%~15%的玉米淀粉用水分散后,于95 ℃水浴锅中搅拌糊化2 h至透明,120 ℃进一步高压(0.2 MPa)糊化40 min。冷却至常温后放冰箱中4 ℃老化2 d,每100 mL淀粉乳中加入0.6 mL高温淀粉酶酶解,离心得到沉淀水洗后得到回生淀粉。将得到的回生淀粉用4 mmol/L KOH溶解后加入3倍体积的正丁醇,充分搅拌后离心分离得到沉淀即为玉米直链淀粉。上清液中加入1倍体积乙醇得到沉淀即为玉米支链淀粉。得到的玉米直支链淀粉再按照文献[19]的方法除去脂肪和蛋白,水洗后成为纯化后玉米直支链淀粉。进行回生试验的玉米直支链淀粉不进行干燥,以湿淀粉形式保存于4 ℃冰箱,取10 g湿淀粉干燥后得到淀粉干湿比例。
1.2.4 玉米直、支链淀粉与藻蓝蛋白及其水解物的共同回生
取相当于干淀粉10 g的玉米直链、支链湿淀粉,按照干燥淀粉质量比例的1.0%、10.0%分别将藻蓝蛋白及其水解物与玉米直链和支链淀粉(湿的状态)进行混合,加入20 mL 蒸馏水,95 ℃手动搅拌、糊化1.5 h,进一步高温高压(0.1 MPa,121 ℃)糊化30 min,冷却后于4 ℃冰箱老化48 h。之后采用文献[15]的方法测定回生率。
1.2.5 测试方法
探索藻蓝蛋白及其水解物促进玉米直支链淀粉回生机制测定紫外可见吸收、红外、固体核磁、X射线衍射时,藻蓝蛋白采用纯品(西安明朗生物科技有限公司纯度98%),添加量为淀粉量的30%。藻蓝蛋白及其水解物的紫外可见吸收测定:将藻蓝蛋白及其水解物用着蒸馏水稀释后静置30 min,用岛津UV-2450/2550紫外可见分光光度计测定最大吸收波长;X射线衍射分析:将粉末状样品放入D8 ADV ANCE型X射线衍射仪(德国Bruker AX S公司),采用Cu靶KT射线(0.154 nm)照射,管压为40 kV,管流为40 mA,扫描速度为0.1 (°)/s。红外分析:将样品用光谱纯KBr压片,在27 ℃下用红外分光光度计Bio-Rad FES135测定淀粉红外吸收,扫描范围4 000~400 cm-1;固体核磁分析:将蛋白或淀粉样品置于密封的 PENCIL型(5-mm)氧化锆转子中,在Varian Unity 300 MHz核磁共振谱仪上进行,共振频率为75 kHz,对应90°脉冲宽度为3.4s,使用4 mm的双共振HX CP/MAS(交叉极化/魔角旋转)探头,魔角旋转(MAS)的速度由转速控制柜自动控制在9~12 kHz,试验温度范围是28~120 ℃。差示扫描量热分析:采用DSC204C型差示扫描量热分析仪(德国Netzach公司)进行分析测试,升温速率为0.02 ℃/s。
1.3 统计学处理
变量以平均值±标准差(¯±),表示,采用检验。采用SPSS软件进行分析。
2 结果与分析
2.1 藻蓝蛋白及其水解物对玉米直支链淀粉回生的影响
表1为藻蓝蛋白及其水解物对玉米直支链淀粉回生率的影响数据。由表1可知,添加1.0%藻蓝蛋白对直链淀粉回生率没有影响,而10%的添加量,则表现出有较显著的促进作用,使回生率从对照的27.0%提高至43.3%,提高了60.4%, 支链淀粉提高了69.6%;添加1%藻蓝蛋白对支链淀粉产生明显的促进回生作用,回生率由26.7%增至43.1%,提高了61.4%,而当添加量从1%增至到10%,支链淀粉回生率再增加效果不显著,仅从43.1%提高到45.3%,提高了5.1%。对于藻蓝蛋白水解肽来说,低的添加量(1.0%)对玉米直链的回生率影响不显著,但对支链淀粉的回生显示出促进作用(提高了28.1%),高添加量(10.0%)显示出极强的促进玉米直链淀粉的作用,回生率从27.0%增加到76.9%,增加了184.7%,而玉米支链淀粉的回生率从26.7%增加到39.2%,仅增加了47%。
因此,对于玉米直链淀粉,随着藻蓝蛋白或水解肽的添加量增加,促进回生率也随之增加。但是对于玉米支链淀粉仅是低的添加量,就显示出其有效的促进作用,再通过增大添加比例来增加回生率,效果不显著。这可能是由于玉米直支链淀粉与藻蓝蛋白或肽形成的氢键部位不同影响的结果。

表1 藻蓝蛋白及其水解物对玉米直支链淀粉回生率的影响
注:* 为<0.05, ** 为<0.01。
Note: * means<0.05, ** means<0.01.
2.2 紫外可见扫描最大吸收分析
图1为藻蓝蛋白及其水解物的紫外可见最大吸收光谱图。由图1可知,藻蓝蛋白的紫外可见最大吸收波长为258.0、616.0 nm,无374 和 340 nm附近的藻胆素特征吸收峰,这与文献报道相似[20-21]。藻蓝蛋白水解物的紫外可见最大吸收波长为258.0、346.0、613.5 nm,出现了藻胆素的特征吸收,说明碱性蛋白酶水解使处于藻蓝蛋白结构中心的藻蓝素外露出来。

图1 不同浓度藻蓝蛋白及其水解物紫外可见扫描光谱图
2.3 X射线衍射分析
图2为玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉的X射线衍射图。由图2a可知,试验采用的藻蓝蛋白并非单个晶体,2衍射角为9.52°、21.34°、31.52°、45.22°,这与文献报道葛仙米中藻蓝蛋白的非晶体衍射(2衍射角为16.66°、20.68°、23.70°、29.06°、30.12°、33.66°、37.90°、40.32°、57.54°)不同[22]。由图2b可知,藻蓝蛋白水解后晶体2衍射角缺失31.52°和45.22°的2个晶面,而增加了2衍射角为8.78°的1个晶面。即晶体面间距小的晶面减少了而面间距比较大晶面增多了。由图2c、2d可知,回生玉米直链淀粉衍射角2为16.76°、22.16°,回生玉米淀粉中支链淀粉衍射角2为17.22°、19.28°,这与课题组前期研究基本一致[23]。由图2e可知,玉米直链淀粉与藻蓝蛋白混合回生后,衍射角2为22.16°的尖锐峰消失,增加了衍射角2为19.36°、23.52°的衍射峰,但这2个峰周围有许多衍生峰,峰型不尖锐。由图2f可知,玉米直链淀粉和藻蓝蛋白水解物混合回生后衍射角2为16.44°的峰明显变得更加尖锐,说明藻蓝蛋白水解物可加速玉米直链回生淀粉在此晶面上的聚集,从而大大加速了其回生的速度。由图2 g可知,玉米支链淀粉和藻蓝蛋白混合回生后衍射角2为16.60°的峰明显变得更加尖锐,显示藻蓝蛋白可加速玉米支链回生淀粉在此晶面上的聚集,加速晶面形成。根据促进玉米直支链淀粉回生样品(2f、2g)尖锐衍射角减小可知,两种物质分别促进玉米直支链淀粉回生机理可能跟它们加入后2衍射角为16.4°~16.7°的面间距增大有关。图2e和2h中藻蓝蛋白与直链淀粉、藻蓝蛋白水解物与支链混合回生后淀粉的回生率增加不多,其2衍射峰也未出现明显的尖锐峰,这也进一步说明尖锐衍射峰的出现和淀粉回生率提高有相关性。
2.4 差示扫描量热分析
图3玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉差示扫描量热图(differential scanning calorimeter, DSC)。由图3可知,藻蓝蛋白有2个晶体融化峰(134.40、140.69 ℃)(图3a),藻蓝蛋白水解物有1个主峰(112.86 ℃)和3个小峰。玉米直链回生淀粉有3个晶体融化峰(89.61、95.48、109.74 ℃),玉米支链回生淀粉有2个晶体融化峰(108.97、143.14 ℃)。这些晶体融化温度均低于甘薯直支链回生淀粉[24],这可能与玉米直支链淀粉平均链长比甘薯直支链淀粉的短有关。回生淀粉晶体中低温为晶体融化温度,高温为淀粉重结晶融化温度[25]。由图3a、3c、3d、3e和3g可知,藻蓝蛋白添加入玉米直支链淀粉后,其所得直链回生淀粉融化温度由109.74升高到126.93 ℃,所得支链回生淀粉融化温度由143.14降低到139.74 ℃,说明藻蓝蛋白参与了玉米直支链的回生,参与回生的藻蓝蛋白分子链长介于玉米直链和支链淀粉之间。值得注意的是:藻蓝蛋白与玉米支链淀粉混合回生后只有淀粉重结晶峰,而没有晶体峰,此峰温度与藻蓝蛋白重结晶峰接近。说明玉米支链淀粉中分子链长与藻蓝蛋白接近的分子数量多,这些分子之间更容易形成氢键,从而产生一种全新的含藻蓝蛋白的回生功能淀粉。由图3b、3c、3d、3f和3h可知,藻蓝蛋白水解物添加入玉米直支链淀粉后,其所得直链回生淀粉融化温度由109.74升高到118.37 ℃,所得支链回生淀粉融化温度由143.14降低到130.02 ℃。与藻蓝蛋白促进玉米支链淀粉结果类似,藻蓝蛋白水解物促进玉米直链淀粉回生的差示扫描量热图(DSC)(图3f)中,直链回生淀粉的晶体融化峰消失,只出现重结晶峰118.37 ℃,这个融化温度与藻蓝蛋白水解物的重结晶融化峰接近。其他2个低温峰应该是藻蓝蛋白水解物不同分子晶体峰,与直链淀粉无关。从差热融化温度可知,藻蓝蛋白及其水解物分别促进玉米支链和直链淀粉回生,是因为这种结合能够解开玉米直支链淀粉双螺旋,为玉米直支链淀粉间形成氢键创造便利条件,进而加速淀粉大分子晶体形成速度,大幅提高淀粉的回生率。
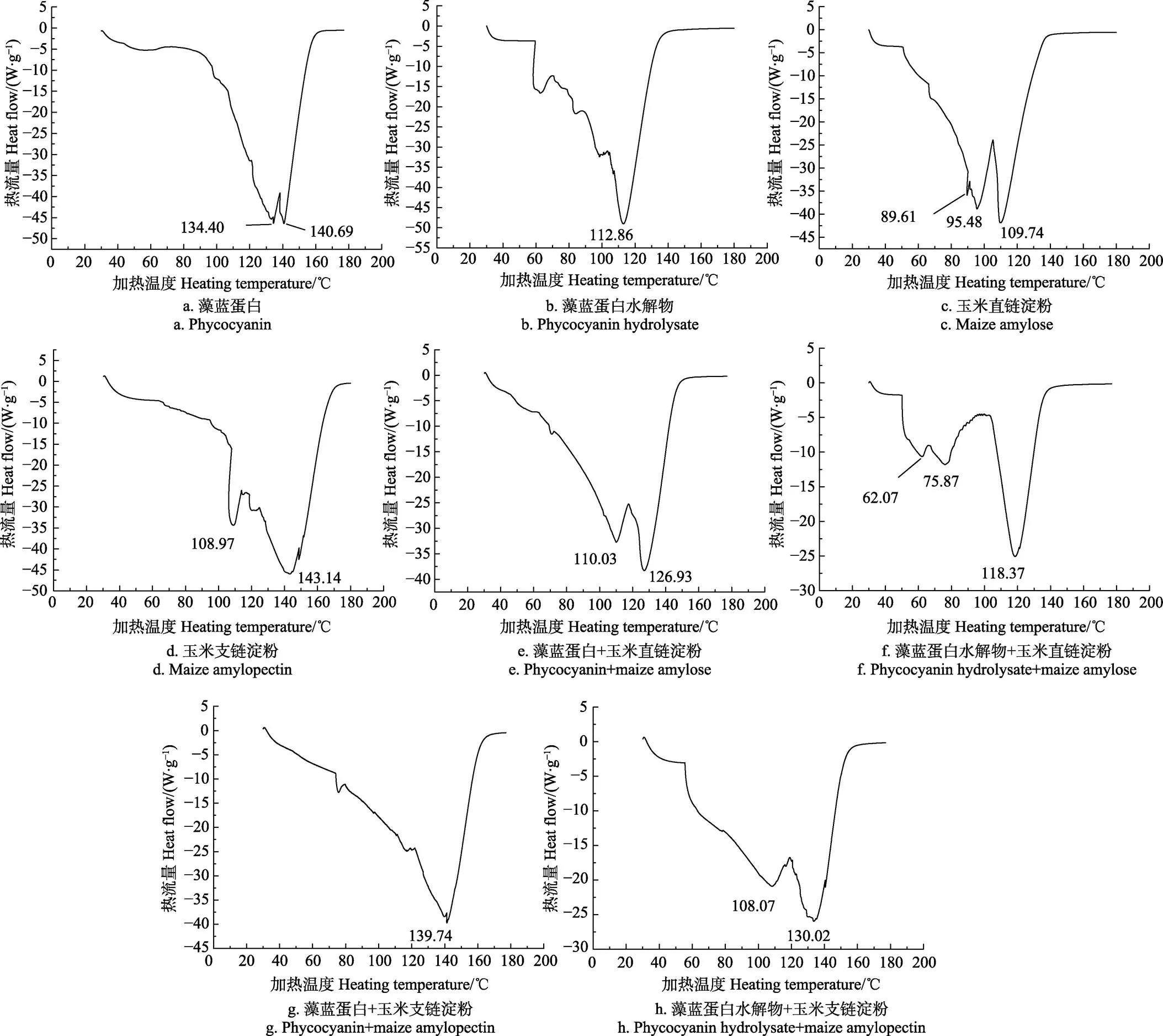
图3 玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉差示扫描量热图
2.5 红外光谱分析
图4为玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉的红外光谱图。3 282~3 315 cm-1附近处的吸收峰为淀粉分子的O-H的伸缩振动或者蛋白分子的N-H伸缩振动,2 930 cm-1附近较尖锐峰是淀粉或蛋白亚甲基的C-H键的不对称伸缩振动吸收峰,图4 e、4f、4g、4h中1 644.1 cm-1处的吸收峰是淀粉中水的H-O-H的弯曲振动吸收峰,1 006.7 cm-1处为淀粉结构C-O-C中C-O的振动吸收峰[26-27]。图4 a、4b中1 651.2 cm-1处为藻蓝蛋白水解物中蛋白质酰胺Ⅰ键C=O的伸缩振动[20]。图4a、4b中1 408.8、1 411.6 cm-1为甲基的C-H剪式弯曲振动,993~1 003 cm-1为C-O-H弯曲振动[28],前者峰强变弱说明藻蓝蛋白水解物中肽链变短,藻蓝蛋白中参与氢键的甲基被解离,后者峰强度减小变化可能与含羟基氨基酸与多糖连接被打断有关。图4 a、4b中1 538~1 550 cm-1处波数代表的酰胺Ⅱ键C-N伸缩振动和N-H变形振动的组合[28],藻蓝蛋白水解后该处峰强度减小,这是蛋白酶水解过程酰胺键断裂所致。图4e、4g中藻蓝蛋白与玉米直支链淀粉混合回生后,玉米回生直链淀粉波数由3 285.3转变为3 268.2 cm-1,支链淀粉由3 315.3转变为3 282.5 cm-1,此处红外波数的减小代表氢键的形成[28],支链淀粉此处波数降低更多可能跟藻蓝蛋白中的巯基、支链淀粉的还原端醛基参与了氢键的形成有关。此两图中可以观察到酰胺Ⅰ、Ⅱ键的吸收峰,说明藻蓝蛋白中羰基和氨基没有参与淀粉回生过程氢键的形成。图4f、4h中藻蓝蛋白水解物与玉米直支链淀粉混合回生后,玉米回生直链淀粉波数由3 285.3转变为3 282.5 cm-1,支链淀粉由3 315.3转变为3 288.5 cm-1。根据表1结果可知,藻蓝蛋白水解物促进玉米直链淀粉回生非常明显,而3 285.0 cm-1附近的红外波数却变化不大,说明促进回生的动力来源于非羟基基团如氨基或巯基。图4f(黑色箭头)中对应于酰胺Ⅰ、Ⅱ键的红外峰的消失正好印证了这种推测,这些羰基和氨基参与了氢键的形成,C=O、C-N伸缩振动消失了。总结红外分析,藻蓝蛋白促进玉米支链淀粉的原因可能是藻蓝蛋白中的巯基与支链淀粉还原端醛基之间形成了氢键;藻蓝蛋白水解物促进玉米直链淀粉回生可能是水解多肽的羰基、氨基与直链淀粉的羟基形成了氢键导致。
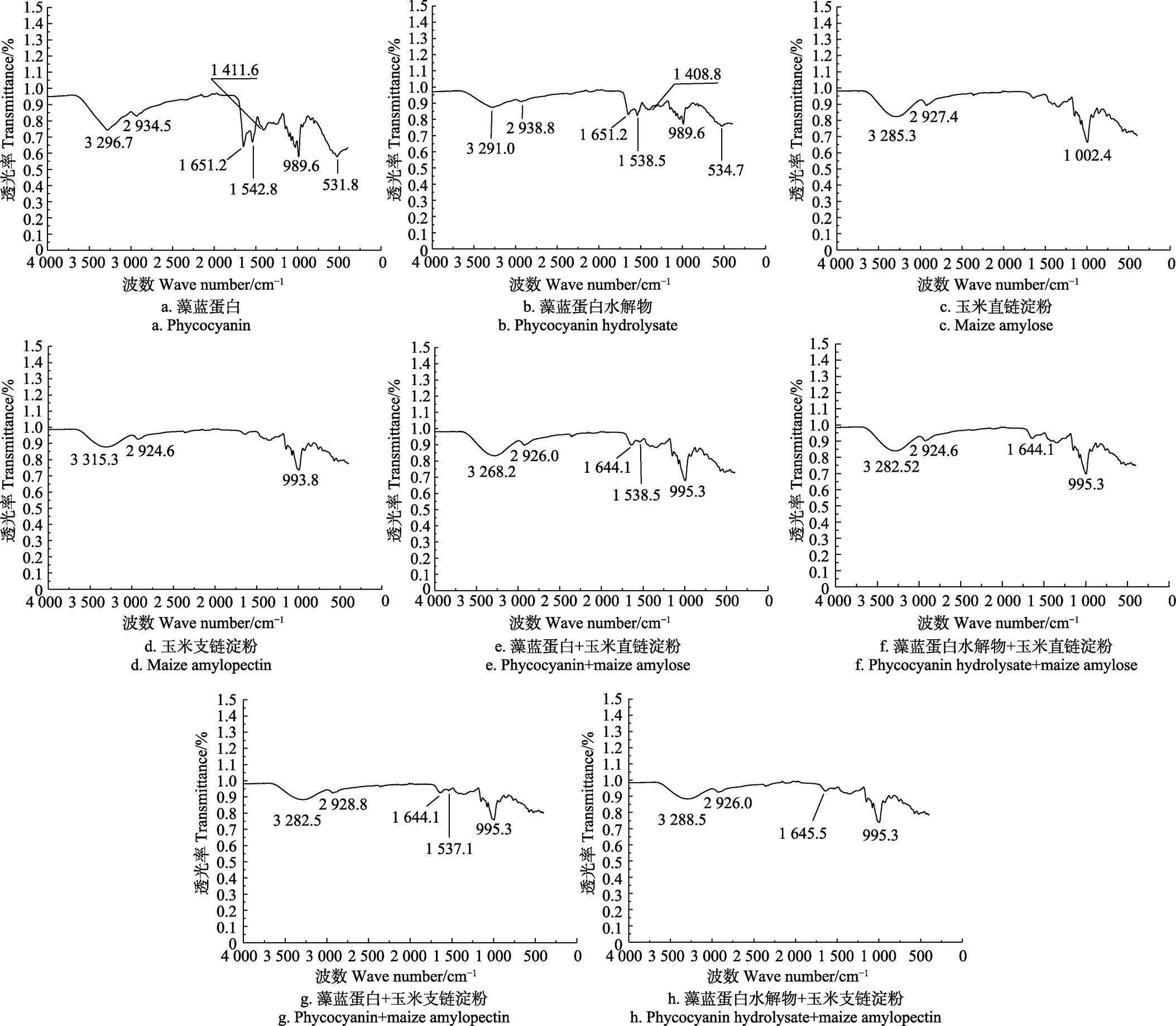
图4 玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉的红外光谱图
2.6 13C固体核磁分析
图5为玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉的13C固体核磁图谱。根据文献[29],藻蓝蛋白中含有的氨基酸主要有Arg、Asp、Ala、Cys、His、Thr、Glu、Leu、Ser、Val、Pro、Ile、Trp、Phe、Lys、Tyr、Met和Gly,图5 a、5 b中化学位移176.7、176.6 ppm代表酰胺键,156.9 ppm代表Arg,129.6、128.5 ppm代表Phe,115.6 ppm可能是Tyr C3或His C4的化学位移[30-33],但Tyr的139 ppm附近的峰强度很弱,说明该氨基酸含量比较少,所以该处化学位移只能由His产生。蛋白酶水解藻蓝蛋白后,此峰裂解为118.1和114.8 ppm,说明水解过程蛋白的酰胺键在His连接位置断开。图5 a、5 b中92.9、93.7 ppm处化学位移为多糖C1原子,73.0、72.7 ppm处化学位移为多糖C2-5原子,60.6、60.8 ppm处化学位移为C6原子[34]。藻蓝蛋白水解后多糖峰强度略有增强(60.8 ppm处C6原子峰的变化最明显),说明藻蓝蛋白可能与藻多糖结合,蛋白酶水解过程使蛋白中氨基酸与多糖的C6连接打断,更多多糖的C6显示出化学位移。图5 a、5 b中未出现代表Glu的折叠结构化学位移53.5、54.0 ppm[35],说明藻蓝蛋白及其水解物主要以-螺旋结构的形式存在。图5 a、5 b中化学位移24.9、25.3 ppm代表Leu的-CH3[35],藻蓝蛋白水解前后此处化学位移变化不大,说明蛋白酶水解过程中与亮氨酸连接的酰胺键可能没有断开。而图5 a、5 b中化学位移16.4、17.1 ppm代表Ala/Val/Thr的-CH3[32],酶解前后该处化学位移发生了明显变化,说明这些氨基酸连接的酰胺键可能被打断,甲基碳的共振发生了变化。含有这些氨基酸的多肽可能跟藻蓝蛋白中多糖连接在一起,使酶解后多糖疏水性增强。由图5 e、5 g可知,藻蓝蛋白与玉米直支链淀粉混合回生后,直链淀粉C1化学位移由100.3 ppm转变为102.4、100.3 ppm,支链淀粉该处化学位移由103.0、100.5 ppm转变为103.2 ppm。根据文献[33-36],回生淀粉此处化学位移出现双峰代表存在淀粉单螺旋晶体或者淀粉处于无定型状态,藻蓝蛋白的添加使玉米直链回生淀粉形成单螺旋晶体或还原端碳原子由结晶态转变为无定型态,使玉米支链淀粉由无定型态转变为结晶态,这与表1中回生率数据结果相符。藻蓝蛋白添加后对玉米直支链淀粉其他碳原子的化学位移影响不大。由图5 f、5 h可知,藻蓝蛋白水解物与玉米直支链淀粉混合回生后,直链淀粉所有碳原子化学位移基本没变,与淀粉无定形区相关的化学位移由82.5减小到81.4 ppm[35],暗示藻蓝蛋白水解物促进玉米直链淀粉回生可能跟无定形区变化相关。支链淀粉该处化学位移变化与添加藻蓝蛋白基本相同,说明从核磁上难以看出藻蓝蛋白和其水解物对支链淀粉回生作用的差异原因。图5 e、5 f、5 g、5 h中的172~174 ppm代表酰胺键,说明这些样品中确实有藻蓝蛋白及其水解物存在,但因为固体核磁衍射灵敏性或蛋白与淀粉在回生过程相互作用导致其他基团信号比较弱。

图5 玉米直链和支链淀粉混合藻蓝蛋白及其水解物前后回生所得淀粉的固体核磁图
2.7 藻蓝蛋白及其水解物促进玉米直、支链淀粉回生机理
根据藻蓝蛋白及其水解物和玉米直支链淀粉混合前后所得回生淀粉的红外和核磁分析,推测了其促进回生机理可能途径(图6)。在图6a中,藻蓝蛋白在碱性蛋白酶作用下分解成不同肽段的多肽和多糖,其中多糖C6分子上还结合有亲水性氨基酸Thr、Cys和Arg等,疏水性氨基酸肽Val 和Leu等。对于玉米支链淀粉来说,藻蓝蛋白与其混合后(如图6c),藻蓝蛋白中Arg的氨基与玉米支链淀粉的还原端醛基间形成氢键,减弱支链淀粉运动速度,缓慢甩动过程中使支链淀粉末端双螺旋解旋,不同分子间羟基形成氢键,生成回生淀粉;由于藻蓝蛋白中的糖蛋白连接在蛋白上,没有溶解到溶液中增加溶液粘度,不影响支链淀粉解旋。但当藻蓝蛋白水解物与玉米支链淀粉混合时(如图6e),水解物中含有Arg的多肽分子量小、链长短,精氨酸与支链淀粉形成氢键后,分子量大得多的支链淀粉在运动过程可以牵引多肽左右摇摆,加之水解物中多糖溶解使溶液黏度增加,玉米支链淀粉末端双螺旋不能解旋,无法为回生提供更好的条件,所以不促进支链淀粉的回生。对于玉米直链淀粉来说,其分子量小、还原端多、移动速度快的特点促使其还原端可以与藻蓝蛋白中半胱氨酸的巯基间形成微弱的氢键(图6b),直链淀粉过快的移动速度阻碍了其与藻蓝蛋白结合后双螺旋的解旋,不能促进其回生。而藻蓝蛋白水解物分子量小,其与直链淀粉双螺旋中一条链形成氢键后(如图6d所示,直链淀粉还原端与藻蓝蛋白水解物中精氨酸之间形成氢键),当直链淀粉运动时,2条双螺旋就容易发生解旋,使淀粉双螺旋上羟基暴露出来,不同链之间更容易形成氢键,大大促进了直链淀粉的回生。因此,淀粉还原端形成氢键可明显促进其回生。

注:Thr,Cys,Arg,His,Val,Leu分别为苏氨酸、半胱氨酸、精氨酸、组氨酸、缬氨酸、亮氨酸。
3 结 论
藻蓝蛋白可以促进玉米支链淀粉回生,藻蓝蛋白水解物可以促进玉米直链淀粉的回生。藻蓝蛋白水解物中半胱氨酸巯基可能和玉米直链淀粉还原端醛基在与直链淀粉混合回生过程形成氢键,通过分子甩动使直链淀粉双螺旋解开,大大促进了玉米直链淀粉间形成氢键,提高了其回生率;而藻蓝蛋白通过精氨酸氨基可能与玉米支链淀粉还原端醛基形成氢键,利用藻蓝蛋白中疏水性氨基酸驱离玉米支链淀粉侧链末端水分子,促使支链淀粉末端双螺旋解旋,加快了支链淀粉末端链间氢键形成,提高了其回生率。淀粉还原端形成氢键可明显促进其回生。
研究结果表明,添加1.0%藻蓝蛋白对直链淀粉回生率没有影响,使支链淀粉回生率提高了61.4%;而添加量为10%的藻蓝蛋白使直链淀粉回生率提高了60.4%,使支链淀粉回生率提高了69.6%。藻蓝蛋白水解肽低的添加量(1.0%)对玉米直链的回生率影响不显著,但使支链淀粉的回生提高了28.1%;水解肽高添加量(10.0%)使玉米直链淀粉的回生率提高了184.7%,使玉米支链淀粉的回生率提高了47.0%。
藻蓝蛋白及其水解物促进玉米直支链淀粉回生的发现开辟了功能蛋白干预淀粉回生的新领域,为开发多功能保健食品、拓宽藻蓝蛋白和玉米淀粉应用领域找到一条新途径。
[1] Fuentes-Zaragoza E, Riquelme-Navarrete M J, Sánchez- Zapata E, et al. Resistant starch as functional ingredient: A review[J]. Food Research International, 2010, 43(4): 931-942.
[2] 张坤生,周雪,连喜军,等. 冷藏条件下荞麦淀粉回生规律的研究[J]. 食品工业科技,2013,34(16):157-158,177. Zhang Kunsheng, Zhou Xue, Lian Xijun, et al. The study on the retrogadation regular of buckwheat starch under cold storage condition[J]. Science and Technology of Food Industry (STFI), 2013, 34(16): 157-158,177. (in Chinese with English abstract)
[3] 张坤生,宁仲娟,连喜军,等. 冷冻对糯米淀粉回生的影响[J]. 食品工业科技,2013,34(21):49-51. Zhang Kunsheng, Ning Zhongjuan, Lian Xijun, et al. Effect of freezing on starch retrogradation of glutinous rice starch[J]. Science and Technology of Food Industry (STFI), 2013, 34(21): 49-51. (in Chinese with English abstract)
[4] 连喜军,张燕. 不同老化工艺对甘薯回生抗性淀粉制备率的影响[J]. 粮食加工,2012,37(3):46-48. Lian Xijun, Zhang Yan. Effects of different aging processes on the preparation rate of resistant starch of sweet potato[J]. Grain Processing, 2012, 37(3): 46-48. (in Chinese with English abstract)
[5] Masatcioglu T M, Sumer Z, Koksel H. An innovative approach for significantly increasing enzyme resistant starch type 3 content in high amylose starches by using extrusion cooking[J]. Journal of Cereal Science, 2017, 74: 95-102.
[6] Jagannadham K, Parimalavalli R, Babu A S. Effect of triple retrogradation treatment on chickpea resistant starch formation and its characterization[J]. Journal of Food Science and Technology, 2017, 54(4): 901-908.
[7] Silverio J, Fredriksson H, Andersson R, et al. The effect of temperature cycling on the amylopectin retrogradation of starches with different amylopectin unit-chain length distribution[J]. Carbohydrate Polymers, 2000, 42(2): 175-184.
[8] 连喜军,罗庆丰,刘学燕,等. 超声波对甘薯回生抗性淀粉生成的作用[J]. 食品研究与开发,2011,32(1):61-64. Lian Xijun, Luo Qingfeng, Liu Xueyan, et al. Effects of ultrasonic wave on the formation of resistant starch of sweet potato[J]. Food Research and Development, 2011, 32(1): 61-64. (in Chinese with English abstract)
[9] 连喜军,钱瑞,刘敬,等. 电解法和微波法联合处理提高甘薯淀粉回生率[J]. 粮食加工,2011,36(5):51-54. Lian Xijun, Qian Rui, Liu Jing, et al. The retrogradation rate of sweet potato starch was improved by electrolysis and microwave[J]. Food Research and Development, 2011, 36(5): 51-54. (in Chinese with English abstract)
[10] Demirkesen-Bicak H, Tacer-Caba Z, Nilufer-Erdil D. Pullulanase treatments to increase resistant starch content of black chickpea () starch and the effects on starch properties[J]. International journal of Biological Macromolecules, 2018, 111: 505-513.
[11] 连喜军,赵璐,牛瑞华,等. 中温-淀粉酶处理提高甘薯回生抗性淀粉制备率[J]. 粮食与油脂,2010(8):21-23. Lian Xijun, Zhao Lu, Niu Ruihua, et al. The preparation rate of retrograde resistant starch of sweet potato was improved by medium temperature and-amylase treatment [J]. Cereals & Oils, 2010(8): 21-23. (in Chinese with English abstract)
[12] 丁文平,李清,夏文水. 淀粉酶对大米淀粉回生影响机理的研究[J]. 粮食与饲料工业,2005 (10):16-17. Ding Wenping, Li Qing, Xia Wenshui. Study on the mechanism of amylase on the retrogradation of rice starch[J]. Cereal & Feed Industry, 2005(10): 16-17. (in Chinese with English abstract)
[13] 孟宪昉,刘立增,郭俊杰,等. 草酸侵蚀马铃薯回生淀粉制备晶种促进玉米淀粉回生的研究[J]. 食品工业科技,2016,37(3):131-134,148. Meng Xianfang, Liu Lizeng, Guo Junjie, et al. Study on the effect of oxalic acid on the retrogradation of corn starch by seed preparation of potato starch[J]. Science and Technology of Food Industry (STFI), 2016, 37(3): 131-134,148. (in Chinese with English abstract)
[14] Luo D, Li Y, Xu B, et al. Effects of inulin with different degree of polymerization on gelatinization and retrogradation of wheat starch[J]. Food chemistry, 2017, 229: 35-43.
[15] Lian X J, Guo J J, Wang D L, et al. Effects of protein in wheat flour on retrogradation of wheat starch[J]. Journal of Food Science, 2014, 79(8): 1505-1511.
[16] 郭俊杰,马乔治,康海岐,等. 含醇溶蛋白小麦回生抗性直支链淀粉性质分析[J]. 农业工程学报,2018,34(4): 293-298. Guo Junjie, Ma Qiaozhi, Kang Haiqi, et al. Analysis on properties of starch with alcohol - soluble protein in wheat resistant to direct - branched chain[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(4): 293-298. (in Chinese with English abstract)
[17] 刘杨,王雪青,赵培,等. 水提分离钝顶螺旋藻藻蓝蛋白及其稳定性研究[J]. 天津师范大学学报(自然科学版),2008(3):11-14. Liu Yang, Wang Xueqing, Zhao Pei, et al. Study on the separation of phycocyanin from spirulina platensis by water extraction and its stability[J]. Journal of Tianjin Normal University(Natural Science Edition), 2008(3): 11-14. (in Chinese with English abstract)
[18] Lian X, Dong S, Gao K, et al. Sweet potato amylose and amylopectin with narrower distribution of molar mass and chain length obtained by a repeated retrogradation–hydrolysis procedure[J]. Journal of Applied Polymer Science, 2016, 133(34): 8311-8319.
[19] Lian X, Sun H, Li L, et al. Characterizing the chemical features of lipid and protein in sweet potato and maize starches[J]. Starch‐Stärke, 2014, 66(3/4): 361-368.
[20] 殷钢,刘铮,刘飞,等. 钝顶螺旋藻中藻蓝蛋白的分离纯化及特性研究[J]. 清华大学学报(自然科学版),1999(6):21-23. Yin Gang, Liu Zheng, Liu Fei, et al. Isolation, purification and characterization of phycocyanin from spirulina platensis [J]. Journal of Tsinghua University(Science and Technology), 1999(6): 21-23. (in Chinese with English abstract)
[21] 李文军,陈敏. 蓝隐藻藻蓝蛋白结构与功能稳定性研究[J]. 海洋科学,2013,37(7):33-40. Li Wenjun, Chen Min. Study on the structure and functional stability of cyanobacteria[J]. Marine Sciences, 2013, 37(7): 33-40. (in Chinese with English abstract)
[22] 汪兴平. 葛仙米藻蓝蛋白的一级结构、构象及抗氧化活性研究[D]. 武汉:华中农业大学,2006.Wang Xingping. Studies on Primary Structure and Comformation as well as Antioxidation Activities of Phycocyanin from[D]. Wuhan: Huazhong Agricultural University. 2006. (in Chinese with English abstract)
[23] 郭俊杰,孙海波,李琳,等. 参与回生玉米直链和支链淀粉理化特性[J]. 食品工业科技,2014,35(14):91-94 Guo Junjie, Sun Haibo, Li Lin, et al. Physicochemical characteristics of amylose and amylopectin fractions from retrograded maize starch[J]. Science and Technology of Food Industry (STFI), 2014, 35(14): 91-94. (in Chinese with English abstract)
[24] 冯霞,杜晓冉,周润生,等. 用差热法研究甘薯直、支链淀粉回生动力学[J]. 河南工业大学学报(自然科学版),2016,37(5):26-33. Feng Xia, Du Xiaoran, Zhou Runsheng, et al. The study of kinetics of sweet potato amylose and amylopectin during retrogradation by DSC method[J]. Journal of Henan University of Technology (Natural Science Edition) (JHUT), 2016, 37(5): 26-33. (in Chinese with English abstract)
[25] 谢新华,贺平,宋一诺,等. 月桂酸对小麦淀粉凝胶回生特性的影响[J]. 麦类作物学报,2016,36(10):1350-1354. Xie Xinhua, He Ping, Song Yinuo, et al. Effect of luaric acid on the retrogradation properties of wheat starch gel[J]. Journal of Triticeae Crop (JTC). 2016, 36(10): 1350-1354. (in Chinese with English abstract)
[26] 牛凯,李贵萧,代养勇,等. 碾轧时间和频率对玉米淀粉机械力化学效应的影响[J]. 农业工程学报,2017,33(4):293-301. Niu Kai, Li Guixiao, Dai Yangyong, et al. Effect of milling time and frequency on mechanical and chemical effects of corn starch[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(4): 293-301. (in Chinese with English abstract)
[27] 吴跃. 抗高直链大米淀粉回生的物理修饰及其回生的检测和表征[D]. 无锡:江南大学,2010. Wu Yue. Physical Modification of Anti-high Linear Rice Starch Retrogradation and Detection and Characterization of its Retrogradation[D]. Wuxi: Jiangnan University, 2010. (in Chinese with English abstract)
[28] Doyle B B, Bendit E G, Blout E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers: Original Research on Biomolecules, 1975, 14(5): 937-957.
[29] 林启山,张建平,曾繁杰,等. 海洋红藻和蓝藻中的别藻蓝蛋白结构特征的比较[J]. 植物生理学报,1992(3): 253-259. Lin Qishan, Zhang Jianping, Zeng Fanjie, et al. Comparison of structural characteristics of allophycocyanin in marine red algae and cyanobacteria[J]. Plant Physiology Journal, 1992(3): 253-259. (in Chinese with English abstract)
[30] Alberti E, Gilbert S M, Tatham A S, et al. Study of high molecular weight wheat glutenin subunit 1Dx5 by 13C and 1H solid-state NMR spectroscopy. I. Role of covalent crosslinking[J]. Biopolymers, 2002, 67(6): 487-498.
[31] Calucci L, Forte C, Galleschi L, et al.13C and1H solid state NMR investigation of hydration effects on gluten dynamics[J]. Int. J. Biol. Macromol. 2003, 32(3): 179-189.
[32] Jiang W, Zhou Z, Wang D, et al. Transglutaminase catalyzed hydrolyzed wheat gliadin grafted with chitosan oligosaccharide and its characterization[J]. Carbohyd. Polym. 2016, 153: 105-114.
[33] Flores-Morales A, Jiménez-Estrada M, Mora-Escobedo R. Determination of the structural changes by FT-IR, Raman, and CP/MAS 13C NMR spectroscopy on retrograded starch of maize tortillas[J]. Carbohydrate Polymers, 2012, 87(1): 61-68.
[34] McIntyre D D, Ho C, Vogel H J. One‐dimensional nuclear magnetic resonance studies of starch and starch products[J]. Starch‐Stärke, 1990, 42(7): 260-267.
[35] Zhang X, Burgar I, Lourbakos E, et al. The mechanical property and phase structures of wheat proteins/polyvinyl alcohol blends studied by high-resolution solid-state NMR[J]. Polymer, 2004, 45(10): 3305-3312.
[36] Flores-Morales A, Jiménez-Estrada M, Mora-Escobedo R. Determination of the structural changes by FT-IR, Raman, and CP/MAS 13C NMR spectroscopy on retrograded starch of maize tortillas[J]. Carbohydrate Polymers, 2012, 87(1): 61-68.
Mechanism of retrogradation enhancement of maize amylose and amylopectin by phycocyanin and its hydrolysate
Wang Xueqing, Jiang Rongxia, Guo Zhipeng, Lian Xijun※, Guo Junjie
(300134,)
Phycocyanin is a kind of dark blue powder isolated from spirulina and has a variety of health functions of anti-cancer, blood cell regeneration, etc. In order to widen its application in food, phycocyanin and its hydrolysis are added into maize amylose/amylopectin paste during retrogradation, it has been found that they can promote the retrogradation of amylose/amylopectin. In order to further explore its mechanism of promoting the retrogradation of maize starch, the effects of contents of phycocyanin or its hydrolysate in maize amylose/amylopectin on retrogradation rate were determined, and the method of X-ray diffraction, differential scanning calorimetry, infrared and solid nuclear magnetic analysis were used. The results showed that phycocyanin hydrolyzate promoted maize amylose retrogradation more obviously than that of phycocyanin. 10% addition of phycocyanin hydrolyzate could make maize amylose retrogradation rate increase from 27% to 76.9%, 184.8% higher. Phycocyanin promoted the retrogradation of maize amylopectin more pronouned than its hydrolysate, 10% addition of phycocyanin let maize amylopectin retrogradation rate increase from 26.7% to 45.3%, which increased by 69.6%. According to the UV-visible scanning, phycocyanin hydrolysis co cause the phycocyanin pigment in the center of phycocyanin to be exposed. X-ray results indicated that addition of phycocyanin to maize amylopectin induced a sharper peak at 2is 16.60º, as well as that mixture of phycocyanin hydrolysate and maize amylose caused a same sharper one at 2is 16.44º. Compared to diffraction angles of retrograded maize amylose/amylopectin, the decrease of sharp diffraction angle in those mixtures supported that interplanar distance at this angle became larger. DSC results demonstrated that mixture of phycocyanin and maize amylopectin, or mixture of phycocyanin hydrolysate and maize amylose, which both promoted retrogradation greatly, both caused the presence of re-crystallization peaks and loss of crystallization peaks. In other words, more phycocyanin/hydrolysate chains and maize amylose/amylopectin with similar length involved in retrogradation. Such process should deal with unwinding of maize amylose/amylopectin. The results of infrared and13C solid NMR showed that phycocyanin might be hydrolyzed into arginine-rich polypeptide with hydrophilic, polysaccharides and polypeptide with hydrophobic. The mechanism for phycocyanin to promote retrogradation of maize amylopectin was that the formation of hydrogen bond between the arginine amino acid of phycocyanin and aldehyde of reduction end in maize amylopectin, and water molecule of maize amylopectin being driving away from the side chain end by phycocyanin hydrophobic amino acid, promoted the end of the chain-branched starch double helix spin, accelerate the formation of hydrogen bond between the end chains of amylopectin, which lead to improve retrogradation rate of maize amylopectin. The mechanism for phycocyanin hydrolysate to increase retrogradation rate of maize amylose was that the hydrogen bond formed between the sulfydryl of cysteine in phycocyanin hydrolyzate and aldehyde of reduction end in maize amylose during retrogradation of mixture, then the double helix of amylose was unlocked by molecular swinging, which greatly promoted the formation of hydrogen bond between amylose and improved the retrogradation rate of amylose. This study provides a new technique to improve the retrogradation rate of maize starch.
agricultural products; starch; hydrolysis; retrograded starch; phycocyanin; retrogradation mechanism
2018-10-25
2019-03-01
国家自然科学基金项目(31571834;31871811);天津市科技重大专项与工程(一二三产业融合发展科技示范工程)(项目编号18ZXYENC00080);天津市高等学校大学生创新训练计划项目(201810069067);天津市高等学校创新团队“农产品加工贮藏新新技术及相关机理研究”(编号TD13-5087);天津市自然科学基金(18JCZDJC98200)资助
王雪青,博士,教授,主要从事天然产物的研究开发及应用。Email:wxqing@tjcu.edu.cn
连喜军,博士,副教授,主要从事回生淀粉研究。 Email:lianliu2002@163.com
10.11975/j.issn.1002-6819.2019.08.038
TS231
A
1002-6819(2019)-08-0324-11
王雪青,蒋荣霞,郭志鹏,连喜军,郭俊杰. 藻蓝蛋白及其水解物促进玉米直支链淀粉回生机理研究[J]. 农业工程学报,2019,35(8):324-334. doi:10.11975/j.issn.1002-6819.2019.08.038 http://www.tcsae.org
Wang Xueqing, Jiang Rongxia, Guo Zhipeng, Lian Xijun, Guo Junjie. Mechanism of retrogradation enhancement of maize amylose and amylopectin by phycocyanin and its hydrolysate[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(8): 324-334. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.08.038 http://www.tcsae.org
