AlCl3·6H2O 在 FeCl3-CaCl2-HCl-H2O体系中溶解度的模拟和测定
2019-05-24程文婷成怀刚郭彦霞程芳琴
张 婵,程文婷,成怀刚,郭彦霞,程芳琴
(山西大学资源与环境工程研究所,山西低附加值煤基资源高值利用协同创新中心,山西太原030006)
AlCl3·6H2O是一种具有广泛用途的传统的无机化合物,是制备氧化铝、聚合氯化铝絮凝剂等诸多铝化工产品的原料[1-3],同时在陶瓷、高性能催化剂等新材料领域显示出广泛的应用前景[4]。近年来,诸多学者对于从粉煤灰、煤矸石和铝土矿中提铝的研究较多[5-7]。针对浸取液中铝盐的分离提纯,结晶是AlCl3·6H2O产品制备过程中的重要工序,而在结晶过程中,由于滤液成分复杂,导致滤液中的部分杂质也会同时结晶,严重影响产品质量。而溶解度和相平衡数据对结晶分离过程的开发、设计、优化和运行有重要的指导意义,因此研究AlCl3·6H2O在粉煤灰酸浸液体系中的溶解度数据尤为重要。
文献中已有诸多关于AlCl3·6H2O溶解度的研究[8-13]。 W.C.Gao 等[8]采用沉淀结晶法测定了温度为10~90℃、氯化镁的浓度为0~5 mol/kg的条件下,AlCl3-MgCl2-H2O三元系统中AlCl3·6H2O的溶解度数据[8]。 M.X.Yuan 等[9]研究了 25 ℃下 AlCl3-CaCl2-H2O和AlCl3-FeCl-H2O三元系统中的相平衡数据,并绘制了相图。Wang Junfeng等[10]使用嵌入Pitzer离子活度模型的Aspen plus软件模拟计算了5~90℃条件下,AlCl3-H2O二元系统和AlCl3-CaCl2-H2O三元系统的相平衡数据[10]。 F.Farelo 等[11]测定了不同温度下AlCl3·6H2O分别在H2O、KCl和NaCl溶液中的溶解度数据。此外还有诸多学者研究了酸性水盐体系下 AlCl3·6H2O 的溶解度。 R.R.Brown 等[12]模拟计算了 AlCl3·6H2O 在复杂多元酸性(Al、Fe、K、Na)溶液中的溶解度以及杂质离子对AlCl3·6H2O晶体纯度的影响。 L.André等[13]使用 Pitzer模拟计算了25℃下 AlCl3·6H2O 在 AlCl3-MgCl2-H2O、AlCl3-KCl-H2O系统中的溶解度。但是粉煤灰酸浸液成分复杂,AlCl3·6H2O在此体系中的溶解度数据仍有待补充。
笔者采用实验和模拟相结合的方法来研究25~60℃时 AlCl3·6H2O 在 FeCl3-HCl-H2O 和 CaCl2-HCl-H2O体系内的溶解度。首先采用静态法系统地测定了AlCl3·6H2O在2个体系中的溶解度,再以OLI软件为平台,使用嵌入的Bromley-Zemaitis活度系数模型对其溶解度做了模拟计算,并与实验数据做了对比。研究结果可为粉煤灰酸浸液提铝工艺中AlCl3·6H2O的分离提纯提供基础数据和理论指导。
1 实验部分
1.1 试剂和仪器
试剂:无水氯化钙(分析纯,质量分数≥96.0%,国药集团化学试剂有限公司);无水三氯化铁(分析纯,质量分数≥97.0%,国药集团化学试剂有限公司);氯化铝、六水氯化铝(分析纯,质量分数≥97%,国药集团化学试剂有限公司);盐酸(分析纯,质量分数为36%~38%,国药集团化学试剂有限公司),实验用水为超纯水(电导率≤0.055×10-4S/m)。
仪器:CP241型电子分析天平、A3型投入式恒温器、84-1A型磁力搅拌器、CS101-2EB型电热鼓风干燥箱、D8 Advance型 X射线粉末衍射仪、ICAP6000系列等离子发射光谱仪(ICP-OES)。
1.2 实验装置和方法
常用的测量固体溶解度的方法有静态法和动态法[14]。静态法对溶解达到平衡的速率没有限制,在实验室中应用广泛,同时由于氯化铝颗粒较大且溶解缓慢,故静态法更适合测定AlCl3·6H2O的溶解度。
本实验采用静态法测定AlCl3·6H2O的溶解度,装置如图1所示。取50 mL配置好的一定浓度的盐酸溶液移入250 mL磨口三角锥形瓶中,加入一定量的无水氯化铁或者无水氯化钙,将锥形瓶置于水浴中,打开投入式恒温器,使其溶解并恒温;加入过量的AlCl3·6H2O固体于混合溶液中,连续搅拌6 h使其达到固液平衡后静置,用预先加热好的注射器吸取上层清液,立即移入已知质量的预热等温的容量瓶中,定容后称取容量瓶和液体的总质量,以计算液体的密度;同时,移取上清液稀释制样,检测样品中各离子浓度,计算得到AlCl3·6H2O的溶解度,即每1 kg水中溶解的AlCl3·6H2O的物质的量;最后,抽滤混合溶液中的固相,用乙醇洗涤滤饼3次,在60℃下低温干燥10 h后,对固相做XRD分析。
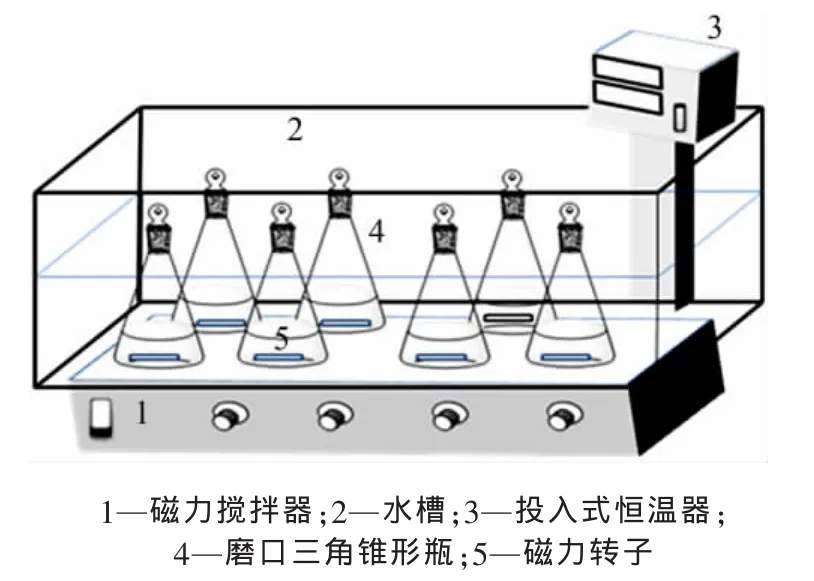
图1 溶解度实验装置
1.3 测试与表征
采用等离子发射光谱仪来测定液体样品中各离子的浓度;采用X射线粉末衍射仪(XRD)对样品做固相分析。
2 AlCl3·6H2O在 FeCl3-CaCl2-HCl-H2O 体系中溶解度的模拟
2.1 AlCl3·6H2O在 FeCl3-CaCl2-HCl-H2O 体系中的热力学平衡关系
在 FeCl3-CaCl2-HCl-H2O 体系中,AlCl3·6H2O溶解时存在如下的化学平衡:

AlCl·6H2O 的热力学平衡常数(Ksp):

式中,Ksp为热力学平衡常数分别为 Al3+、Cl-、H2O 的 活度分别为Al3+、Cl-的浓度,mol/kg;分别为 Al3+、Cl-的活度系数。
2.2 活度系数模型的选择
从式(2)可以看出,AlCl3·6H2O 溶解度的计算需要确定相关的离子活度及离子活度系数,Bromley-Zemaitis活度系数模型已成功地应用于0~200℃范围内、0~300 mol/L的电解质溶液中,来预测化学物质的活度。考虑到粉煤灰酸浸液中AlCl3·6H2O结晶的温度区间、电解质溶液的浓度范围,本实验以OLI软件为平台,选用Bromley-Zemaitis活度系数模型来计算活度系数,Bromley-Zemaitis活度系数的计算方程式:

式中,A是Debye-Huckel参数;I是溶液中的离子强度;B、C和D与温度有关的经验系数;Zi和Zj分别是阳离子和阴离子的电荷数;针对离子的活度系数,下标i代表溶液中的阳离子,j代表溶液中的阴离子,每一个离子对都可以用式(3)来表示。
3 AlCl3·6H2O在 FeCl3-CaCl2-HCl-H2O 体系中的溶解度的测定
3.1 实验材料与方法的可靠性验证
在实验中为确保固液相达到平衡,设定平衡时间为6 h[15]。为了验证实验方法和反应装置的可靠性,将实验测量值和文献值做对比,结果见图2。由图2可见,在25℃和60℃条件下,实验测量值与文献值吻合较好,平均相对误差小于5%,表明本文的实验方法可靠。

图2 不同温度下AlCl3·6H2O在盐酸溶液中的溶解度
3.2 AlCl3·6H2O在FeCl3-HCl-H2O体系中的溶解度
在温度为 25~60℃、FeCl3浓度为 0~2.5 mol/kg、盐酸浓度分别为1 mol/kg和9.9 mol/kg的条件下,通过静态法测定了AlCl3·6H2O在FeCl3-HCl-H2O体系中的溶解度,结果见图3。由图3可见,在同一盐酸浓度和同一氯化铁浓度下,AlCl3·6H2O在FeCl3-HCl-H2O体系中的溶解度随温度的升高略有增加,如在盐酸浓度为1 mol/kg、氯化铁浓度为2.0 mol/kg的溶液中,在25℃和45℃时,AlCl3·6H2O的溶解度分别为2.034 6 mol/kg和 2.164 2 mol/kg,溶解度增幅为6%;而在同一温度和同一盐酸浓度下,随着氯化铁浓度的增大,AlCl3·6H2O在体系中的溶解度逐渐减小,变化显著;如在25℃、盐酸浓度为1 mol/kg时,浓度为0.2mol/kg和2.0mol/kg的氯化铁溶液中AlCl3·6H2O的溶解度分别为3.1298mol/kg和2.0346mol/kg,溶解度减少35%,说明氯化铁对于AlCl3·6H2O在盐酸溶液中的溶解有显著的抑制作用,原因是溶液中氯离子的同离子效应。此外,在同一温度、同一氯化铁浓度下,盐酸的浓度对AlCl3·6H2O的溶解度有显著影响,随着盐酸浓度的增大,AlCl3·6H2O的溶解度显著减小。如在45℃、氯化铁浓度为0.2mol/kg条件下,盐酸浓度为1 mol/kg和 9.9 mol/kg时,AlCl3·6H2O的溶解度分别为3.065 8 mol/kg和0.633 6 mol/kg,AlCl3·6H2O的溶解度减少了 79.3%,该结果与文献[16]报道的结果一致。以上结果表明,温度对于AlCl3·6H2O在FeCl3-HCl-H2O体系中的溶解度的影响可以忽略,氯化铁和盐酸浓度对AlCl3·6H2O的溶解度均有显著的影响。
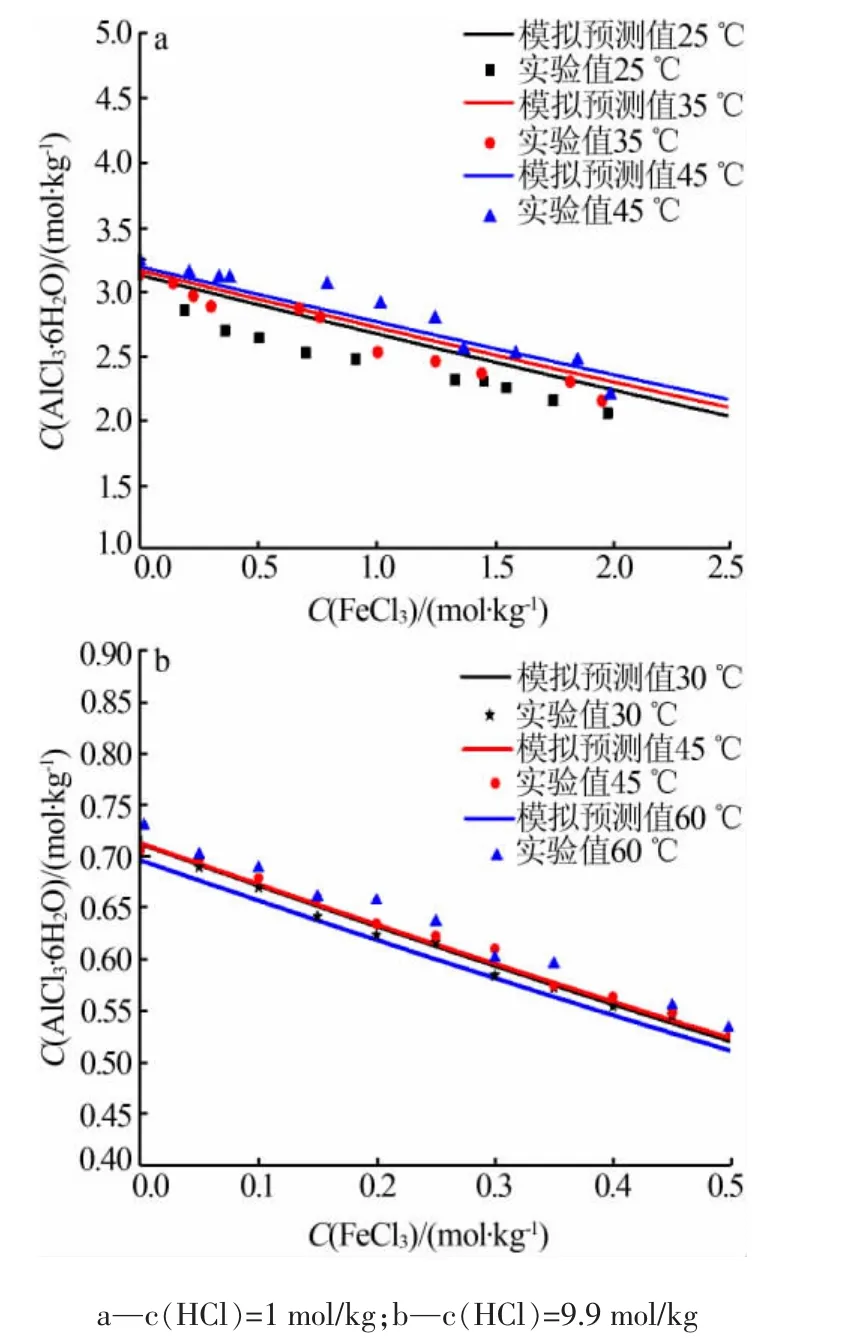
图3 不同温度下AlCl3·6H2O在FeCl3-HCl-H2O体系中的溶解度
图3中利用活度系数模型计算的AlCl3·6H2O在 FeCl3-HCl-H2O体系中随温度(25~60℃)、氯化铁浓度及盐酸浓度的变化关系与实验测定的溶解度数据有较好的一致性,温度对于AlCl3·6H2O的溶解度无显著影响,可以忽略;AlCl3·6H2O的溶解度随氯化铁的浓度的增大线性减小;不同浓度盐酸条件下AlCl3·6H2O的溶解度有显著差异;随着盐酸浓度的增大,AlCl3·6H2O的溶解度显著减小。通过比较,所得到的模拟预测值和实验值的平均相对误差均小于5%。
在测定AlCl3·6H2O溶解度的过程中,由于体系中铁离子的存在以及溶解反应,会给AlCl3·6H2O固体的晶相以及稳定性带来一定影响。对不同条件下AlCl3·6H2O在FeCl3-HCl-H2O体系中达到溶解平衡后的固相做XRD分析,结果见图4。由图4可见,XRD谱图衍射峰与标准卡片(44-1473)上的AlCl3·6H2O的谱图相吻合,说明所有实验条件下混合溶液平衡 6 h 后,固相中都只有 AlCl3·6H2O,且 AlCl3·6H2O在混合溶液中是稳定的,并未发生相变。
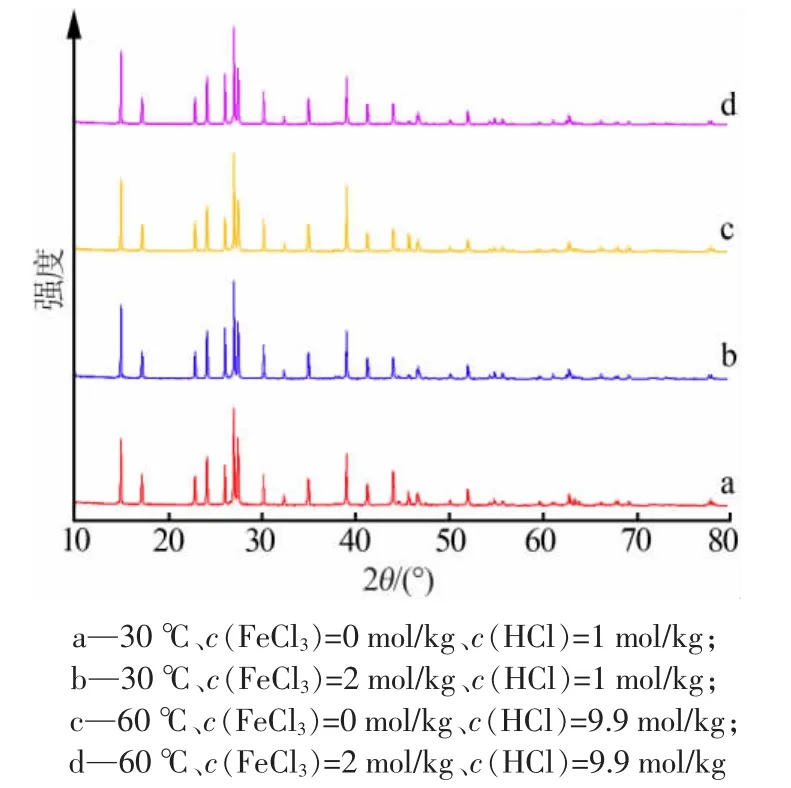
图4 AlCl3·6H2O在FeCl3-HCl-H2O体系中溶解平衡后固相的XRD谱图
3.3 AlCl3·6H2O在CaCl2-HCl-H2O体系中的溶解度
在温度为25~60℃、氯化钙浓度为0~2.5 mol/kg、盐酸浓度分别为1 mol/kg和9.9 mol/kg的条件下,通过静态法测定了AlCl3·6H2O在CaCl2-HCl-H2O体系中的溶解度,结果见图5。由图5可以看出,在同一盐酸浓度和同一氯化铁浓度下,AlCl3·6H2O在CaCl2-HCl-H2O体系中的溶解度随温度的升高略有增加。如在盐酸浓度为1 mol/kg、氯化钙浓度为1.0 mol/kg的溶液中,在 25℃和 45℃时,AlCl3·6H2O的溶解度分别为2.701 8 mol/kg和2.715 8 mol/kg,溶解度增幅为0.52%;而在同一温度和同一盐酸浓度下,随着氯化钙浓度的增大,AlCl3·6H2O在体系中的溶解度逐渐减小,变化显著。如在35℃、盐酸浓度为1 mol/kg、氯化钙浓度为0.15 mol/kg和2.0 mol/kg的溶液中,AlCl3·6H2O的溶解度分别为3.0782 mol/kg和2.017 3 mol/kg,溶解度减少34.5%,说明氯化钙对于AlCl3·6H2O在盐酸溶液中的溶解也有显著的抑制作用,原因是溶液中氯离子的同离子效应。此外,在同一温度、同一氯化钙浓度下,盐酸的浓度对AlCl3·6H2O的溶解度有显著影响,随着盐酸浓度的增大,AlCl3·6H2O的溶解度显著减小。如在45℃、氯化钙浓度为0.2mol/kg的条件下,盐酸浓度为1mol/kg和 9.9 mol/kg时,溶解度分别为 3.119 8 mol/kg和0.6329mol/kg,AlCl3·6H2O的溶解度减少了79.7%。以上结果表明,温度对于AlCl3·6H2O在CaCl2-HCl-H2O体系中的溶解度的影响可以忽略,氯化钙浓度和盐酸浓度对其溶解度均有显著的影响。
图5中利用活度系数模型计算的在CaCl2-HCl-H2O体系中的AlCl3·6H2O的溶解度随温度(25~60℃)、CaCl2浓度和盐酸浓度的变化关系与实验所得数据和规律吻合良好,其模拟预测值与实验数据的平均相对误差均小于5%。

图5 不同温度下AlCl3·6H2O在CaCl2-HCl-H2O体系中的溶解度
为了确定AlCl3·6H2O在溶解反应过程中晶体结构的稳定性,对实验所得固相做XRD分析,结果见图6。由图6可知,不同条件下AlCl3·6H2O在CaCl2-HCl-H2O体系中溶解平衡6 h后,固相的衍射峰与标准卡片(44-1473)上的AlCl3·6H2O的谱图相吻合,说明所有实验条件下混合溶液平衡6 h后,AlCl3·6H2O在CaCl2-HCl-H2O体系中是稳定的,并未发生相变。
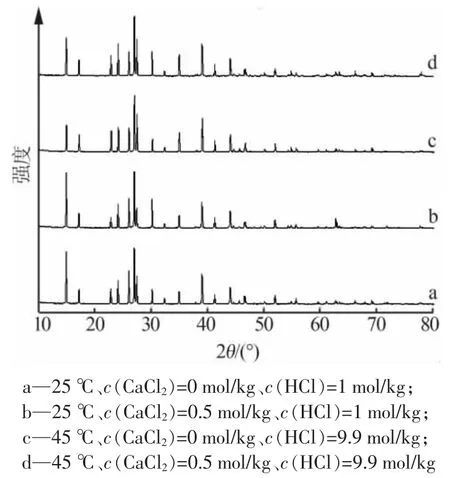
图6 AlCl3·6H2O 在 CaCl2-HCl-H2O体系中平衡后固相的XRD谱图
3 结论
采用静态法分别测定了25~60℃、盐酸浓度为1 mol/kg和9.9 mol/kg、氯化铁或氯化钙的浓度为0~2.5 mol/kg 条件下,AlCl3·6H2O 在 FeCl3-CaCl2-HCl-H2O体系中的溶解度。同时以OLI软件为平台,采用Bromley-Zemaitis活度系数模型预测了相同条件下AlCl3·6H2O在该体系中的溶解度。实验结果表明,在FeCl3-HCl-H2O和CaCl2-HCl-H2O两个体系中,随着温度的升高,AlCl3·6H2O的溶解度增势较小,可以忽略温度对它的影响;由于同离子效应和盐析作用,氯化铁和氯化钙的浓度对AlCl3·6H2O在体系中的溶解度也有不同程度的影响,随着氯化钙和氯化铁浓度的增大,AlCl3·6H2O的溶解度逐渐减小。盐酸浓度对于 AlCl3·6H2O在 FeCl3-HCl-H2O和 CaCl2-HCl-H2O体系中的溶解度的影响显著,随着盐酸浓度的增加,AlCl3·6H2O的溶解度显著减小。将实验数据和模拟结果做了比较,发现它们的平均相对误差均小于5%,说明所选模型能够很好地预测实验条件下AlCl3·6H2O在FeCl3-CaCl2-HCl-H2O体系中的溶解度。并且在粉煤灰酸浸液提铝工艺中,可以通过改变溶液的浓度和盐酸浓度来控制结晶氯化铝的结晶效果。
