蛛网萼未成熟种子培养与离体繁殖
2019-05-23曹丽雯支肖戴嘉禾于宁宁陈怡倩叶立新陈利萍徐礼根
曹丽雯,支肖,戴嘉禾,于宁宁,陈怡倩,叶立新,陈利萍*,徐礼根*
(1.浙江大学农业与生物技术学院园艺系,杭州 310058;2.浙江凤阳山-百山祖国家级自然保护区凤阳山管理处,浙江 丽水 323700)
蛛网萼(Platycrater arguta)属于绣球花科(Hydrangeaceae)蛛网萼属(Platycrater)小型落叶灌木[1],喜生于溪涧边和阴湿裸岩旁[2]。其植株常呈丛生状态,花瓣4枚,花色纯白,具有极高的观赏价值。同时,蛛网萼作为东亚特有的单种属植物,对研究东亚植物地理、植物区具有深远的科学价值[3-4]。近年来,由于生物学特性和环境因素的双重影响,蛛网萼分布面积和资源量日渐减少,种群自然增强能力减弱,面临很高的灭绝风险。因此,1992年蛛网萼被列入《中国植物红皮书——稀有濒危植物》名录,为国家二级濒危种[5]。蛛网萼在自然条件下主要通过产生大量种子进行繁育[6]。然而,已有研究表明,尽管蛛网萼能产生较多的种子,但由于种子体积小限制了其获取养分,使得真正成熟能萌发的种子数量十分有限,而且在野外环境条件下落地的种子随着时间的延长,其活力不断下降,导致蛛网萼种子在自然状态下萌发率极低[7]。张丽芳等[6]研究表明,即使蛛网萼成熟种子在适宜的环境条件下,也存在萌发时间长,萌发不整齐,萌发的幼苗脆弱、不易生长等问题。这些因素都导致了蛛网萼资源量减少和种群自然增强困难。植物组织培养是提高种子萌发率、加快植物繁育的重要的现代生物技术之一[8]。然而,迄今为止通过组织培养培育蛛网萼的研究尚未见报道。
近年来,野生植物的开发利用已经成为园林植物与观赏园艺研究方向的重要组成部分,是丰富园林植物物种多样性的根基与源泉。然而,野生蛛网萼存在生长缓慢、植株矮小、对生长环境要求高等问题,限制了对其进一步的开发利用。研究表明,野生植株多倍体的诱导是对其开发利用的有效途径之一。多倍体植株一般具有生长旺盛,抗逆、抗病性强和适应能力广等特性[9]。而利用秋水仙素进行化学诱变是获得多倍体植株的重要方法之一[10-11]。例如,CHEN等用秋水仙素对野生剪秋罗进行加倍处理后,获得了大花、矮壮、观赏价值更高的植株[12]。
本研究以采集于浙江凤阳山-百山祖国家级自然保护区的蛛网萼种子为试验材料,通过未成熟种子的离体培养,获得试管实生苗。以试管实生苗的茎段为外植体,培养在木本植物用培养基(woody plant medium,WPM)[13]附加不同6-苄氨基嘌呤(6-benzylaminopurine,6-BA)和α-萘乙酸(1-naphthylacetic acid,NAA)质量浓度配比的培养基上,建立蛛网萼的“芽生芽”离体繁殖体系。在此基础上,通过不同质量浓度秋水仙素处理带腋芽的茎段,诱导蛛网萼多倍体材料的获得。再生芽经生根、炼苗后野外回归至自然保护区内生长。研究结果对蛛网萼濒危资源的保护及其利用具有重要的理论意义和实践价值。
1 材料与方法
1.1 试验材料
分别采集野生蛛网萼成熟果实和未成熟果实。成熟果实为紫红色,顶部孔呈开裂状态;未成熟果实为浅绿色,顶部孔呈闭合状态。采样时间为2013年9月中下旬到10月初。地点为浙江凤阳山-百山祖国家级自然保护区内。
1.2 试验方法
1.2.1 材料消毒
分别将摘取的成熟果实和未成熟果实用洗洁精清洗后在流动水下冲洗2 h。将冲洗好的果实放置在超净工作台上,用75%乙醇浸泡30 s,无菌水洗3次。再用0.1%HgCl2消毒10 min,其间摇晃3~5次后,无菌水冲洗5次。最后用无菌滤纸将果实上的多余水分吸干。
1.2.2 种子的剥离与接种
将消毒后的果实置于铺有灭菌滤纸的培养皿中,用灭菌解剖刀切除上下两端各0.3 cm左右。然后纵向切开,左手持镊子夹住果实外皮,右手持解剖刀将种子及部分子房组织取下。以底部铺1层湿润滤纸的培养皿作发芽床,以置于发芽床的成熟种子作对照(CK)。将成熟种子和未成熟种子连同部分子房组织接种到种子萌发培养基(表1)上进行培养,直至未成熟种子颜色变为暗褐色,再随机挑取成熟种子和未成熟种子各10颗转移至新的种子萌发培养基上。培养条件为:(20±2)℃、黑暗。

表1 培养基成分Table 1 Component of medium
1.2.3 种子的萌发
将以上种子转移至弱光条件(光照强度20 μmol/(m2·s)、光照时间12 h/d)下诱导萌发。培养35 d后统计萌发率,并观察试管实生苗的生长情况。
1.2.4 繁殖体系的建立
将试管实生苗转移至WPM+1mg/L6-BA+1mg/L玉米素+500 mg/L水解酪蛋白培养基上生长,待其长出3~4片叶后,取单节的试管实生苗茎段(约0.5 cm左右),转移至1~4号含4种不同6-BA和NAA质量浓度配比的繁育培养基(表1)上。每个浓度处理4个茎段外植体,每隔10 d观察并记录诱导的再生芽的高度和生长情况。培养条件为:温度(20±2)℃、光照强度 20 μmol/(m2·s)、光照时间 12 h/d。平均生长高度变化率=(平均终株高-平均起始株高)/平均起始株高×100%。
1.2.5 多倍体诱导试验
取蛛网萼带腋芽的茎段分别置于含100、200、300、500 mg/L 4种质量浓度的秋水仙素的液体MS培养基中,于摇床内(150 r/min,28℃)培养3 d。再将经秋水仙素液体培养基处理过的带腋芽茎段移植于WPM培养基上,观察其生长情况。培养条件为:温度(20±2)℃、光照强度20 μmol/(m2·s)、光照时间12 h/d。每个浓度处理3个茎段,并进行3次生物学重复。在多倍体诱导试验中,存活率=(成活个数/接种个数)×100%。
1.2.6 流式细胞分析
称取单个诱导芽完全展开的叶片约20 mg,放入塑料培养皿中,加入100 μL OttoⅠ缓冲液,用锋利的刀片将其剁碎,以释放细胞核。再用直径为30 μm的尼龙网过滤到1.5 mL离心管中,5 000 r/min离心2 min。取沉淀及100 μL上清液,吹打混匀。再加入100 μL OttoⅠ缓冲液,室温静置5 min,其间将溶液颠倒2~3次。加入500 μL OttoⅡ缓冲液和200 μL PI(碘化丙啶+核糖核酸酶)染色液,轻轻摇动混匀,避光静置5 min后,用BD FACS Calibur流式细胞仪测定数据,并通过Mod Fit LT软件进行分析[11]。
1.2.7 生根炼苗及野外回归
待再生芽长到1 cm左右后,转移至WPM+0.5 mg/L IBA生根培养基(表1)中诱导生根并观察生根情况。培养条件为:温度(20±2)℃、光照强度20 μmol/(m2·s)、光照时间12 h/d。
选取根系长为1.0~2.5 cm的试管苗,将瓶口打开,在自然环境中炼苗2~3 d。再将试管苗取出,用清水冲洗除去残留的培养基后转移至消毒的基质中。为保持蛛网萼生长环境高湿,每12 h或1 d对其全株进行喷淋,并避免阳光直射[12]。炼苗结束后选取部分植株进行野外回归。
1.2.8 数据处理
使用SPSS 22.0统计分析软件包对数据进行显著性分析。
2 结果与分析
2.1 种子的萌发情况
自然条件下种子萌发率低是野生植物发生濒危的重要原因之一。本试验以置于发芽床(CK)的成熟种子为对照,开展了成熟种子和未成熟种子在培养基上的诱导萌发试验。结果(表2)发现,播种35 d后,成熟种子无论在发芽床还是在种子萌发培养基上均不发芽,萌发率为0。未成熟种子在种子萌发培养基上颜色由浅黄褐色(图1A)逐渐转变为深褐色,培养成熟后种子萌发率达到了40.00%。萌发的试管实生苗叶片翠绿,外形矮小(图1B),生长速度较慢。

表2 不同处理方法对蛛网萼种子萌发率的影响Table 2 Effect of different treatments on germination rate ofP.arguta

图1 蛛网萼未成熟种子离体培养Fig.1 In vitro culture of immature seeds of P.arguta
2.2 繁殖体系的建立情况
为了扩大试管实生苗的数量,本试验将带有单个节的茎段(图2A)置于1~4号繁育培养基(表1)上进行培养。20 d左右发现,不同质量浓度6-BA和NAA的组合对诱导芽的个数影响没有差异,都只诱导产生了单个腋芽,并没有诱导出丛生芽。然而,1号培养基中诱导再生芽的平均生长高度变化率最大,为61.54%,是其他质量浓度配方的1.7~2.5倍,且腋芽长势良好,颜色浓绿,叶片较大(图2B)。6-BA和NAA不同质量浓度的组合诱导的再生芽的平均生长高度变化率存在显著差异(表3)。由此可见,WPM+1 mg/L 6-BA+0.5 mg/L NAA培养基是蛛网萼茎段培养的最佳配方。

图2 蛛网萼扩繁体系的建立Fig.2 In vitro propagation of P.arguta
2.3 蛛网萼的多倍体诱导结果
对濒危植物多倍体的诱导一方面可以提高其对环境的适应能力,另一方面还可以丰富其遗传多样性。本研究结果发现,经过多倍体诱导处理的带腋芽的茎段存活率随秋水仙素质量浓度的增加而显著降低,当秋水仙素质量浓度增加至500 mg/L时,带芽茎段全部死亡(表4)。存活下来的诱导芽经流式细胞仪鉴定发现:用100 mg/L秋水仙素处理后共获得了2个混倍体的芽,为二倍体和四倍体混合;用200 mg/L秋水仙素处理后共获得了5个混倍体的芽,为二倍体和四倍体混合(表5和图3)。综上表明:本试验获得了蛛网萼混合倍体的芽,而且二倍体的细胞数较多,但是其多倍体诱导的最佳质量浓度还需要进一步探究。
2.4 生根炼苗与野外回归分析
野外回归是野生植物种群增强与重建的重要途径,能更有效地对濒危植物进行拯救和保护。本试验对获得的再生芽进行生根诱导,将生长至1 cm高度左右的蛛网萼试管苗于WPM+0.5mg/L IBA生根培养基上进行诱导,产生了4~6根、1~2 cm长的根,并带有许多白色根毛(图4A)。经过7 d左右的炼苗处理后移栽至基质上进行培养,蛛网萼试管苗生长状态良好,叶片肥大,颜色翠绿(图4B)。选取部分移栽苗于2017年4月野外回归至浙江凤阳山-百山祖国家级自然保护区中。

表3 不同植物生长调节剂浓度处理对蛛网萼生长的影响Table 3 Effect of different concentrations of plant growth regulator on P.arguta growth
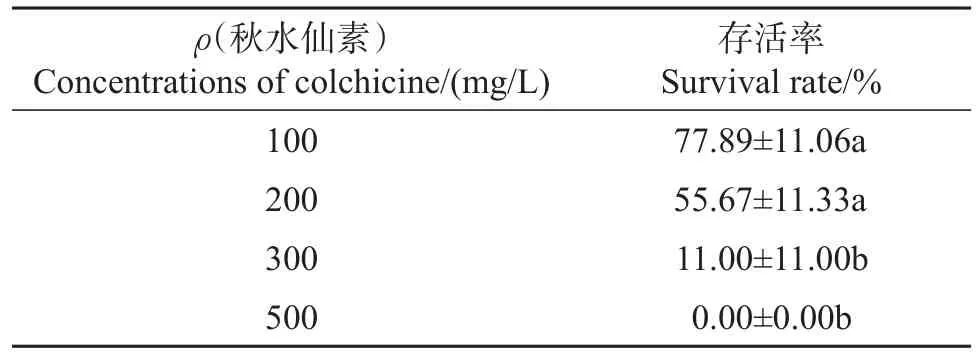
表4 不同质量浓度的秋水仙素对蛛网萼存活率的影响Table 4 Effect of different concentrations of colchicine onsurvival rate of P.arguta

表5 不同质量浓度的秋水仙素诱导对蛛网萼混倍体芽个数的影响Table 5 Effect of different concentrations of colchicine onnumbers of induced buds of P.arguta mixoploids
3 讨论
3.1 未成熟种子培养对提高蛛网萼种子萌发率的作用
野生植物主要依靠种子繁衍后代。然而本试验发现,蛛网萼成熟种子无论在发芽床还是在WPM+400 mg/L谷氨酰胺+500 mg/L水解酪蛋白+2 000 mg/L活性炭种子萌发培养基上均不能萌发。张丽芳等也发现,蛛网萼成熟种子在自然条件下萌发困难,处理后的蛛网萼种子最高萌发率只有12.5%,仍很低[6]。对于成熟种子萌发率低的情况,可以对未成熟种子进行组织培养,提高其萌发率。丁兰等发现,濒危植物佛手参的成熟种子难以萌发,而未成熟种子经培养后萌发率可达20%[14]。本试验使蛛网萼未成熟种子在萌发培养基中培养35 d后萌发率达到40%,有效解决了蛛网萼种子活力低或无活力的问题,研究结果可以作为保护蛛网萼濒危资源的重要手段之一。
3.2 蛛网萼高效离体繁殖体系的建立
野外观察发现,蛛网萼在自然状态下生长缓慢,植株矮小,且蛛网萼试管苗过于矮小,甚至叶片紧贴培养基,不利于其后期诱导生根。因此,本试验将诱导芽的平均生长高度变化率作为建立繁殖体系的重要衡量指标。已有研究发现,不同激素浓度及其组合方式对诱导芽的生长具有显著促进作用[15]。然而,至今仍未有对蛛网萼的研究。本试验利用“芽生芽”的培养方式[16],发现添加1 mg/L 6-BA和0.5 mg/L NAA的繁育培养基诱导的芽生长率最大,长势良好。此配方不仅有利于后期生根诱导和野外回归的开展,而且在一定程度上弥补了蛛网萼作为木本植物生长缓慢的缺陷,能在短时间内获得长势良好且基因组相同的蛛网萼试管苗,并防止通过愈伤组织途径带来的遗传变异,有效规避了对稀有濒危种质资源的破坏[17]。
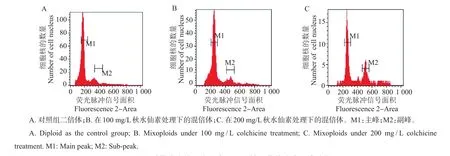
图3 不同质量浓度的秋水仙素处理后蛛网萼的流式细胞分析图Fig.3 Flow cytometric analysis histograms of P.arguta under different concentrations of colchicine treatments

图4 蛛网萼生根与移栽炼苗Fig.4 Root induction and seedling transplanted of P.arguta
3.3 秋水仙素诱导多倍体
CHEN等[12]发现,在组织培养的条件下利用秋水仙素处理茎段可以获得多倍体植株。本试验利用秋水仙素处理蛛网萼试管实生苗茎段,诱导出了二倍体和四倍体的混倍体再生芽,说明秋水仙素只诱导了再生芽部分细胞的加倍。混倍体在秋水仙素处理后非常常见[18],ZAHEDI等对大叶青兰进行诱导时,同时诱导出了四倍体和混倍体植株[19],而吉仁花等用秋水仙素处理金达苜蓿的愈伤组织只获得了混倍体[20]。一般情况下,可以通过提高秋水仙素的浓度来进一步诱导多倍体植株的产生,但是随着秋水仙素浓度的增大,其对细胞的毒害作用也加大。在本试验中,随着秋水仙素质量浓度的升高,混倍体产生的比率增大,但是诱导芽死亡率也升高,这与SHI等对冬枣(Ziziphus jujubeMill.)的诱导结果一致[21]。本研究获得的混倍体再生芽需要通过进一步诱导不定芽的产生来获得四倍体的植株[22-24]。
综上所述,本研究成果为相关稀有濒危种利用未成熟种子离体培养诱导种子萌发和建立繁殖体系来改善植株生长速度和植株高度提供了技术支持,并对秋水仙素诱导加倍濒危物种染色体以优化种质资源、增加物种多样性提供了技术参考。
