厌氧氨氧化研究的分子生态学进展
2019-05-23朱辰张乃方徐陈超张凯杭程磊
朱辰,张乃方,徐陈超,张凯杭,程磊
(浙江大学生命科学学院,生命系统稳态与保护教育部重点实验室,杭州 310058)
氮素对于地球上所有生物而言都不可或缺,它参与形成了细胞结构,是蛋白质和核酸的必要组成成分之一。其中,铵态氮和硝态氮是自然界中氮元素常见的存在形式。在传统的氮循环框架中,固氮细菌将大气中的氮气固定为铵态氮,而铵态氮向氮气的转化需要2步反应[1-2]:第一步是在有氧条件下,硝化细菌将铵态氮转化为硝态氮[3];第二步是在厌氧条件下,由反硝化菌把硝态氮转化成氮气[4](图1)。
20世纪90年代,对“厌氧氨氧化”[式(1)]的发现及相关微生物的鉴定打破了好氧氨氧化的传统观念[5-7]。

迄今为止,无数关于厌氧氨氧化菌的研究揭示了这类细菌具有广泛的分布及可能演化出的与众不同的结构与代谢特征。本文总结了最为常见的研究方法与技术,并在群落、细胞、分子与组学3个不同的层面论述了它们在厌氧氨氧化研究中起到的推动作用(图2)。
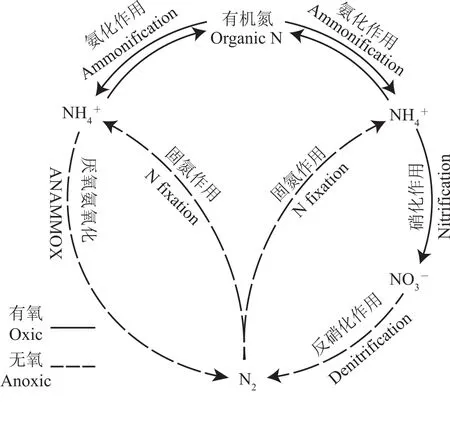
图1 氮循环框架Fig.1 Framework of nitrogen cycle

图2 厌氧氨氧化菌研究发展示意图Fig.2 Timeline ofANAMMOX bacteria research
1 群落水平
经典的培养方法和氮同位素标记相结合,为厌氧氨氧化过程及相关微生物的初步了解打下了基础。
1.1 厌氧氨氧化的发现
早期的厌氧氨氧化研究主要集中在厌氧生物反应器中。1995年,MULDER等[7]证实了BRODA的猜测[8],他们发现在反硝化流化床反应器(denitrifying fluidized-bed reactor,DFBR)中,随着氮气的产生,铵根离子和硝酸根离子的消耗也在不断增加,由此他们提出了在厌氧条件下以硝酸根离子(后来证明是亚硝酸根离子)为电子受体的铵根离子氧化反应,并将其命名为“厌氧氨氧化”[7]。紧接着,VAN DE GRAAF等通过灭菌实验进一步表明,厌氧氨氧化实际上是微生物参与的氧化还原反应[5]。
由于厌氧氨氧化菌的生长极为缓慢,迄今仍未获得它们的纯培养,但一些厌氧生物反应器的应用使厌氧氨氧化菌的富集研究取得了很大进展。首先,序批式反应器(sequencing batch reactor,SBR)利用生物膜,不仅提高了生物量的保留,还在很长时间内维持了反应器内稳定的底物环境,因此成功将厌氧氨氧化菌在富集后的微生物群落中的比例提升到了80%[9],为厌氧氨氧化菌的分类鉴定打下了基础。随后,膜生物反应器(membrane bioreactor,MBR)被证明是更为有效的富集工具,它一方面满足了厌氧氨氧化菌悬浮的自由生长状态,另一方面减少了细菌因为难以沉淀而造成的损失。在用MBR获得的富集产物中,厌氧氨氧化菌的比例可以达到97.6%[10],使得其全基因序列获取成为可能。
1.2 厌氧氨氧化的环境分布
在厌氧氨氧化发现之初,厌氧氨氧化的发生途径及它在自然界的地位是研究人员十分关注的问题,然而,采用单纯测定反应物和产物浓度的方法无法提供明确的证据表征其通量,而同位素标记法的出现为厌氧氨氧化的研究带来了新的机遇。
同位素是同一元素的不同原子,它们质子数相同,中子数不同,但是除了相对原子质量不同以外,化学性质基本相同。研究中,同位素标记培养常被用来追踪特定元素的转变过程。1997年,VAN DE GRAAF等首次尝试在反应器的培养体系中添加了15N标记的氮化合物,以此分析厌氧氨氧化的代谢通路,并预测联氨可能作为中间产物[11]。
在自然生态系统的物质转化方面,同位素标记起着十分重要的作用。反硝化产生的氮气中的氮原子全部来源于硝酸根离子,而厌氧氨氧化产生的氮气中的氮原子一个来自铵根离子,另一个来自亚硝酸根离子,因此它们的来源并不相同。在添加15N标记的和或者和对样品进行厌氧培养后,通过气相色谱-同位素比值质谱仪测定产物氮气中的29N2和30N2,可以得知在总的氮气产生中厌氧氨氧化所占的比例,从而估算环境中厌氧氨氧化在氮素流失上作出的贡献。
借助同位素标记,越来越多的研究验证了厌氧氨氧化在自然生态系统中的重要地位。例如在海洋生态系统中,厌氧氨氧化的贡献范围为0~67%[12],有时甚至可以超过反硝化;在淡水生态系统中,如天然淡水湖坦噶尼喀湖,厌氧氨氧化所产生的氮气也可以达到13%[13];而在陆地生态系统如水稻田中,同样也存在着厌氧氨氧化,其贡献的比例为4%~37%[14]。
厌氧氨氧化菌的分布差异可能是受到了环境因子的限制。作为厌氧微生物,厌氧氨氧化菌对氧气浓度的变化十分敏感,以空气中含氧量100%为氧饱和,它们在低于5%氧饱和的环境下可以生存,高于18%氧饱和的氧分压会抑制它们的活性[15];许多研究表明,pH中性或者弱碱性的条件比较适合厌氧氨氧化菌的生长和反应的发生,例如在反应器中的厌氧氨氧化菌,最适pH范围为6.7~8.3[11,16];温度也是厌氧氨氧化反应的另一个重要限制因子,厌氧氨氧化菌最适应的温度范围是20~43℃[17]。此外,取样深度[18]、盐度[19]、有机质浓度[17,20]等也都会对厌氧氨氧化反应产生影响。
近年来,陆续有研究证实全球气候变化可以对全球碳氮循环带来影响[21-23],而厌氧氨氧化反应对全球气候变化的响应还有待进一步研究。
2 细胞水平
以16S rRNA基因测序为基础的一系列分子手段的加入推进了厌氧氨氧化菌的结构、分类和代谢特征相关的研究。
2.1 鉴定与分类
1999年,STROUS等首次对厌氧氨氧化菌使用16S rRNA基因测序进行鉴定和分类,发现它们是属于浮霉菌门的一个单独分支[6],促使厌氧氨氧化菌的研究深入到细胞水平。
16S rRNA基因测序分析一直作为揭示细菌系统发育和细菌鉴定的重要方法之一。rRNA是一段十分理想的研究细菌分类的基因序列。几乎所有微生物都需要核糖体来进行转录,编码核糖体的序列在细胞中有着很高的比例且不可或缺,而且它们在进化过程中十分保守,因此常用作细菌的分类和进化判断的依据。
迄今为止,已经有Brocadia、Kuenenia、Anammoxoglobus、Jettenia和Scalindua5个属被归为厌氧氨氧化菌。厌氧氨氧化菌在自然界分布十分广泛,不仅存在于海洋、淡水、陆地等各种生态系统中,甚至在极端温度或者pH的环境中也有它们的分布(表1)。
在已知的厌氧氨氧化菌里,Brocadia、Kuenenia、Anammoxoglobus和Jettenia4个属大多出现在淡水或者人工处理系统中;而在海洋生态系统中则以Scalindua最为常见,特别是在一些海洋沉积物和最小含氧区(oxygen minimum zone,OMZ)中;Brocadia和Jettenia在土壤中占据主导地位。在一些情况下,微生物群落组成还会发生转变,例如在人工湿地系统中,单一的Brocadia在培养之后逐渐变成了由Jettenia、Brocadia和Anammoxoglobus组成的混合菌群[24]。
2.2 原位检测
基于碱基互补原则的荧光原位杂交(fluorescencein situhybridization,FISH)已经逐渐成为微生物生态学研究中的有力工具。它先是使用带有Cy3、Cy5等荧光基团标记的寡核苷酸探针对微生物细胞进行原位标记,再通过检测原位荧光来显示特定核苷酸序列(通常选用rRNA基因序列)的存在和分布。FISH操作快速且具有很高的灵敏性。在长期的摸索中,许多探针以其准确性和普适性在厌氧氨氧化研究中被广泛使用(表2)。
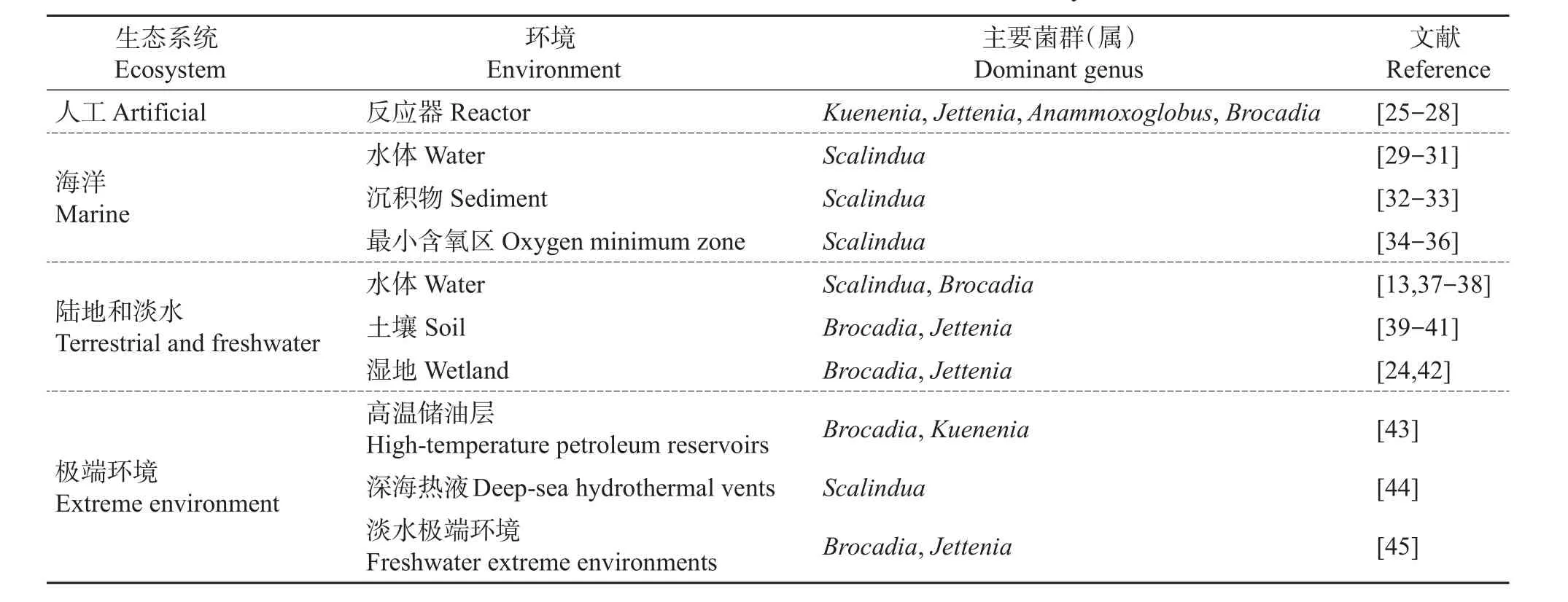
表1 厌氧氨氧化菌在不同环境中的分布Table 1 Distribution ofANAMMOX bacteria in different systems

表2 荧光原位杂交常用探针Table 2 Probes frequently used in fluorescence in situ hybridization(FISH)
FISH不仅在许多自然环境中原位证明了厌氧氨氧化菌的存在,还可以完成厌氧氨氧化菌的定量分析,例如在黑海和本格拉上升流等海洋水体的研究中,以FISH标记为依据的厌氧氨氧化菌细胞计数表明单细胞的反应速率和之前在反应器内测得的数据相吻合[29,34]。
然而,在陆地生态系统的研究中,FISH面临着较大的局限性。厌氧氨氧化菌的低丰度及大量可以产生自发荧光的干扰物对FISH的灵敏度提出了更高要求。催化报告沉积荧光原位杂交(catalyzed reporter deposition-fluorescencein situhybriddization,CARD-FISH)技术的出现在一定程度上解决了这个问题。它使用以辣根过氧化物酶(horseradish peroxidase,HRP)标记的寡核苷酸探针,杂交完成后加入含有荧光标记的酪胺,利用HRP催化酪胺沉积的酶促反应使得荧光信号随之聚集。荧光信号的放大无疑可以大幅度增强显微镜下标记微生物的辨识度。
2015年,NIE等在水稻田土壤样品中采用CARD-FISH进行原位检测,并成功获得了厌氧氨氧化菌原位图像[51]。相信随着这一技术的不断成熟和推广,将会给陆地生态系统中厌氧氨氧化的研究带来更多的契机。
2.3 定量分析
在厌氧氨氧化菌研究中,定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR)同样也是一项与基因测序相结合的分子技术。常被用到的方法包括TaqMan探针法和SYBR Green染料法。qPCR的原理是在PCR反应体系中加入荧光基团,随着PCR反应的扩增,荧光信号不断增强,实时监测的荧光信号可以根据外参基因或者内参基因所建立的标准曲线来计算待测样品中目标基因的拷贝数。
在许多研究中,厌氧氨氧化菌丰度的估算都会以厌氧氨氧化菌的16S rRNA基因作为目标基因[14,36,52],如HAMERSLEY等发现在秘鲁海洋最小含氧区的水体中,几乎所有深度都有厌氧氨氧化菌的分布,而且它们在总群体中所占的比例从0.8%到3.1%不等[36]。除此之外,一些功能基因如联氨氧化酶基因(hzo)[53-54]和联氨合成酶基因(hzs)[26,41-55]等也会被用来进行厌氧氨氧化菌的丰度评估。
2.4 细胞结构
在引入现代分子手段的同时,STROUS等借助透射电子显微镜找到了富集于微生物群落中的厌氧氨氧化菌,发现它们外观呈不规则的球状,平均直径为0.8~1.1 μm[6]。值得注意的是,厌氧氨氧化菌有着一层由致密的“梯烷(ladderane)”组成的膜,这层膜在细胞内部形成了一个封闭的厌氧氨氧化体(anammoxosome)(图3),这个结构在其他已知的原核生物中都没有出现过。厌氧氨氧化体可以占据细胞50%~80%的体积[56],致密的膜结构有效地防止了厌氧氨氧化反应过程中有毒产物进入细胞。正是因为厌氧氨氧化菌结构上的这一特点,所以在很多研究中,梯烷也可以作为厌氧氨氧化菌的特征性标志物,用来探测厌氧氨氧化菌在环境中的分布[13,29,34]。

图3 厌氧氨氧化菌的结构及厌氧氨氧化代谢途径Fig.3 Structure and metabolic pathway of ANAMMOX bacteria
3 组学分析水平
基因组学(genomics)和蛋白质组学分析的应用使厌氧氨氧化菌的代谢途径和代谢相关酶类愈发清晰。
3.1 基因组学
在基因组中,通常相同功能或者相同起源的基因会聚集形成基因簇,而通过与已知功能基因的相似性比对来预测基因组中不同位置基因的功能,可以很好地反映这个物种的代谢需求。2006年,STROUS等从环境DNA中获得了CandidatusKuenenia stuttgartiensis(K.stuttgartiensis)相对完整的基因序列,在厌氧氨氧化菌的代谢和功能研究中加入了基因组学分析[57]。在K.stuttgartiensis基因组中,有200多个与厌氧氨氧化有关的基因。根据亚硝酸盐还原酶基因(nirS)的出现,STROUS等提出在厌氧氨氧化反应中,可能存在以NO为中间产物的新型代谢途径[57]。
另外,对基因组的分析还带来了其他的发现。在结构上,浮霉菌门细菌的细胞壁一直被认为不含肽聚糖,但在K.stuttgartiensis中却检测到一些编码肽聚糖的基因,近年研究也证实厌氧氨氧化菌的细胞壁中的确含有少量肽聚糖[58],这表明厌氧氨氧化菌本该属于革兰氏阴性菌。
在固定二氧化碳方面,K.stuttgartiensis存在着编码完整的乙酰辅酶A途径的基因。随着关键酶活性的证实,说明厌氧氨氧化菌其实是一类通过乙酰辅酶A途径进行二氧化碳固定的化能自养菌。
新近研究也表明,在铵的吸收方面,K.stuttgartiensis基因编码的铵转运蛋白中,有一类只与铵根离子结合并不参与转运的不同于其他家族成员的蛋白,它们很有可能代表了进化上比较原始的一类铵转运蛋白[59]。
近年来,Brocadia、Jettenia和Scalindua的部分或完全基因组序列也相继被测出[60-62]。分析表明,不同种类的厌氧氨氧化菌在编码关键酶的基因上存在一些差异,例如在K.stuttgartiensis和CandidatusScalindua profunda(S.profunda)中存在的nirS,并不存在于CandidatusBrocadia fulgida(B.fulgida)和CandidatusJettenia asiatica(J.asiatica)中,预示着它们的亚硝酸盐代谢途径可能有所不同。
3.2 转录组学和蛋白质组学
转录组代表的是细胞内基因表达的水平,在转录水平上的分析往往更能代表细菌的活性。2011年,KARTAL等利用蛋白质组和转录组分析,阐明了K.stuttgartiensis完整的分子机制[63]:在厌氧氨氧化体内,亚硝酸还原酶首先将亚硝酸根离子还原成一氧化氮;然后,一氧化氮与铵在联氨生成酶作用下反应生成中间产物联氨;最后,联氨在联氨脱氢酶的作用下分解形成氮气,完成整个厌氧氨氧化循环(图2)。
4 展望
厌氧氨氧化不仅在自然界具有重要的地位,在污水处理方面也起着重要的作用[64]。直接氧化铵产生氮气简化了硝化-反硝化反应过程,节省了物质和能源的消耗。目前已经发展出ANAMMOX、SHANNON-ANAMMOX和CANON等工艺应用于污水脱氮处理。
然而,由于厌氧氨氧化菌生长缓慢和对环境变化敏感的特性,人们对于它们的了解还不够深入,许多假设仍待进一步验证,其中的科学问题及其应用前景仍待深入发掘。首先,如何获得厌氧氨氧化菌的纯培养,是否能找出浮霉菌门以外的能够进行厌氧氨氧化的细菌;其次,关键酶类的体外解析是否可以帮助完善这类细菌的代谢通路;再者,以亚硝酸为电子受体的厌氧氨氧化菌和以其他如铁[65]、锰[66]、硫氧化物[67]等为电子受体的厌氧氨氧化菌的遗传代谢机制的差异等。
经典方法的迅速革新和新兴技术的快速发展为解决这些问题提供了前所未有的机遇。一方面,作为微生物富集首要途径的厌氧生物反应器已经愈发高效和成熟,与此同时,稳定同位素探针(stable isotope probing,SIP)技术在环境微生物培养方面的应用也会大大加速主导菌群的鉴定[68];另一方面,合成生物学的发展使得越来越多的关键酶类能够在体外表达,甚至可以重构其代谢通路验证其功能,为厌氧氨氧化过程中关键酶的解析提供了极大的便利。
作为全球氮循环中至关重要的一环,厌氧氨氧化的阐释不仅可以帮助完善微生物种群与功能之间的联系,而且在如何有效地进行环境的利用和保护及探讨整个生态系统对于全球气候变化的响应方面也具有十分重要的意义。
