基质辅助激光解吸电离飞行时间质谱法对中药材霉菌污染的快速鉴定
2019-05-22徐小雁郭寅龙
徐小雁,苏 越,郭寅龙
(1.上海中医药大学 中医方证与系统生物学研究中心,上海 201203;2.中国科学院 上海有机化学研究所 上海有机质谱中心,上海 200032)
随着中药材消费的增加,中药材的品质日益受到人们的关注[1]。霉变是引起中药材品质变差的重要原因之一。一方面,霉变会引起中药材有效成分的降解,另一方面,霉菌会产生许多对人体有害的霉菌毒素,因此快速准确地确定药材是否被霉菌污染对于药材质量控制具有非常重要的意义[2]。传统的鉴定方法是微生物计数法,该过程需对霉菌进行稀释培养,耗时耗力[3]。目前,很多研究通过酶联免疫吸附法[4]、荧光分析法[5]、液相色谱-质谱联用法(LC-MS)[6-7]、气相色谱-质谱联用法(GC-MS)[8-9]等对中药材中的霉菌毒素进行测定,从而鉴定中药材被霉菌污染的情况。上述方法的灵敏度较高,能够有效检测各种霉菌毒素,其中LC-MS法已成为目前霉菌毒素分析的标准方法。但这些方法受样品基体的影响较大,通常需要较繁琐的样品前处理过程,而且它们仅限于检测其中的产毒霉菌,具有局限性。因此需要开发一种新的方法对中药材霉菌污染状况进行快速鉴定[10]。
甾醇是一类以环戊烷多氢菲为基本结构的甾族化合物,其广泛存在于细菌、真菌以及动植物中,根据来源可分为植物甾醇、动物甾醇以及菌类甾醇等。由于甾醇结构的多样性,使它们具备许多生物学功能,例如,β-谷甾醇和麦角甾醇分别是植物和真菌细胞膜的重要组分,在细胞信号调节方面具有非常重要的作用[11]。中药材中的甾醇一般均为植物甾醇,而受到霉菌污染后,由于微生物的存在会出现动物来源以及菌类来源的甾醇,所以可通过确定中药材中甾醇的种类来鉴定其是否受到霉菌污染。目前甾醇类化合物的分析主要采用LC-MS及GC-MS法[12-14],但样品前处理较复杂,需要分离纯化过程,不能满足高通量筛选的需要。此外,由于甾醇类化合物的质子亲和力较低,酸性较弱,质谱信号易被抑制,灵敏度较低。因此将质谱法与高效的衍生化方法相结合,能够提高分析的灵敏度。目前已开发出许多提高甾醇分析灵敏度的衍生化方法[15-16],例如,Van Berkel等[17]利用二茂铁离子化反应成功鉴定了棕榈果提取物中的甾醇。Tai等[18]利用丹磺酰氯衍生化显著提高了人血清中甾醇的测定灵敏度。本课题组开发了一种新型的甾醇衍生化技术N-烷基吡啶同位素季铵化反应(NAPIQ),并运用该反应对食用油、人的毛发以及尿液中的甾醇类化合物进行定性定量分析[19-23]。
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)由于其高灵敏度、高通量以及简单的样品处理步骤,已被广泛应用于各种生物样本中复杂物质的分析。本文运用NAPIQ结合MALDI-TOF MS,对中药材中的甾醇进行了定性分析,通过进一步检测动物来源以及菌类来源的甾醇,对中药材的霉菌污染情况进行评价,为快速鉴定中药材霉菌污染状况提供了可能。
1 实验部分
1.1 实验材料
新鲜白杜叶和接骨木采自上海中医药大学百草园;发霉白杜叶和接骨木是将新鲜药材放置后获得;吡啶(纯度>99.9%)购自Sigma-Aldrich公司;三氯甲烷(HPLC级)、二氯甲烷(HPLC级)、三氟甲磺酸酐(Tf2O,99%)购自上海化学试剂有限公司;氘代吡啶(>99.9%)购自美国Cambridge Isotope Laboratories Inc.;三氟醋酸(TFA,≥ 99.5%)购自Fluka 公司;乙腈(ACN,HPLC级)、乙醇(ETOH,HPLC级)均购自Merck公司;α-氰基-4-羟基肉桂酸(CHCA)购自 Sigma Chemical Co.(St.Louis,MO);环四磷腈质谱校准溶液合成于上海有机化学研究所;实验用水(18 MΩ·cm)由Milli-Q去离子水净化器(Millipore,ELPaso,TX)纯化;沙氏葡萄糖琼脂培养基和氯化钠-蛋白胨缓冲液均购于北京陆桥生物技术有限公司。
1.2 样品处理
本实验分为两组,一组为新鲜药材,另一组为发霉药材。称取新鲜药材和发霉药材各0.2 g,用7 mL氯仿浸泡20 min得提取液,两组提取液各量取1 mL加入衍生化反应瓶中,N2吹干,向两组提取液中均加入30 μL 的20%吡啶二氯甲烷溶液和30 μL的20%氘代吡啶二氯甲烷溶液,再与60 μL 20%三氟甲磺酸酐的二氯甲烷溶液(体积比1∶1)混合,摇床上(220 r/min,30 ℃)反应,2 h后向反应液中加入30 μL水,12 000 r/min 离心10 min,取下层二氯甲烷层N2吹干,向反应瓶中加入30 μL 10 mg/mL的 CHCA基质溶液,摇匀后点样。
1.3 MALDI-TOF MS 分析
质谱采集由日本JEOL公司MALDI Spiral-TOF MS(Spiral 3000 MALDI质谱仪)完成。后处理软件为msTornado Analysis,质谱条件:Spiral正离子模式,激光能量45%,检测器灵敏度60%,延迟时间300 ns。质量校正采用环四磷腈质谱校准溶液作为内标。
1.4 微生物计数法
样品处理:取发霉药材10 g置于100 mL高温灭菌的氯化钠-蛋白胨缓冲液中,制成霉菌悬液。另取10支试管,分别加入9 mL高温灭菌的缓冲液,向第1支试管中加入1 mL霉菌悬液,摇匀后,取1 mL加至第2支试管中,依次类推,将霉菌悬液稀释10个梯度。从各个稀释度的霉菌悬液中取1 mL分别加至10个平板中,加入适量的沙氏葡萄糖琼脂培养基,待其冷凝后置于32 ℃培养7 d,每个稀释度做3个平行样本。
阴性对照:取新鲜药材10 g置于100 mL高温灭菌的氯化钠-蛋白胨缓冲液中,制成悬液,按照阳性对照的方法进行稀释培养,并计数。
空白对照:取1 mL氯化钠-蛋白胨缓冲液于培养皿中,加入适量的沙氏葡萄糖琼脂培养基,待其冷凝后32 ℃培养7 d。观察计数:微生物数=平均菌落数×稀释倍数。
2 结果与讨论
2.1 实验条件的考察
NAPIQ反应是一种以三氟甲磺酸酐为醇羟基的活化试剂,吡啶/氘代吡啶为季铵化试剂的衍生化技术。其可以特异性地与羟基和α,β-不饱和酮类化合物发生反应,具体反应历程如图1所示。本实验利用该反应对从植物中提取的甾醇进行了衍生化,三氟甲磺酸酐首先会活化甾醇分子中的羟基,形成三氟甲磺酸酯基,而后吡啶/氘代吡啶取代三氟甲磺酸酯基形成相应的季铵盐,此种季铵盐在用MALDI-TOF MS进行检测时可以得到D0/D5的对峰。考察了乙醇和氯仿作为提取溶剂时的影响,结果显示,乙醇提取液衍生化后所得到的质谱图信号较差,m/z484、486、488处的甾醇信号强度较低,而用氯仿进行提取所得到的衍生化质谱图中甾醇种类较多,信号较强,因此选用氯仿作为提取液。

图1 实验过程Fig.1 The procedure of the experiment
2.2 新鲜中药材的检测结果
运用NAPIQ衍生化反应结合MALDI-TOF MS对新鲜的白杜叶和接骨木进行了检测,结果见图2。根据MALDI-TOF MS测定结果,以误差小于5 ppm为标准,比较谱图中的实验质荷比与目标衍生化产物的理论质荷比,分别对新鲜的白杜叶和接骨木中的甾醇种类进行了定性分析。结果表明,从新鲜的白杜叶中共检出3种植物甾醇,分别为豆甾-5,7,22-三烯-3-醇、豆甾醇以及谷甾醇,其中豆甾-5,7,22-三烯-3-醇的氘代吡啶衍生物的准确质量数偏差>5 ppm,这主要是由于受到m/z476.422峰的同位素峰的影响所致。从新鲜的接骨木中共检出2种植物甾醇,分别为豆甾-5,7,22-三烯-3-醇和谷甾醇。其化合物信息见表1。对这两份新鲜的药材进行微生物计数,均未观察到霉菌,表明符合药典标准。

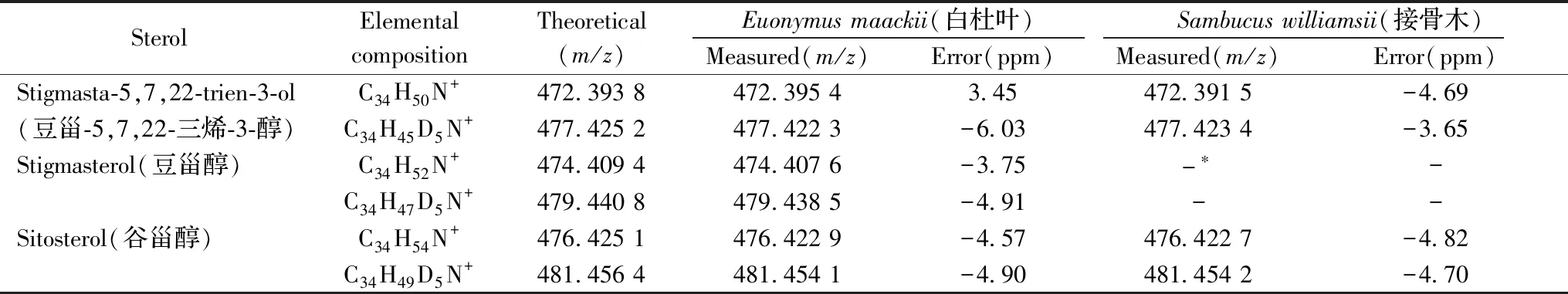
SterolElemental compositionTheoretical (m/z)Euonymus maackii(白杜叶)Sambucus williamsii(接骨木)Measured(m/z)Error(ppm)Measured(m/z)Error(ppm)Stigmasta-5,7,22-trien-3-olC34H50N+472.393 8472.395 43.45472.391 5-4.69(豆甾-5,7,22-三烯-3-醇)C34H45D5N+477.425 2477.422 3-6.03477.423 4-3.65Stigmasterol(豆甾醇)C34H52N+474.409 4474.407 6-3.75-∗-C34H47D5N+479.440 8479.438 5-4.91--Sitosterol(谷甾醇)C34H54N+476.425 1476.422 9-4.57476.422 7-4.82C34H49D5N+481.456 4481.454 1-4.90481.454 2-4.70
*not detected
2.3 发霉中药材的检测结果
运用NAPIQ衍生化方法结合MALDI-TOF MS对发霉的白杜叶和接骨木中的甾醇进行检测,所得质谱图如图3所示。结果表明,在发霉的白杜叶中共检出8种甾醇,其中麦角甾-4,6,8(9),22-四烯-3-酮、麦角甾醇、4,4-二甲基麦角甾-1,5,7,22-四烯-3-醇、4,4-二甲基麦角甾-5,7,22-三烯-3-醇属于菌类甾醇,羊毛甾醇属于动物甾醇,这5种甾醇在新鲜的白杜叶中均未检出(见表2);从霉变的接骨木中共检出7种甾醇,其中麦角甾醇为菌类甾醇,羊毛甾醇和2,5-二氢羊毛甾醇为动物甾醇,这3种甾醇在新鲜的接骨木中均未检出(见表3)。因此,上述在发霉药材中峰度很高的动物甾醇以及菌类甾醇可以作为药材受霉菌污染状况的鉴定指标。为验证该方法是否符合药典标准,对这两种发霉药材进行了微生物计数,发霉的白杜叶中微生物数为2.0×105cfu/g,发霉的接骨木中微生物数为2.3×105cfu/g,均大于药典规定的102cfu/g,表明这两种药材均发生了霉变。
利用MALDI Spiral-TOF MS的高分辨率优势,可以区分质荷比非常接近的物质。例如,麦角甾醇与溶液中干扰组分的质荷比非常接近(图3B),但可以通过比较其准确质量数进行区分,实验中麦角甾醇的准确质量数为m/z458.376 1,而干扰物质的准确质量数为m/z458.238 6,由此可以排除干扰组分的影响。

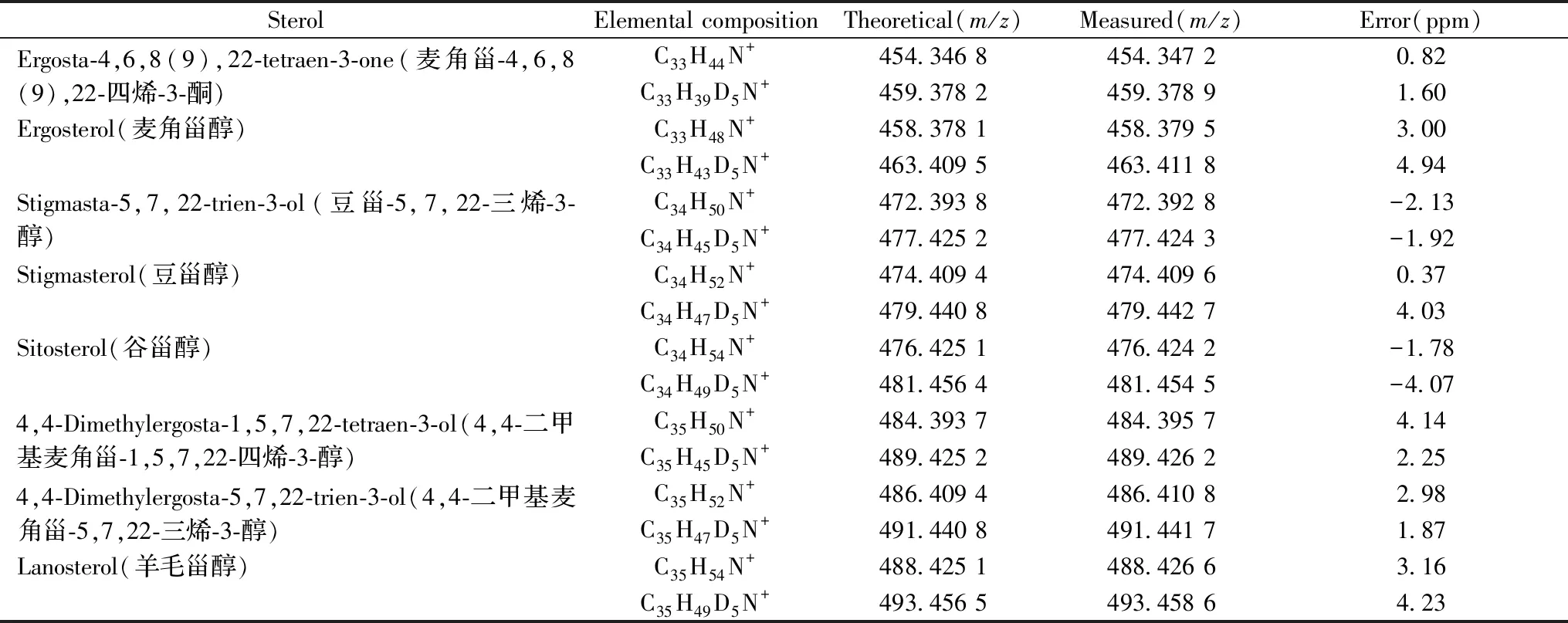
SterolElemental compositionTheoretical(m/z)Measured(m/z)Error(ppm)Ergosta-4,6,8(9),22-tetraen-3-one(麦角甾-4,6,8(9),22-四烯-3-酮)C33H44N+454.346 8454.347 20.82C33H39D5N+459.378 2459.378 91.60Ergosterol(麦角甾醇)C33H48N+458.378 1458.379 53.00C33H43D5N+463.409 5463.411 84.94Stigmasta-5,7,22-trien-3-ol(豆甾-5,7,22-三烯-3-醇)C34H50N+472.393 8472.392 8-2.13C34H45D5N+477.425 2477.424 3-1.92Stigmasterol(豆甾醇)C34H52N+474.409 4474.409 60.37C34H47D5N+479.440 8479.442 74.03Sitosterol(谷甾醇)C34H54N+476.425 1476.424 2-1.78C34H49D5N+481.456 4481.454 5-4.074,4-Dimethylergosta-1,5,7,22-tetraen-3-ol(4,4-二甲基麦角甾-1,5,7,22-四烯-3-醇)C35H50N+484.393 7484.395 74.14C35H45D5N+489.425 2489.426 22.254,4-Dimethylergosta-5,7,22-trien-3-ol(4,4-二甲基麦角甾-5,7,22-三烯-3-醇)C35H52N+486.409 4486.410 82.98C35H47D5N+491.440 8491.441 71.87Lanosterol(羊毛甾醇)C35H54N+488.425 1488.426 63.16C35H49D5N+493.456 5493.458 64.23

表3 霉变接骨木的氯仿提取液衍生化后所得甾醇及其结果Table 3 Results of sterols extracted with CHCl3 from moldy Sambucus williamsii
3 结 论
本文运用NAPIQ衍生化反应结合MALDI-TOF MS对新鲜药材和发霉药材中的甾醇类化合物进行了检测,在两种新鲜药材中检出的甾醇均为植物甾醇,而在发霉药材中除了较常见的植物甾醇外,还有动物甾醇及菌类甾醇检出。这主要是由于药材受到了霉菌的污染。因此,可以通过药材中检测出的甾醇种类对药材的霉菌污染情况进行快速评价,以对药材的质量进行控制。
