Ⅲ型内耳不完全分隔耳蜗植入10例*
2019-05-22安鹏王健刘世龙王瑜王秋阳李阳杨兰兰蔡兰兰柯怡彤
安鹏,王健,刘世龙,王瑜,王秋阳,李阳,杨兰兰,蔡兰兰,柯怡彤
(1.湖北医药学院附属襄阳市第一人民医院,湖北 襄阳 441000;2.湖北省襄阳市博爱优抚医院,湖北 襄阳 441000)
内耳不完全分隔畸形是先天性听力障碍重要原因之一,我国每年有3 万新增听力损失残疾儿童出生,随着二胎政策的开放及高龄孕妇的增加,听力损失残疾新生儿数量将逐步增加[1-2]。据报道先天性听力损失多与妊娠期特定的并发症或遗传因素有关[3]。由内耳畸形导致的感音神经性听力损失主要包括骨性及膜性畸形,前者可通过磁共振成像(magnetic resonance imaging,MRI)及电子计算机断层扫描成像(computed tomography,CT)诊断。NANCE 等[4]1971年首次详细报道Ⅲ型内耳不完全分隔(incomplete partition type Ⅲ,IP-Ⅲ)的骨性特点并称其为一种X 型染色体连锁遗传性混合型听力损失。其特点是镫骨底板固定或撼动手术时会出现井喷。IP-Ⅲ患者临床较罕见,手术较复杂易井喷甚至危及生命,本报道10 例IP-Ⅲ患者耳蜗植入情况。
1 资料与方法
1.1 一般资料
选取2009年5月—2017年10月襄阳市第一人民 医院及襄阳市博爱优抚医院收治的重度感音神经性听力损失患儿10 例。均为男性,耳蜗植入时年龄1.2 ~ 11.0 岁,平均(4.57±3.47)岁。9 例患者有佩戴助听器史,效果欠佳。均否认家族性传染病史及遗传病史。
1.2 影像学检查
选用GE Light Speed 16 及Siemens 64 排CT,采用横断面及冠状面扫描后图片重组。螺距1 mm,层厚0.5 ~1.0 mm;矩阵512×512,窗宽2 000 ~4 000 HU,最终行骨算法重建。
1.2.1 纳入标准 ①CT 示内听道底与耳蜗底的骨间隔部分缺损,诊断为内耳IP-Ⅲ畸形;②双耳纯音测试:常规开放语言识别率低于50%或极重度听力缺失;③心肺功能正常,全身麻醉评估通过。
1.2.2 排除标准 ①合并癫痫或颅脑肿瘤;②脑白质病变、中耳炎等特殊情况;③凝血功能异常;④近6个月开颅手术。
选用Mindray M9 便携式超声诊断仪,线阵探头,频率8.0 ~10.0 MHz,伤口缝合后观察皮下有无广泛无回声区及大片低回声炎症渗出物。
1.3 手术方法
患者呈仰卧位,头偏向对侧,常规消毒手术耳及耳侧面部皮肤,铺孔巾行全身麻醉。耳显微镜下显示鼓膜完好后沿耳后弧线切小口,电切除乳突气房后暴露砧骨短脚及鼓窦入口,打开面神经隐窝并定位圆窗龛,暴露鼓阶后常见涌出脑脊液,本次井喷9 例(9/10,90%)。将耳蜗(澳大利亚Cochlear Nucleus 公司)电极从面神经隐窝置入鼓阶,取部分梭形肌肉填入电极的鼓阶入口并缝合固定及堵塞漏口,无脑脊液漏后取部分肌肉填入面神经隐窝。行术中CT 检查观察电极位点并确认其在鼓阶中,并未移入内耳道;检测电极阻抗及神经反应遥测,正常后缝合封闭切口并结束手术,术后便携式超声扫查伤口皮下有无大量渗液,均无异常及麻醉醒后安返病房。
2 结果
2.1 听力学检查
10 例IP-Ⅲ患者术前均被诊断为双耳极重度感音神经性聋,未检出残余听力1 例,有残余听力9 例。纯音测听平均为(121.11±21.04)dB HL。Click ABR测试平均为(96.51±8.94)dB nHL;潜伏期只引出V波4 例共5 耳,只引出Ⅲ、V 波2 例共2 耳,5 波均引出1 例共2 耳,其左、右耳I、V 波间期分别为4.26和4.24 ms,V 波耳间差为0.03 ms。40 Hz 相关电位测试示平均阈值为(98.61±14.96)dB nHL。ASSR 测试示平均阈值为(102.41±22.24)dB HL。DPOAE 测试示双耳均未引出。
2.2 影像学检查
10 例患者颞骨CT 扫描均提示双侧耳蜗底转与内听道底的骨质间隔部分缺失,蜗轴缺失,内耳道扩大(见图1),内耳道水成像显示蜗后神经发育良好(见图2)。其中单纯IP-Ⅲ型耳蜗畸形7 例,占70%(7/10),合 并 大 前 庭 水 管 综 合 征(large vestibular aqueduct syndrome,LVAS)1 例,占10%(1/10);合并IP-Ⅱ型耳蜗畸形2 例,占20%(2/10)。
2.3 手术情况
术后检查均无耳道内瘘、面瘫及颅内高压。术后均未出现其他并发症,行CT 扫查后均见电极植入耳蜗鼓阶中(见图3)。植入后患者均1 ~4 周内正常开机调机,12 个月后听觉表现趋于稳定,声场助听听阈测试示平均听阈值为(39.11±6.61)dB HL,言语识别率单音节词表平均为45%,扬扬格词表平均为61%,神经遥测结果显示不同程度改善,引起反应波。
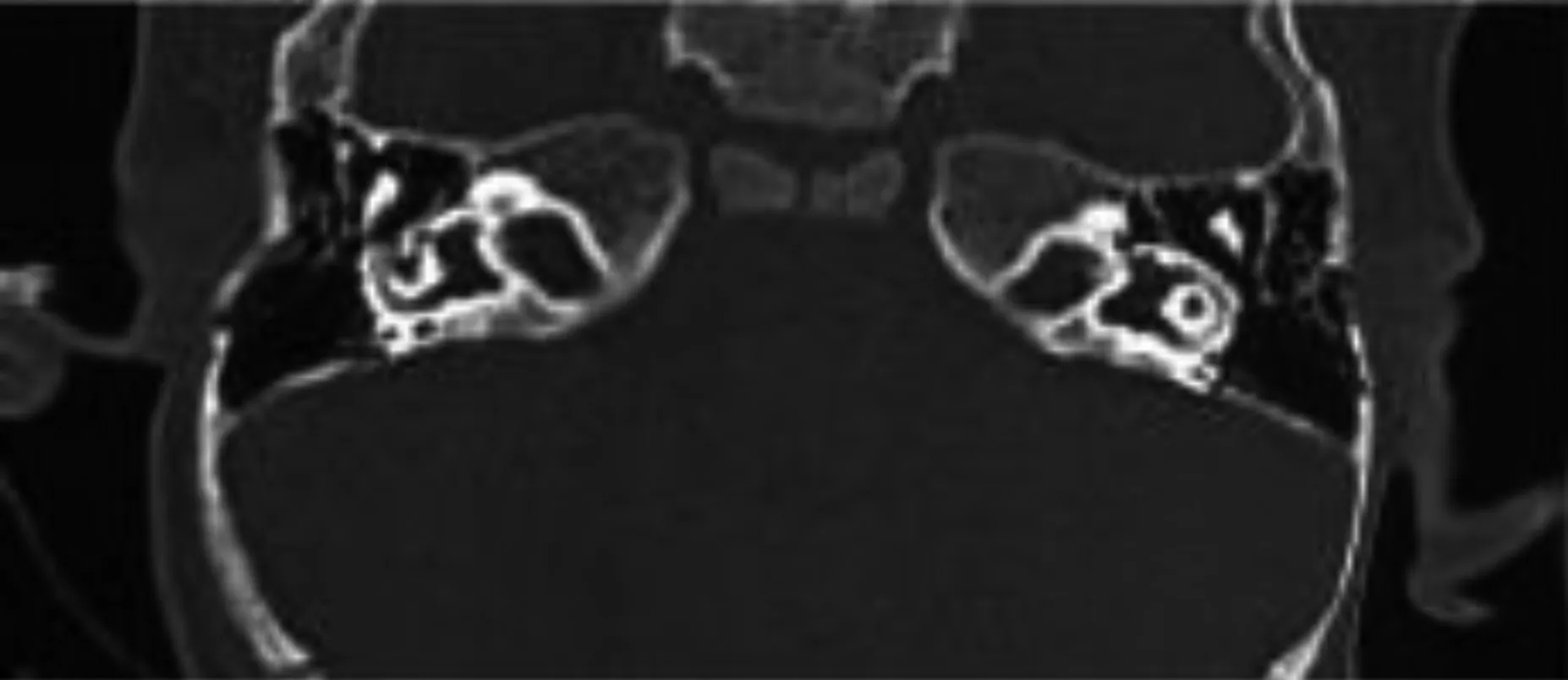
图1 双侧耳蜗底转与内听道底的骨质间隔部分缺失, 蜗轴缺失,内儿道底膨大
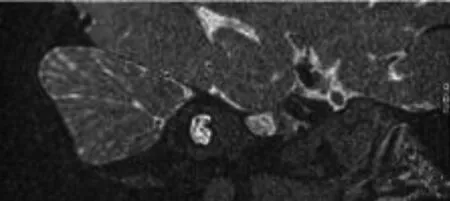
图2 内耳道水成像显示前庭上、下神经、 蜗神经及听神经发育良好
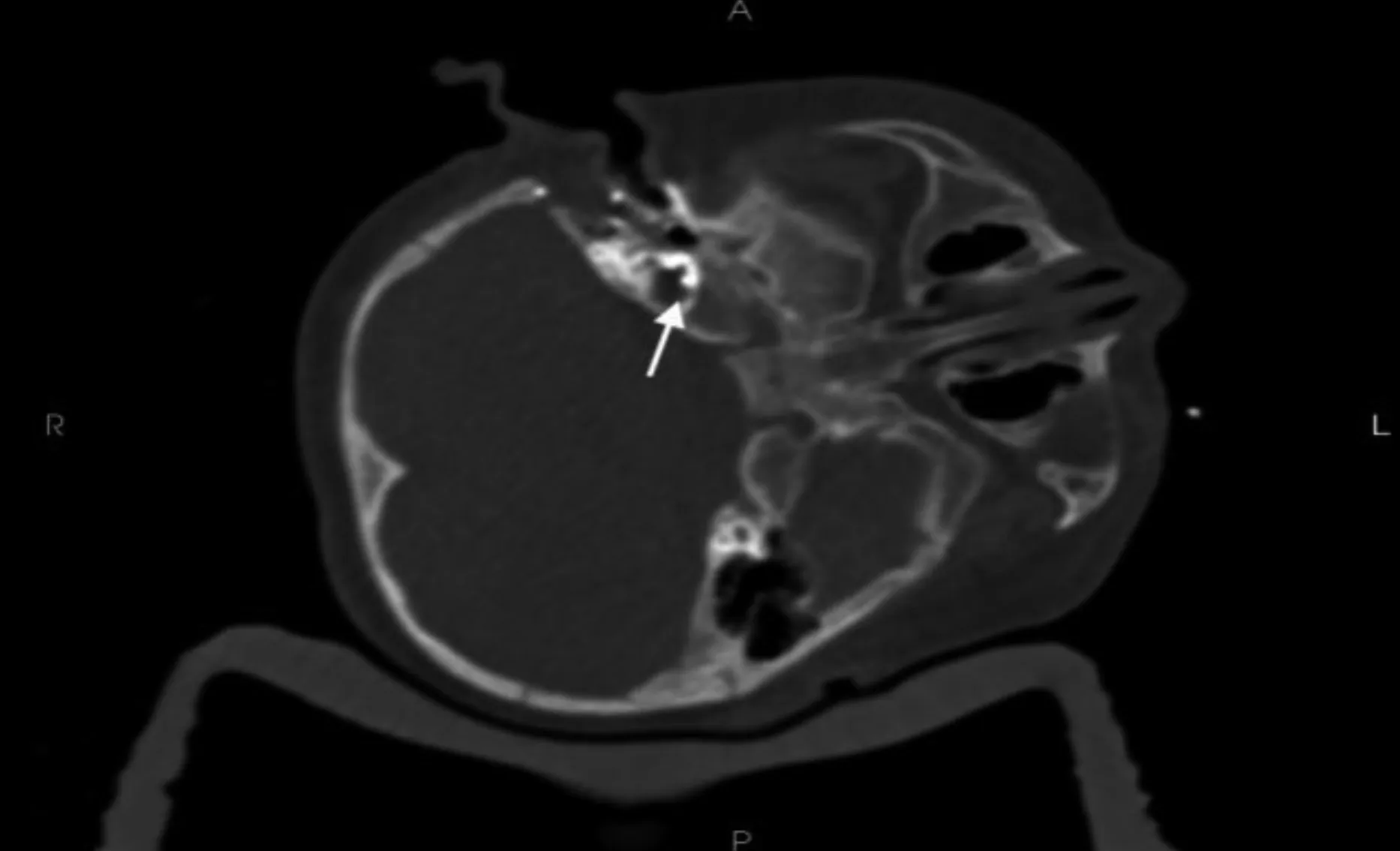
图3 术中CT 示右耳耳蜗电极植入位置正常
3 讨论
据报道,IP-Ⅲ畸形多与POU3F4(DFNX2)基因突变导致的X 连锁有关[3],POU3F4变异多致蜗轴的缺损及菲薄的耳蜗骨性包膜,可能与中耳黏膜上皮的血管发育异常有关,女性携带此基因但罕见发病,常表现为男性发病,本研究10 例均为男性与之相符。但亦有报道女性携带者会表现出较轻微的内耳畸形并出现轻度听损的案例[5-6]。
IP-Ⅲ具有特征性的内耳畸形的解剖形态,文献[7]报道特征如下:①内耳道底椭球形膨胀;②不完全分隔的耳蜗与内耳道;③颞骨面神经第一、二段交汇处角度常小于90°。10 例IP-Ⅲ患者CT 资料均表现为耳蜗底转及内耳道底的骨质间隔部分缺损、内耳道呈变异呈椭球形膨胀;蜗轴消失,但形态仍类似正常耳蜗,与报道一致并做了补充;此外,IP-Ⅲ患者CT扫查见耳蜗的骨性包膜较薄,膜迷路的轮廓似由增厚的骨内膜层构成[8]。正常耳蜗有3 层包膜,IP-Ⅲ的包膜仅存在增厚内骨膜层,中层软骨膜、外层骨膜层或异常菲薄或不存在[9]。此外,TALBOT[9]发现部分IP-Ⅲ畸形的前庭导水管的内侧呈不同程度的膨大;且神经迷路段在耳蜗内上方,与正常面神经曲折行于耳蜗底异同,但MRI 扫查听神经、蜗神经仍正常;这说明IP-Ⅲ也存在变异,本次有2 例患者结果与上述特征一致。
本研究10 例IP-Ⅲ患者术前均诊断为重度感音神经性耳聋且均无传导性耳聋。首先,ABR 显示耳I、V 及V 的波间潜伏期差值均正常并提示正常的蜗后通路。然后,其他听力测试均显示各级频率段上听力损失的严重程度,虽然ABR、ASSR、40 Hz 相关电位的测试可作为听力损失程度的参考,但仍存在偏差,因此,耳科临床医师需将准确的主观纯音测试作为听力损失诊断的金标准。耳蜗手术时电极的选择可影响患者的后续听力恢复。IP-Ⅲ患儿耳蜗蜗轴的消失,螺旋神经节常附在耳蜗壁外。MELO[10]提出对蜗轴缺失的IP-Ⅲ患儿使用全环电极能有效刺激螺旋神经节细胞。但临床研究认为全环电极有刺激面神经损伤的风险,故半环电极手术优势更大[11];本手术中共采用直电极9 例及弯软电极1 例。若电极正常植入后神经反应遥测结果较差时,应警惕电极误入内耳道的可能。为防止电极进入内耳道,术中CT 电极定位法尤为重要。本研究发现,1 例采用弯软电极植入后可保留电极的内芯以防止电极环抱短路的发生。此外,术后便携式超声可探查切口皮下是否存在大量渗液,这对术后评估有着重要意义。
本手术中出现井喷9 例(9/10,90%),与文献报道相符[12]。PHELPS[7]提出井喷与内耳道内蛛网膜下腔-耳蜗内的外淋巴液互通有关。井喷导致的脑膜炎是术后严重的并发症,可导致死亡,需引起重视并做好补救工作。本手术中出现井喷时,在植入电极后医师立刻取数块梭形肌肉及筋膜垫于圆窗龛处缝合并仔细观察有无复喷,取得良好的效果。李万鑫[13]认为出现井喷时,应在脑脊液流出压力逐渐降低后再植入电极,不建议使用甘露醇直接降低颅内压;本研究有2例效果佳。
在正确的调试耳蜗及助听器后并加上周期性的语言训练,IP-Ⅲ患儿的听力及语言能力均逐步恢复。本次术后12 个月随访患儿行声测听平均值39.11 dB HL,患儿对声音敏感性强,听力不同程度恢复,这与患儿MRI 检查的听神经形态正常有关,国外文献亦有报道。因为耳蜗畸形阻碍其正常的放大功能致听力损 失,而听神经的异常会致患儿的言语信号编码错误,终致言语分辨能力下降,故听神经正常患儿耳蜗植入后恢复效果佳。据报道单纯的IP-Ⅲ畸形患儿的手术难度会大于共同腔及Mondini 畸形,但术后恢复较好。医师应与家属做好术前沟通,意识到手术过程中的风险,建立合理的期望值[14]。
综上所述,IP-Ⅲ患儿术前影像学有助评估预后,手术易井喷,应做好补救措施,术后患儿听力恢复佳。
