猪流行性腹泻病毒N蛋白单克隆抗体的制备与鉴定
2019-05-21张庆桥王一鹏魏艳秋米建华孙立旦宋勤叶
张庆桥,王一鹏,魏艳秋,米建华,赵 雪,孙立旦,宋勤叶
(1.河北工程大学生命科学与食品工程学院,河北 邯郸 056021;2.河北农业大学动物医学院 河北省兽用生物制品工程技术研究中心,河北 保定 071000;3.河北省涞水县畜牧水产局,河北 涞水 074199)
猪流行性腹泻病毒(PEDV)属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae)甲型冠状病毒属(Alphacoronavirus)成员。该病毒引起的猪流行性腹泻(PED)是猪场常见的一种肠道传染病,以猪呕吐、腹泻、脱水和死亡为特征。1971年PED首次发生于英国的生长育肥猪群,1973年我国上海发生PED,随后该病主要以地方流行性形式在国内多地猪场发生[1]。但2010年秋冬以来,PEDV变异株引起的PED在国内暴发流行,初生仔猪的发病率和死亡率高达100%,给养猪场造成了巨大经济损失[2-4]。目前PEDV是导致仔猪腹泻的最重要的致病因子[5-6],此外,猪传染性胃肠炎病毒、猪轮状病毒猪δ-冠状病毒以及大肠杆菌等也是引起仔猪腹泻常见病原[5-6]。不同病原引起的临床表现相似,给临床诊断造成了很大困难。因此,研究高效特异的诊断试剂,建立快速检测技术,具有重要实践意义。
单克隆抗体(McAb)以其高特异性、高均一性、方便生产、容易标准化和商品化等优势,成为病原学或血清学检测技术、感染与免疫机制研究以及靶向治疗的理想工具。核衣壳蛋白是PEDV的主要结构蛋白,保守性高,在PEDV感染早期,细胞内N蛋白浓度高,是病毒感染早期诊断与监测的主要靶蛋白[7]。此外,N蛋白还与病毒致病以及机体的细胞免疫应答反应有关[8]。本研究旨在用体外表达的重组N蛋白作为免疫原,应用杂交瘤技术,获得分泌单克隆抗体的杂交瘤细胞株,制备PEDV特异性单克隆抗体,为PEDV诊断或检测技术的进一步研发以及感染免疫机制的研究奠定基础。
1 材料与方法
1.1 细胞与毒株 Vero细胞和SP2/0骨髓瘤细胞,购自中国兽医药品监察所;表达PEDV N蛋白的工程菌E.Coli BL21,由河北农业大学传染病实验室制备。PEDV HBMC2012株(GenBank ID:JX163294),由河北农业大学传染病实验室分离鉴定与保存。
1.2 主要试剂与试剂盒 DMEM、HAT(次黄嘌呤-氨甲蝶呤-胸腺嘧啶核苷)和HT(次黄嘌呤-胸腺嘧啶核苷),均购自Sigma公司;胎牛血清,购自Hyclone公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(H+L),购自康为世纪生物科技有限公司;HRP标记的山羊抗小鼠IgM,购自武汉博士徳生物工程有限公司;山羊抗鼠 IgG+IgM H&L(FITC),Abcam公司产品。Pierce Rapid ELISA Mouse mAb Isotyping Kit,购自Thermo公司;IgM类单克隆抗体纯化试剂盒,购自北京博奥龙免疫技术有限公司。
1.3 实验动物 BALB/c小鼠,购自北京维通利华实验动物技术有限公司。
1.4 间接 ELISA 每孔用0.1 μg纯化的PEDV包被96孔酶标板;弃去包被液,洗涤3次;每孔加入100 μL封闭液,37℃封闭1 h;弃去封闭液,每孔加入100 μL鼠抗 PEDV阳性血清(1∶40倍稀释),37℃孵育1 h,洗涤;加入HRP-羊抗鼠IgG(1∶2 000倍稀释),100 μL/孔,37 ℃孵育45 min,洗涤;加入 TMB底物溶液,100 μL/孔,避光反应15 min;加入2 mol/L 的 H2SO4,50 μL/孔,终止反应。用自动酶联检测仪测定OD450nm值,当待检样本的OD450nm值≥0.3时,判定为抗体阳性;当OD450nm值<0.3时判定为阴性。
1.5 PEDV-N重组蛋白的制备 参照文献[9]所述方法,将表达PEDV-N蛋白的E.Coli BL21单个菌落接种到Amp+/LB培养基中振摇培养,待对数生长期(OD600nm值=0.6~0.8),用终浓度为0.5 mmol/L的IPTG诱导表达5 h。离心收集菌体,冰浴下超声裂解细胞;离心,收集上清。按照Ni-Agarose His标签蛋白纯化试剂盒说明书,纯化重组N蛋白,回收透析后的蛋白,测定蛋白含量,-80℃保存备用。
1.6 动物免疫 用纯化的PEDV-N重组蛋白免疫4只6~8周龄的BALB/c小鼠,连续免疫3次,间隔两周,每次每只小鼠经背部皮下注射50 μg蛋白。首次免疫抗原与弗氏完全佐剂乳化,第2、3次免疫抗原与弗氏不完全佐剂乳化。最后1次免疫后10 d,用间接ELISA检测小鼠血清中的PEDV特异性抗体水平。在融合前3 d每只小鼠腹腔注射100 μg蛋白,进行加强免疫。
1.7 杂交瘤细胞株的建立
1.7.1 细胞融合 无菌摘出加强免疫后3 d的小鼠脾脏,制备脾细胞。将脾细胞与SP/20骨髓瘤细胞按照5∶1的比例混合,1 000 r/min离心10 min,弃上清;取细胞沉淀,使其均匀松散成糊状;应用聚乙二醇(PEG 4 000)方法使脾细胞和杂交瘤细胞融合。然后将融合后的细胞加入到铺有饲养细胞的96孔板中,100 μL/孔,置 37 ℃、5%CO2培养箱中培养。在融合后的第3天、6天、9天用HAT的1640培养液半量换液,第12天改用含1%HT的DMEM培养液半量换液,第14天后用含10%胎牛血清的1640培养液半量换液。
1.7.2 阳性杂交瘤细胞的筛选与克隆 当孔内杂交瘤细胞克隆生长到孔底面积的1/4~1/3时,用1.4的间接ELISA方法筛检分泌特异抗体的阳性孔。采用有限稀释法对阳性孔细胞进行3~4次亚克隆,当克隆细胞株的所有细胞孔的上清液结果均为阳性时,扩大培养阳性杂交瘤细胞,并冻存于液氮中。
1.7.3 杂交瘤细胞分泌抗体的稳定性检测 复苏冻存的阳性杂交瘤细胞,进行传代培养。收集第2、5、10、15、20、25、30 代的细胞培养上清,用间接ELISA法检测细胞分泌的抗体水平,评价杂交瘤细胞分泌抗体的稳定性。
1.8 单克隆抗体的大量制备 采用体内诱生腹水法大量制备单克隆抗体。取雌性BALB/c小鼠(≥12周龄),每只小鼠腹腔注射灭菌的石蜡油10~14 d后,腹腔注射杂交瘤细胞5×106个/只。约7~10 d后,抽取腹水,8 000 r/min离心10 min,收集上清,按照IgM类单克隆抗体纯化试剂盒的说明书纯化腹水,ELISA测定抗体效价后,分装后冻存于-80℃。
1.9 单克隆抗体的鉴定
1.9.1 单克隆抗体的类和亚类的鉴定将获取的单克隆抗体作1∶50倍稀释,按照鼠单克隆抗体类/亚类鉴定ELISA试剂盒(Thermo Scientific)的说明书进行抗体类型鉴定,当OD450nm值≥0.2判为阳性反应。
1.9.2 Western Blot试验 用PEDV N蛋白进行SDS-PAGE电泳,通过半干转印法将N蛋白转印到PVDF膜上,封闭后,取1∶400倍稀释的腹水作Western Blot,检测抗体与N蛋白的特异性结合活性。
1.9.3 间接免疫荧光试验(IFA) 将生长良好的Vero细胞铺于96孔板,待细胞单层生长达90%汇合时,感染HBQY2016株(0.5 MOI),同时设立未接毒阴性对照;将培养板至于37℃ 5%CO2孵育1 h;弃去病毒液,加入MEM维持液,置37℃、5%CO2培养箱培养48 h。按照文献[10]所述方法,将制备的腹水作1∶1 000倍稀释,进行间接免疫荧光试验,分析抗体与PEDV的结合特性。
1.10 单克隆抗体的初步应用
1.10.1 免疫过氧化物酶单层试验(IPMA)用HBQY2016株感染(0.1 MOI)生长良好的Vero细胞,同时设立非感染阴性对照。感染后48 h,弃去孔内液体,PBS轻洗细胞。每孔加入200 μL固定液(40%丙酮和0.2%BSA的PBS),室温固定20 min;弃去固定液,PBS洗涤3次;每孔加入100 μL 30%H2O2和甲醇混合液(1∶50),室温孵育 20 min;弃去孔中液体,PBST洗涤细胞3次;用含2%BSA的PBST于37℃封闭30 min;弃去封闭液,每孔加入100 μL单克隆抗体(4A7,1∶1 000倍稀释),37℃温育1 h;PBST洗涤5次,加入50 μL山羊抗鼠IgMHRP(1∶2 000倍稀释),37℃温育45 min;PBST洗涤5次,每孔加入100 μL DAB溶液,室温显色10~15 min,用水冲洗终止反应,显微镜下观察结果。
1.10.2 免疫组化 取QY2016株人工感染初生仔猪的小肠,4%多聚甲醛固定后,制成石蜡切片,经过脱蜡水化、抗原修复、阻断内源性过氧化物酶活性以及封闭后,取1∶500稀释的腹水(4A7),通过免疫组化技术,检测感染猪小肠内的病毒。
2 结果
2.1 免疫鼠血清特异性抗体 第3次免疫后10 d,4只小鼠的血清抗体全部转阳,ELISA抗体效价在1∶1 280~1∶2 560 之间(图 1)。 选择抗体效价为1∶2 560的小鼠用于细胞融合前进行冲击免疫。
2.2 杂交瘤细胞株 免疫小鼠的脾细胞和SP2/0骨髓瘤细胞融合后,以纯化的PEDV作为包被抗原用间接ELISA方法筛选阳性克隆孔,然后通过有限稀释法对阳性克隆孔进行3~5次亚克隆,最终获得了4株稳定分泌单克隆抗体的杂交瘤细胞,分别命名为:4A7、6C1、5E10和6F7,其分泌的抗体效价分别为:1∶3 200、1∶1 600、1∶800、1∶800(图 2a)。 复苏冻存的4株杂交瘤细胞,并连续传代培养30代,4A7和6C1的抗体效价稳定在1∶1 600~1∶3 200之间,5E10与6F7的抗体效价在1∶800~1∶1 600之间,表明4株杂交瘤细胞具有良好的抗体分泌稳定性。4A7、6C1、5E10和6F7杂交瘤细胞诱生的腹水抗体效价分别为:1∶106、1∶105、1∶105和 1∶105(图 2b)。
2.3 单克隆抗体的类、亚类与型 经鼠单克隆抗体类/亚类鉴定ELISA试剂盒鉴定,4A7、6C1、5E10和6F7四株杂交瘤细胞分泌的抗体均与抗IgM抗体、抗κ轻链抗体反应,OD450nm值>0.2,表明获得的4株杂交瘤细胞分泌的抗体均为IgM,其轻链均为κ链(表1略)。
2.4 单克隆抗体能与PEDV-N蛋白特异性结合Western Blot结果显示,4株单抗与PEDV N蛋白反应后,均在40 kDa处出现清晰条带(图3),说明4株单克隆抗体均能够与PEDV N蛋白发生特异结合。

图2 杂交瘤细胞培养上清液和小鼠腹水中的PEDV特异性抗体效价
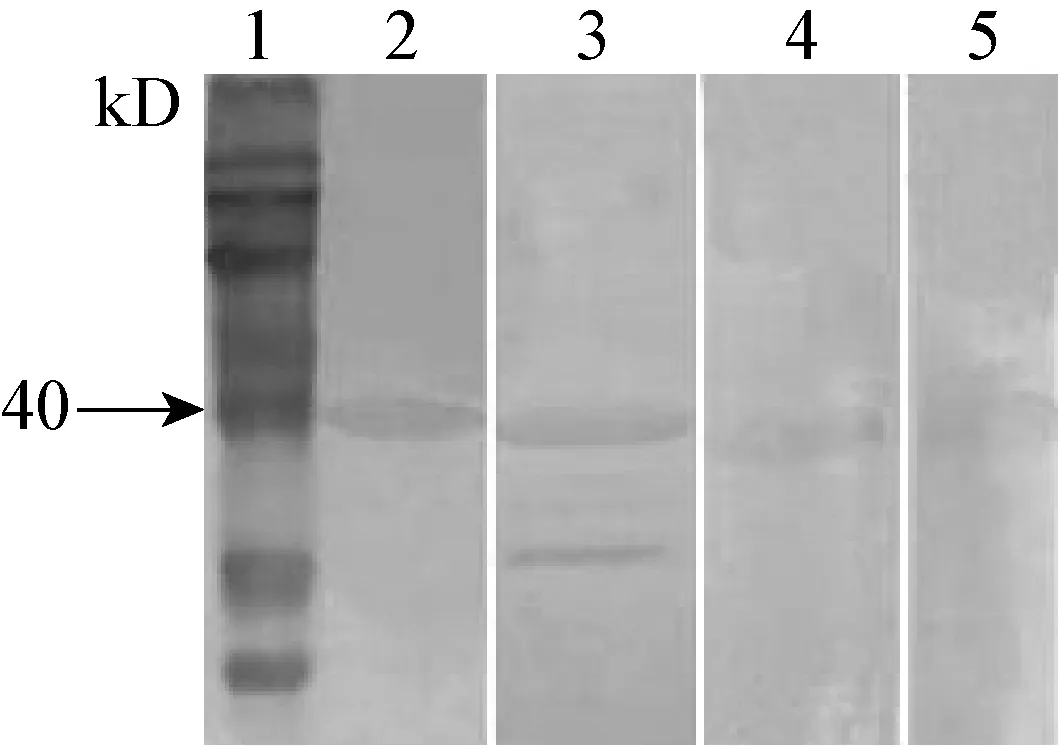
图3 单克隆抗体与PEDV-N蛋白反应的Western-Blot鉴定
2.5 单克隆抗体能与PEDV特异性结合 IFA检测显示,4株单抗均能与PEDV感染Vero细胞内的病毒发生特异性结合,在胞浆内发出特异性绿色荧光,而未感染病毒的阴性对照细胞内没有绿色荧光(见封三彩版图4)。该结果表明,制备的4株单抗均能够与PEDV发生良好的特异性免疫反应。

图4 单克隆抗体与PEDV反应的间接免疫荧光试验
2.6 单克隆抗体的初步应用
2.6.1 用于体外感染的PEDV鉴定 通过IPMA,用获取的单抗4A7检测PEDV感染Vero细胞内的病毒抗原,结果在感染细胞胞浆内出现棕色信号,而在阴性对照细胞内没有出现棕色信号(见封三彩版图5)。该结果表明,制备的单抗能够特异地检测到感染细胞内的特异性病毒抗原,可通过IPMA试验用于PEDV鉴定及细胞感染情况分析。
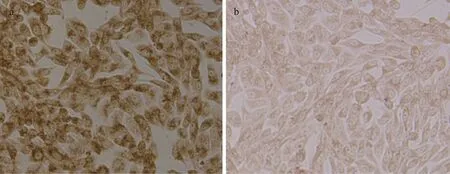
图5 用单抗4A7通过IPMA鉴定Vero细胞内的PEDV (×200)
2.6.2 用于体内感染的PEDV检测与定位 通过免疫组化技术,用制备的单抗4A7检测PEDV感染猪的小肠内的病毒抗原,结果在小肠上皮细胞内出现明显的棕色信号(见封三彩版图6),表明4A7能够与感染猪小肠内的PEDV抗原发生特异性结合,单抗可用于感染组织内PEDV检测与定位分析。

图6 用单抗4A7通过免疫组化试验检测PEDV感染猪小肠中的病毒 (×100)
3 讨论
猪流行性腹泻病毒、猪传染性胃肠炎病毒、δ-冠状病毒及轮状病毒是引起仔猪腹泻的常见病毒,临床上这些病毒可单独或混合感染引起腹泻,临床症状类似,需要实验室诊断才能够确诊[5-6,11]。对采集的仔猪腹泻样本的流行病学调查显示,近年来PEDV的检出率最高,是导致初生仔猪腹泻、死亡的最主要原因[5,6]。研制快速、准确诊断PED的检测试剂,对有效防治该病、降低经济损失具有重要意义。
由于病毒的体外培养、提取和纯化困难,花费时间长、成本高,所以通过分子生物学技术,在体外表达重组蛋白,以该重组蛋白作为抗原在单克隆抗体和其他检测技术的研究中应用十分广泛。本研究首次表达、提取和纯化了PEDV重组N蛋白,以其作为免疫原免疫小鼠,制备免疫脾细胞。此方案显著降低了抗原制备成本,缩短了单克隆抗体的制备周期。考虑到抗体的抗原结合活性与特异性,本试验在筛选阳性杂交瘤细胞时,用PEDV作为包被抗原,以确保筛选到的克隆为分泌PEDV特异单克隆抗体的阳性杂交瘤细胞。
病毒、细菌、大分子蛋白等抗原可诱导机体产生免疫反应,引起B细胞活化。活化的B细胞分化为不同浆细胞克隆,产生与抗原有特异性结合能力的不同类别的抗体,如IgG、IgM、IgA和gE等。当抗原初次免疫小鼠后,体内特异性抗体含量较低,主要成分为IgM;二次免疫后,抗体含量升高,此时抗体的主要成分为IgG,同时还会有少量的IgM。抗体类别发生转换受到多种因素的影响,如抗原性质、免疫途径与免疫佐剂、激活的Th细胞以及细胞因子等[12]。本试验中,用重组N蛋白共免疫了小鼠3次,在细胞融合前3 d,给小鼠进行了冲击免疫,此时体内浆细胞分泌的抗体应该以IgG类为主,但是本试验筛选出来的4株单克隆抗体均为IgMκ。此抗体类别与王隆柏等(2017)[13]报道的结果一致,其制备了两株单克隆抗体,其中识别PEDV N蛋白的为IgM,识别M蛋白的为IgG2a。该结果提示,N蛋白可能更容易诱导IgM的产生,此现象很可能与蛋白本身的抗原性质有关。至于这4株单抗识别的抗原表位是否相同以及表位序列,有待进一步鉴定。
ELISA、Western Blot和免疫荧光鉴定结果表明,制备的4株单抗能够与PEDV-N蛋白和细胞内病毒发生特异性结合,说明4株抗体具有良好的抗原结合活性。进一步通过免疫组化技术和IPMA证明,单克隆抗体(4A7)能够特异地识别PEDV人工感染猪小肠组织和感染Vero细胞内的病毒。这些试验结果说明,本试验制备的单抗能够用于PEDV抗原检测及感染病毒的组织定位分析,并可为ELISA、免疫层析试纸条以及化学发光免疫分析等PEDV诊断或检测技术的研发奠定基础。
