植物工厂生菜根际通风对冠层和根际环境影响
2019-05-21邹志荣
李 琨 ,邹志荣
(1. 西北农林科技大学园艺学院,农业部西北设施园艺工程重点实验室,杨凌 712100;2. 中国农业科学院农业环境与可持续发展研究所,北京 100081)
0 引 言
人工光植物工厂(PFAL,plant factory with artificial lights)是一种通过对设施内温度、湿度、光照、CO2浓度以及营养液等环境要素进行高精度自动控制,实现作物周年连续生产的高效农业系统[1]。经过多年研究,已经建立了一套以光/暗期变温控制为主的温度控制策略,辅以不间断的强制通风,使适宜温湿度及 CO2浓度的气体与内部空气进行交换,并在植物冠层上方保持一定的横向气流,使植物工厂内部各环境参数分布均匀,促进植物生长发育[2]。这一成熟的环境控制体系在密闭式人工栽培系统中得到了广泛的应用[3-7]。
然而,该传统通风调温方式很难使植物工厂内部各处形成均匀一致的气流场,随之而来的是温度场、湿度场和浓度场的不均匀。有研究表明,在规格为 3.47 m×4.35 m× 2.97 m 的人工光植物工厂中环境参数即存在较大差异,不同工况下不同高度处温差能够达到 0.4~2.7 ℃,流速差异可达0.963~1.408 m/s[8]。随着植物工厂规模逐步扩大,传统通风调温模式下不同区域环境差异进一步凸显,难以满足高品质蔬菜的生产环境需求。
研究表明,调高通风系统功率,增加叶面冠层气流速度可在一定程度上改善气流分布,促进植物光合作用。Thongbai等[9]将设施内的风速从不到0.5 m/s提高到1 m/s,使番茄幼苗的光合速率提高了1.6倍。Kitaya等[10]将风速从0.1 m/s增加到0.4 m/s,番茄叶片光合速率增加了1.3倍。在黄瓜幼苗光合与蒸腾速率试验中,当风速从0.005 m/s增加到0.8 m/s,光合速率增加1.7倍,蒸腾速率提高2.1倍[11]。其他植物如水稻、甘薯及大豆的光合速率对风速的响应表现出相同趋势[12-14]。此外,研究发现增加气流能使空气饱和蒸汽压差增加(相对湿度降低),促进外部叶片钙含量积累,有效抑制叶菜烧心病发生[15-17]。
上述方法虽然对叶面冠层气流分布有一定改善作用,但并未消除植物工厂内气流差异,原风速较低区域风速增加的同时,原风速较高区域植株可能会受到高速气流机械损伤;加之叶面冠层边界层阻力[18-21]及叶片封闭效应[22-24]的作用,横向的气流极易受到外部叶片的阻挡,使栽培单元内部风速降低,通风效率较低[15]。为了突破冠层边界层阻力及叶片封闭效应,提高植物工厂内气流及温度分布均一性,Goto等[25-26]提出了垂直通风技术,采用1根内径114 mm的主管连接6根内径32 mm的支管置于冠层上方,将气流由支管上的孔从上向下吹到叶片冠层,在一定程度上改善植株内部环境,效率高于水平通风。Zhang等[27]采用2根内径50 mm的带孔通风管提供气流,对密闭植物工厂内的气流特征进行了计算流体动力学(CFD,computational fluid dynamics)模拟并提出了较优的通风参数,冠层风速可达 0.42 m/s。Shibuya等[28]将带孔通风管敷设于栽培板上,使气流自下而上引入植物冠层内,通过与自上向下及水平通风方式进行比较,发现自下而上通风效率更高。Kitaya等[12]的试验表明垂直通风时的风速大于0.3 m/s时即可对光合速率增加产生明显效果。此外,有学者采用降温-加热-通风系统联合调控的混合控制策略减少植物工厂栽培架层间及不同区域间的环境差异,提高其均匀性[8]。也有研究通过改进植株栽培系统实现植物微环境参数的均匀分布。Nishikawa等[23]将植株放置在独立的旋转平台上,以2 r/min的速度匀速旋转,在一定程度上打破了外层植株对内部的阻挡,比不旋转植株产量提高了20%。
尽管上述通风方式对环境均一性起到了积极作用,但须借助粗重的打孔通风管或复杂的机械装置,初始投资和运行管理成本都较高,不利于推广应用。本研究将水培系统营养液面与栽培板之间的空气层作为气流通道,仅增加1个风机即可将气流导入植物冠层下部,不受边界层阻力和叶片封闭效应影响,同时实现冠层内部高效通风调温和根际微环境的调控。本文通过探明地上部及根际环境变化特点并对其响应机制进行分析,阐明该种通风调温模式相较于传统通风方式的先进性,并就其替代传统通风方式用于植物工厂通风的可行性进行探讨。
1 材料与方法
1.1 植物材料和生长条件
试验采用散叶生菜(Locarno RZ,荷兰瑞克斯旺)作为试验植物。将种子播种于育苗海绵上,并置于育苗盘中(320 mm×230 mm×40 mm)。使用纯净水使海绵保持湿润,覆盖黑色塑料膜进行避光处理,放置于LED人工光培养箱(GLED-250PY,北京陆希科技有限公司)内进行催芽育苗。4 d后,种子露白,去掉黑膜接受光照,光期16 h,温度(20±0.5)℃,暗期8h,温度(18±0.5)℃。3 d 后使用营养液 pH 值(6.3±0.1),EC 值(1.6±0.2) mS/cm 1/2浓度进行幼苗培育,7 d后幼苗长至两叶一心时,挑选健壮一致的幼苗植株移栽入位于中国农业科学院农业环境与可持续发展研究所的人工光植物工厂内,定植于泡沫栽培板(720 mm×650 mm×14 mm,栽培密度37株/m2)上。生长环境参数设定为光期16 h(07:00-23:00),温度(24±0.5)℃,相对湿度(65±10)%,CO2浓度(500±50)×10-6;暗期 8 h(23:00-07:00),温度(22±0.5)℃,相对湿度(65±10)%,CO2浓度(500±50)×10-6。植物冠层总光合有效辐射200 μmol/(m2·s),红蓝比(R/B)为8:1,每天进行20 min的营养液循环。为充分体现植株群体对微环境的影响与根际通风效果,栽培20 d后,在植株采收前(2017年12月15日—2017年12月22日)进行了为期7 d的根际通风处理与微环境参数监测。监测开始前采用新配制的营养液对旧营养液进行置换,监测开始后不进行营养液循环。
1.2 系统构建及测点布置
1.2.1 根际通风系统的构建
该研究设计制造了一套根际通风(RV,root zone ventilation)系统,其工作原理如图1所示。植物工厂环境空气经风机导入栽培板下方与营养液面上方的空气层中(高度20 mm),经栽培板蔬菜定植孔周围预留的通气孔自下而上排出,调节植物微环境。

图1 根际通风系统原理图Fig.1 Schematic diagram of root zone ventilation (RV) system
RV系统主要由离心风机(BFB1212HH,台达电子企业管理有限公司)及其控制系统组成。其中,风机出风口通过一连接管(108 mm×30 mm)固定于栽培板一端(图2a),在控制系统作用下可调整其工作时间,运行间隔及转速。试验栽培槽规格0.7 m×1.5 m,使用2块栽培板覆盖,共32个定植孔(4行8列)。围绕各栽培孔使用电热开孔器均匀开8个直径5 mm的通气孔(通气单元),孔心至栽培孔中心20 mm(图2b)。

图2 根际通风系统及风速测量装置Fig.2 RV system and velocity measurement device
为了准确的测量风速,我们采用薄塑料板进行弯折制作一直筒风管,其半径刚好能够覆盖整个通气单元,其高度在栽培板与光源板间距范围内尽量长,并与光源板保持一定距离,使通气单元中各通气孔的气流在直筒风管内充分混合后从顶端流出。最终确定所用直筒风管半径48 mm,高300 mm。在距该风管顶端50 mm处开一直径9 mm的风速检测孔(图2c),用于风速检测。
栽培板与栽培槽以及栽培板之间的所有空隙均采用橡胶条或胶带进行密封,防止气流从通风孔以外部位渗漏。该根际通风系统的运行时间和间隔时间采用自动循环时间控制器(ZYS48-S,上海卓一电子有限公司)控制。离心风机转速采用PWM直流电机调速器(CCM96SK,上海美默通电子有限公司)调整。
1.2.2 测点布置与测量方法
为了探明根际通风对植株微环境的影响,本研究对各处理的地上部和地下部环境参数进行了全面的监控,各传感器测点布置如图3所示。

1.冠层上部温湿度测点 2.冠层上部光合有效辐射测点 3.冠层下部温湿度、CO2浓度测点 4.空气层温湿度测点 5.空气层 CO2浓度测点 6.营养液温度测点 7.营养液溶解氧浓度测点1.Temperature and relative humidity measure points of canopy 2.Photosynthetic active radiation measure point of canopy 3.Temperature, relative humidity and CO2 concentration measure points of internal canopy 4.Temperature and relative humidity measure points of interlayer 5.CO2 concentration measure point of interlayer 6.Temperature measure point of nutrient solution 7.Dissolved oxygen concentration measure point of nutrient solution.
其中,植株冠层上部温湿度采用HOBO U14-001型温湿度记录仪(美国Onset 公司生产,精度:温度±0.2 ℃,相对湿度±2.5%)测定,记录仪悬挂于冠层上方成熟植株冠层水平高度(距栽培板15 cm)处。冠层下部温湿度、CO2浓度采用HOBO MX 1102型二氧化碳记录仪(美国Onset 公司生产,精度:温度±0.2 ℃,相对湿度±2%,CO2浓度±50×10-6)测定,记录仪置于单块栽培板中部由4株生菜定植孔组成的矩形区域内,当植株为成菜时,整个传感器被植株冠层遮挡。空气层温湿度采用 HOBO UX100-023型温湿度记录仪(美国 Onset 公司生产,精度:温度±0.2 ℃,相对湿度±2.5%)监测,其传感器为直径约10 mm的柱状探头,由一延长线与记录仪相连。在单块栽培板近中部区域 4株生菜定植孔组成的矩形区域内开一直径略小于10 mm的孔,将传感器探头从该孔插入至空气层,即可精确测量栽培板以下、液面以上空气层的温湿度。空气层CO2浓度采用HOBO MX 1102型二氧化碳记录仪监控。在栽培板边缘区域取一定植孔,将其孔径扩大至约40 mm,可精确地将记录仪CO2传感器嵌入上述孔中,监测空气层 CO2浓度。营养液温度、溶解氧浓度分别采用特氟龙涂层耐酸碱 Pt100温度传感器和DOS-600溶解氧传感器(北京博海志远科技有限公司)进行监测。将上述传感器穿过栽培区 2块栽培板拼接处缝隙浸入营养液中进行数据采集,使用无纸记录仪MIK-R4000D(杭州美控自动化技术有限公司)记录,缝隙采用胶带封闭。光合有效辐射数据采用Li-1500检测仪(美国 LI-COR)在冠层上方成熟植株冠层水平高度对不同波长光源进行分别测量获得。
作为RV的重要性能参数,试验所用离心风机的转速采用激光转速表(Testo 460,德图仪器国际贸易有限公司)进行测量,确定维持风机工作不致停转的最小转速为1 300 r/min,风机标称最大功率下所达到的最大转速为2 700 r/min。在不同转速下,各通气单元的风速也呈现出明显的变化。风速测量时,我们将热线风速仪探头(Climomaster 6501-BG,日本加野麦克斯公司)由前述直筒风管的风速检测孔插入至风管中轴线位置,施加一定压力使风管垂直扣于栽培板上,将某一通气单元(定植孔采用胶带进行封闭)完全包括于圆筒内(图 2c),此时风速仪度数即为该通气单元风速。
1.3 试验设计
为研究RV通风均匀性,试验以350 r/min为间隔将可用转速区间平均分成5个水平,在栽培区内2块栽培板上间隔选取了4列共计16个通气单元(单块栽培板测点选取如图2b所示),测试各通气单元在各风机转速下的风速,对其均一性进行评价。
为探明RV对植株微环境参数的影响,在上述试验结果的基础上选取使各通气单元风速均匀的最小及最大风机转速,结合其运行时间设置2种特殊工况的RV处理,并与传统环控方式(CEC,conventional environment control)进行对照。2种特殊工况的RV处理各采用同型号风机,分别为低速连续根际通风(LCRV)和高速间隔根际通风(HIRV)。其中LCRV将风机转速控制在最小值,间隔时间设为0,即风机24 h连续工作;HIRV风机转速设为最大值,运行时间50 min,间隔时间40 min,保证环境参数发生明显波动的同时,可在数据分析时根据时间差异准确地判断风机运行状态。上述RV工况不随光暗期交替进行变化。为保证RV处理微环境不受植物工厂内常规通风调温气流影响,采用塑料膜将2个RV处理栽培区包围,对应的侧边回风口采用无纺布遮挡,将风机进风口置于该包围外,确保栽培区处于根际通风作用下。CEC对照栽培区呈开放状态,侧边对应的回风口也处于打开状态,在植物工厂上进风侧回风的气流组织形式下,气流从栽培区一侧流经植物冠层上方后由回风口流走,形成传统的侧通风方式。2个RV处理与CEC对照同时在采用常规通风调温系统的植物工厂内进行,目标环境参数如材料和方法中所述。
2 结果与分析
2.1 根际通风均匀性分析
表1为不同风机转速下,栽培区中16个通气单元的风速及其平均值。

表1 风机不同转速下栽培区内16个通气单元风速测定值Table 1 Velocity of 16 measure points in cultivation area at different fan rotation rates
由表 1可知,在同一风机转速下,试验所在栽培区内不同位置的通气单元间风速差异不大;在试验转速范围内,随着风机转速增加,通气单元风速呈上升趋势,且不同转速下各通气单元通风均匀,即RV最低到最高转速均可有效提升通风均匀性,可选用1 300和2 700 r/min分别作为LCRV与HIRV转速设定值。这是由于试验所用风机流量(0.92 m3/min)大于作为风道的空气层体积(0.19 m3),当风机运行时在空气层中建立了2 mm H2O正压,不同通气单元风速不受其所在位置影响,实现了高度的通风均匀性。已有研究表明,植物工厂内冠层上部风速最好维持在0.3~1.0 m/s[27],本研究中各通气单元平均风速仅为0.051~0.11 m/s,小于前述研究数据。其原因为前述研究推荐的风速值为冠层上部风速,而本研究测定的风速为冠层下部风速。在叶面冠层边界层阻力作用下,冠层下部风速会出现明显的降低(图4)[18]。

图4 边界层阻力作用下冠层下部和上部风速差异[18]Fig.4 Velocity differences between canopy and internal canopy under boundary layer resistance
2.2 根际通风对空气层的影响及分析
根际通风依靠营养液和栽培板间的空气层作为气流通道,故该通风模式对空气层的环境产生了直接影响。图 5为 RV和 CEC空气层温湿度变化(2017-12-16-2017-12-17)。

图5 不同处理空气层温湿度变化(2017-12-16-2017-12-17)Fig.5 Variations of interlayer air temperatures and relative humidity of three treatments (2017-12-16-2017-12-17)
由图 5可知,植物工厂环境光暗期平均温度分别为23.48和21.67 ℃。在此环境条件下,CEC空气层光暗期平均温度分别为 22.08和20.65 ℃;LCRV分别为19.41和18.13°C;HIRV分别为20.16和18.91 ℃。由此可见,CEC光暗期空气层温度低于环境温度 1.4和 1.02 ℃;LCRV处理温度降低更为明显,光暗期最大降幅达到了4.07和3.54 ℃,较CEC降低2.67和2.52 ℃。变化幅度方面,CEC和LCRV波动较小,幅度为0.5 ℃,HIRV变化幅度最为突出,风机运行时,温度在40 min内可降低1.57 ℃,风机停止的40 min内,温度能够回升1.71 ℃。
植物工厂环境中实际光暗期平均相对湿度分别为66.99%和67.88%。在此环境条件下,CEC光暗期平均相对湿度最高,分别达到 100%和 97.27%;LCRV分别为96.22%和 92.43%;HIRV光暗期平均相对湿度最低,分别为90.27%和89.75%。
由上述数据可以看出,在栽培槽及栽培板的遮光及营养液蒸发吸热作用下,空气层温度均低于环境温度;在RV作用下,空气层内气体流速加快,LCRV与HIRV均能产生可观的蒸发降温效果,使空气层温度达到一个较低的水平。LCRV降温效果更好,平均温度较环境降低2.52 ℃以上。HIRV暂停时空气层温度迅速回升,其原因是由于试验所用PVC营养液槽保温性较差,外部环境热量向槽体内传导引起的。
与温度变化相比,空气层内相对湿度随光暗期的变化不明显,空气层温度的变化对湿度也未产生影响;因为空气层下部就是营养液,在液面蒸发作用下,CEC相对湿度在光期时能够达到100%;RV中,相对湿度较CEC有了较大幅度的降低,但仍然高于环境湿度,可见RV在有效地排出已有水分的同时,还会促进营养液蒸发,并最终稳定在某一相对湿度下;HIRV风机工作时,最低湿度与平均相对湿度均低于LCRV,即空气层风速(流量)对相对湿度影响较大,大风速更有利于空气层内湿度的排出。
图6表示的是RV和CEC空气层中CO2浓度的变化情况(2017-12-19)。

图6 不同处理空气层CO2浓度变化(2017-12-19)Fig.6 Variations of interlayer air CO2 concentration of three treatments (2017-12-19)
由图6可以看出,各处理和对照CO2浓度处于同一水平。其中,光期 CO2浓度均呈现出先上升后下降的趋势,暗期则呈下降趋势;HIRV的CO2浓度波动最大,风机开启后,CO2浓度在 3 min内能够从峰值下降约300×10-6至低谷并持续,风机停止后,低水平的CO2浓度仍将保持15 min,然后在35 min内回升至原水平。
由此可知,LCRV和CEC空气层内CO2浓度没有差异,其原因可能是由于 CO2在此试验温度下的营养液中溶解度较大(分别为0.902和0.829 mL/mL,远高于氧气的0.031 mL/mL[29]),加之根系的大部分浸泡在营养液中,植物根系生理活动释放的 CO2首先会向营养液中溶解并均匀释放,导致空气层中 CO2浓度变化得到缓冲。光暗期 CO2浓度表现出的变化趋势是由于根系呼吸随光环境变化导致的,当光源打开后,温度上升,植物开始进行光合作用,此时根系活动加剧,呼吸增强,CO2浓度上升,进入暗期后,光源关闭,温度下降,光合作用停止,根系活力也随之降低,但由于大部分根系浸没在营养液中,释放的 CO2需经一定时间方能移动到空气层中,故而其变化趋势呈现出一定的滞后性,表现为光期先上升后下降;值得注意的是,在HIRV中,平均CO2浓度在间歇期能够高于其他处理 200×10-6以上,其原因可能是较高的流速(流量)能够促进根系呼吸,释放更多的 CO2,同时可以加快营养液的扰动,引起二氧化碳-水体系远离原有静态溶解平衡,促使溶解在水中的CO2释放[30]。
2.3 根际通风对冠层下部的影响及分析
气流经空气层流动后,通过各通气单元预留的 8个通气孔向上流动至栽培板上的植物冠层下部及上部,对植物周围空气的温湿度、CO2浓度产生影响。首先受到影响的是靠近通气孔的冠层下部,其温湿度变化(2017-12-19 00:00-2017-12-20 00:00)如图7所示。

图7 不同处理冠层下部温湿度变化(2017-12-19-2017-12-20)Fig.7 Variations of internal canopy temperatures and relative humidity of three treatments (2017-12-19-2017-12-20)
其中,CEC光暗期平均温度分别为21.78和20.87 ℃,LCRV相应数据为20.01和18.93 ℃,HIRV分别为20.41和19.19 ℃,此时环境中光暗期平均温度分别为23.48和21.67 ℃。经分析,CEC比环境光暗期平均温度分别降低1.7和0.8 ℃;降温效果最佳的LCRV光暗期平均温度较环境下降 3.47和 2.74 ℃,比 HIRV相应数据低 0.4和0.26 ℃。值得注意的是,RV和CEC的波动幅度较空气层(图 5a)明显减小。相对湿度方面,LCRV光暗期平均相对湿度分别为 87.37%和 85.31%;HIRV分别为86.98%和87.42%,CEC为94.55%和93.32%,与环境平均相对湿度光期66.99%,暗期67.88%相比均有大幅提升,CEC提升最为明显,较环境提高27.56%。
由上述数据可以看出,RV和CEC冠层下部温度均低于环境,LCRV降温作用更为明显。CEC温度的降低是由上方冠层的遮盖使部分热辐射不能到达冠层下部,以及植物蒸腾降温作用导致的。在相同条件下,RV特有的根际通风使通气孔吹出的空气在营养液蒸发降温作用下得到了一定程度的冷却,使温度进一步降低。RV和CEC冠层下部相对湿度均大幅高于环境,这是由于冠层下部叶片密集,植物蒸腾产生的水汽无法及时排出导致的,这可能引起叶片蒸腾速率降低,诱发真菌病害,叶片坏死,元素缺乏症及软薄叶片等症状[31-36],已有研究表明多种叶菜的烧心病也由此引起[16,37]。这一现象在RV中得到缓解,湿度较CEC有一定程度降低,这是因为自下而上的通风模式有利于内部气体的流通;同样的,风速(流量)对相对湿度的降低起到了重要作用,HIRV风机运行时,能够使相对湿度降至约75%,效果好于LCRV。
图 8为不同处理冠层下部 CO2浓度变化情况(2017-12-19 12:00-2017-12-21 12:00)。
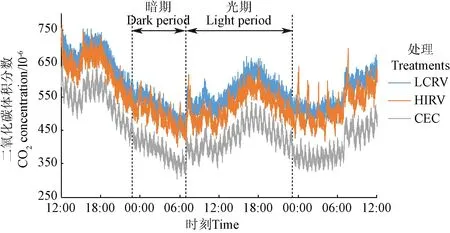
图8 不同处理冠层下部CO2浓度变化(2017-12-19 12:00-2017-12-21 12:00)Fig.8 Variations of internal canopy CO2 concentration of three treatments (2017-12-19 12:00-2017-12-21 12:00)
由图8可知,不论何时LCRV的CO2浓度最高,HIRV次之,CEC最低。其中,LCRV光期最高平均CO2浓度为 617×10-6,暗期最低平均 CO2浓度为464×10-6;HIRV光期最高平均 CO2浓度为 581×10-6,暗期最低平均 CO2浓度为 446×10-6;CEC 相应数据分别为 478×10-6和343×10-6。这一差距产生的原因是由于植株在进行光合作用时会吸收 CO2,导致冠层周围 CO2浓度的降低;CEC受边界层阻力及叶片遮蔽作用影响,其冠层下部通气受阻,CO2浓度得不到及时补充,引起 CO2浓度下降;在RV作用下,能够将外界及根系呼吸产生的CO2输送至冠层下部,较CEC提高139×10-6,在一定程度上保证光合作用的顺利进行。
2.4 根际通风对冠层上部的影响及分析
图 9为叶面冠层上部温湿度在不同处理影响下的变化特征(2017-12-18 00:00-2017-12-20 00:00)。
其中,LCRV光暗期平均温度分别为 22.73和21.06 ℃,HIRV分别为23.22和21.87 ℃,CEC相应数据为23.82和22.51 ℃;此时环境中光暗期平均温度分别为23.48和21.67 ℃。对比发现,CEC冠层上部光暗期平均温度均高于环境温度,差距达到0.3和0.84 ℃;HIRV温度略有下降,光期已经低于环境温度0.26 ℃;LCRV温度最低,光暗期平均温度均低于环境温度,温差达到0.75和0.61 ℃。相对湿度方面,LCRV光暗期平均相对湿度分别为82.83%和83.68%;HIRV分别为72.92%和73.16%,CEC为 68.39%和 67.95%,与环境平均相对湿度光期66.99%,暗期67.88%相比,LCRV和HIRV均有大幅提升,数值最高的LCRV较环境提高15.8%,CEC变化则较小。

图9 不同处理叶面冠层上部温湿度变化(2017-12-18-2017-12-20)Fig.9 Variations of canopy temperatures and relative humidity of three treatments (2017-12-18-2017-12-20)
由上述分析可以看出,RV能够降低作物冠层上部的温度,但其温度降低幅度普遍较小,均未超过1°C。其原因是经通气孔吹出的空气虽然经通过营养液的蒸发降温作用下得到冷却,对冠层产生了一定程度的影响,但因为冠层距栽培板通气孔较远,整体上仍主要受外界环境调控,RV对此处环境调控作用有限。CEC冠层上部光期平均温度的升高主要由光期人工光源散热[38]导致植物周围区域热负荷的增加引起的,若采用荧光灯等光源会进一步加大升温现象;暗期的升温则可能来自于植物生理代谢产热[39]。上述现象表明,植物工厂空间环境参数与植物周围的微环境参数存在较大差别,以空间环境参数为依据的CEC并未充分考虑植物对自身微环境尤其是密集区域温湿度的影响。甚至在以环境模型[40],自动栽培系统[41]及节能管理系统[42-43]为对象的研究中,也未充分考虑植物微环境与空间环境的差异,均采用空间环境参数替代微环境参数。此外,LCRV温度低于HIRV,其原因是由于栽培系统本身并不具备蓄冷作用,更高的流速(流量)也不能在短时间内使系统内温度下降很多,一旦停止通风,外界热量会立刻通过辐射、传导等方式进入,故需要连续不断地通风才能维持一个较低的温度,且这一过程受风机转速的影响较小。经过营养液面上方后,气流中水分含量增加,是RV中冠层上方相对湿度增加的主要原因,此外,植物蒸腾过程中的高湿气体在自下而上的气流中被整体抬升也是不可忽视的。
2.5 根际通风对营养液温度及溶解氧浓度的影响及分析
根际通风以营养液及栽培板间的空气夹层作为气流通道,对营养液的参数产生直接影响。图10为不同处理下营养液温度及溶解氧浓度变化情况(2017-12-15 17:00-2017-12-21 12:00)。

图10 不同处理营养液温度及溶解氧浓度变化(2017-12-15 17:00-2017-12-21 12:00)Fig.10 Variations of nutrient solution temperature and dissolved oxygen concentration of three treatments(2017-12-15 17:00-2017-12-21 12:00)
各处理随光暗期交替表现出明显的变化规律, RV均低于CEC。其中,LCRV光暗期平均液温分别为18.94和17.63 ℃,HIRV分别为19.75和18.43 ℃,CEC对应数据分别为22.52和21.66 ℃。LCRV光暗期平均液温最低,CEC最高,二者光暗期平均液温分别相差 3.58和4.03 ℃;HIRV温度变化幅度最大。随着时间增长,各处理溶解氧含量均呈下降趋势,在一周内,LCRV和 CEC溶解氧含量由新鲜配制营养液约4.6下降至约1.8 mg/L;其中,CEC溶解氧在前期下降速率很快,当试验开始2 d后已降至2.8 mg/L,同期RV溶解氧数值为3.8 mg/L;在试验后期,LCRV与 CEC溶解氧处于相同水平;HIRV在试验开始2 d内与其他处理保持相似的下降幅度,2 d后降至3.8 mg/L,此后下降趋势明显趋缓,并将这一溶解氧含量保持至试验结束;此外,在试验前期溶解氧浓度较高时,RV处理未显示出明显的随光暗期交替变化的趋势,当溶解氧质量浓度降至3.8 mg/L时方展现出随光暗期交替变化的特征,CEC这一现象出现的更晚,试验开始4 d后溶解氧降至2.4 mg/L时才显示出来。
由上述结果可知,各处理光暗期营养液温度均相差1 ℃左右,且随光暗期交替呈现出相应的变化;CEC液温较RV高3.58到4.03 ℃,大量文献表明根际温度高不利于植物生长,Benlloch-Gonzalez等[44]的报道中指出当作物根际温度较高时,可消除高二氧化碳浓度对根系的生长促进作用。Fukuoka和Enomoto[45]试验表明根际温度高可导致萝卜褐根病发生。RV能够降低营养液温度,是由于该模式增加了营养液表面的空气流动速度,促进了营养液蒸发降温,LCRV降温效果更佳。新鲜配制的营养液注入到栽培系统中后,其溶解氧含量快速下降,CEC中降幅更为明显,这主要是由于氧气直接向大气扩散导致的,有文献表明,营养液从储液池运输至栽培槽内,溶解氧就会降低 67%[46];植物根系呼吸也是造成这一现象的原因之一,这会对根系呼吸[47],养分摄取[48]及病原体防治[49]造成负面影响。由于RV中营养液温度大幅降低,这在一定程度上增加了其溶解氧饱和度,加之RV所用风机流量远大于栽培槽空气层体积,使空气层能够维持约2 mm H2O的正压,营养液层上方的氧分压也相应提高,更有助于空气中的氧气向营养液溶入。HIRV下溶解氧含量经历了短暂快速的下降后呈现出相对稳定的状态没有继续下降,这可能是由于较大的风速增加了营养液的扰动,促进了氧气向营养液中溶入,保证了溶解氧的稳定。随着溶解氧含量的降低,其随光暗期温度变化的特征逐渐明显,这可能是由于溶解氧含量的下降速率远高于由液温降低促进氧溶入的部分,这一下降趋势平缓后溶解氧随液温下降升高的趋势才逐渐清晰。值得注意的是,本次试验观察到RV会加速营养液的蒸发消耗,这会导致其浓度上升,对蔬菜栽培产生潜在影响。在常规栽培过程中,营养液会定期循环并根据在线监测结果补充清水或营养元素。通风导致的营养液浓度变化在这一过程中能够得到很好地解决,不会对植物生长产生不良影响。
上述结果表明,根际通风使地上部及地下部环境参数产生较大变化。这些变化会在多大程度上对植物生长造成何种影响尚不清楚,在今后的工作中,需要进一步完善根际通风系统运行模式,通过植物栽培试验及能耗监测,优化其运行参数,逐步降低植物工厂对大环境温控系统的依赖,实现大幅节约空调能耗的目标。
3 结 论
针对现有植物工厂内各处通风调温不均的问题,本研究提出了以营养液及栽培板间的空气层作为气流通道的根际通风系统,并对低速连续(LCRV)、高速间歇(HIRV)及传统环控方式(CEC)对植株地上部与地下部环境参数的影响进行了测试分析,得出以下结论:
1)传统环控方式冠层上部温度高于植物工厂环境温度 0.84 ℃,以后者作为依据调控作物栽培区温度不够准确,需要进一步降低环境温度设定值以满足植物冠层温度,这将进一步加大空调制冷量,增加能耗。
2)根际通风可以有效打破植物侧向通风阻挡,克服冠层边界阻力,提供冠层下部0.051~0.11 m/s的风速,且各通气单元风速均匀。在此作用下,冠层上部和下部温度分别降低0.75和3.47℃。当根际通风开启时,可以适当提高植物工厂环境设定温度,减少空调制冷量和启动次数,节约大量电能。
3)根际通风能够调控根际环境,与传统通风模式相比空气层和营养液温度分别降低2.67和4.03 ℃。同时可减缓溶解氧下降速率,试验结束时营养液中溶解氧浓度较传统环控方式高2.0 mg/L,对植物生长具有潜在的正面作用。
综上,本文提出的根际通风调温技术能够针对各栽培单元进行分布式通风,打破植物侧向通风阻挡,克服冠层边界阻力,直接调节植物生长区微环境,提高植物工厂通风控温均匀性和效率,同时具有结构简单成本低的特点。在未来的植物工厂技术更新中,此类针对局部栽培区进行精准微环境调控的技术将取代现有通风模式在植物工厂中得到广泛应用。
