动脉粥样硬化斑块中TNF-α的表达与斑块稳定性的关系
2019-05-21刘清霞张宏颖徐利霞姜辉韩新生
刘清霞,张宏颖,徐利霞,姜辉,韩新生
随着人口老龄化的发展,心脑血管疾病已成为威胁人们生命健康的主要疾病,其发病率和死亡率常年居高不下[1]。动脉粥样硬化是动脉硬化血管病中最常见的一种,也是引起严重心脑血管疾病的主要原因之一,其真正的病因及发病机制目前仍不明确[2]。医学研究表明[3],动脉粥样硬化的基本病变为脂质在动脉血管内膜进行沉积,引发血管内膜发生灶状纤维化改变,使动脉弹性降低,出现粥样斑块,造成动脉管腔变窄,管壁增厚变硬,从而引发冠状动脉粥样硬化性心脏病(冠心病)、脑梗塞等心脑血管疾病,严重时可导致患者死亡。据统计,全世界每年平均超过1900万人突发急性心脑血管疾病死亡,在一些发达国家,由动脉粥样硬化为主引起的心脑血管疾病死亡率已经超过癌症。长久以来,动脉粥样硬化的预防与治疗一直被医学界所重视。肿瘤坏死因子α(TNF-α)是介导人体免疫反应与炎症反应的重要炎性细胞因子,主要由活化的单核巨噬细胞分泌,与多种疾病的发生有关[4]。本研究为了分析动脉粥样硬化斑块中TNF-α的表达与斑块稳定性的关系,特对郑州市第二人民医院收治的80例患者进行分析,现报告如下。
1 资料与方法
1.1 研究对象选取2014年2月至2017年3月于郑州市第二人民医院行手术治疗的冠状动脉(冠脉)粥样硬化患者80例,其中冠脉支架植入术12例,冠脉血栓抽吸术17例,起搏器置入术15例,射频消融术11例,先心病室间隔缺损10例、房间隔缺损封堵术15例,术中均获取患者冠状动脉粥样硬化斑块标本(部分斑块),其中男性63例,女性17例;年龄45~82(58.7±2.5)岁,病程2~7年,平均病程(4.1±1.5)年。本组所有患者均经过X线、超声以及动脉造影诊断为动脉粥样硬化。排除标准:①不符合纳入标准者;②存在严重肝肾功能不全、血液系统疾病以及恶性肿瘤患者;③患者临床资料不全;④不愿接受调查及临床试验者。
1.2 主要仪器与试剂①低温超速离心机(EVOLUTION TMKC,美国制造)。②微波炉(型号:HWL09PA,杭州耀博生物科技有限公司)。③鼠抗人单核巨噬细胞 CD68 单克隆抗体(即用型)(型号:fs-Y1166,上海抚生实业有限公司)。④鼠抗人平滑肌细胞α-actin单克隆抗体(即用型)(型号:LOP1055上海酶联生物研究所)。⑤兔抗人TNF-α多克隆抗体(浓缩型,工作浓度为 1:200)(武汉博士德生物技术有限公司)。⑥SP试剂盒(北京北瑞达医药科技有限公司)。⑦浓缩型DAB 试剂盒(上海信裕生物科技有限公司)。
1.3 试验方法
1.3.1 切片及染色通过手术获取患者冠脉粥样硬化斑块标本,使用10%浓度福尔马林溶液对选定的冠脉标本进行常规固定,对冠脉标本的左主干、左前降支、左旋支以及右侧做间隔为1 cm的连续取材,经脱水、透明、浸蜡以及石蜡包埋等一系列处理后进行连续切片,切片厚度为4μm,最后将冠状动脉标本切片放入二甲苯以及不同浓度酒精溶液中进行常规脱蜡和水化处理。对处理后的冠脉标本切片进行HE和EVG染色,部分切片水化后进行免疫组织化学染色。
1.3.2 分组使用显微图像分析系统(Imagepro-Plus 6.0),分别对标本斑块面积和脂质坏死中心面积进行测量。参照病史、显微镜观察结果以及EVG 染色血管组织学形态特点,结合HE染色结果,病理特征,根据冠状动脉粥样硬化斑块的组织学病理学特征将标本分为正常对照组(21例)、稳定斑块组(28例)和不稳定板块组(31例),其中斑块评定标准参照文献[5]进行判定:稳定斑块组:主要病变为纤维结缔组织,纤维帽厚或斑块内膜增厚,不存在脂质坏死中心或脂质坏死中心占斑块大小的40%以下。不稳定斑块组:纤维帽较薄,存在大的偏心性脂质坏死中心占斑块的40%以上。
1.3.3 免疫组织化学检测①将冠状动脉石蜡切片放入60~65℃的烤箱中烘烤2~3 h。②使用不同浓度的酒精溶液对烤好的冠状动脉石蜡切片进行水化处理,然后使用二甲苯进行脱蜡,使用流水冲洗10 min,使用PBS冲洗3次,每次3 min,擦干。③为防止内源性过氧化物酶发生作用,在室温下,3%浓度的过氧化氢去离子水进行孵育10 min,PBS冲洗3次,每次3 min,擦干。④使用枸橼酸微波热修复对抗原进行修复,时间为15 min,使抗原暴露。⑤完成抗原修复后,在自然环境下使冠状动脉切片降至室温,重复PBS冲洗3次,每次3 min,擦干。⑥室温状态下加入5%小牛血清蛋白,作用是封闭非特异性抗体20 min。⑦倾去小牛血清,将标本切片擦干,分别加入稀释后的一抗,放入4℃冰箱中过夜(约18 h)。⑧将标本切片预热15 min,重复PBS冲洗3次,每次3 min。⑨在室温条件下加入生物素化的二抗,孵育15 min,重复PBS冲洗3次,每次3 min。⑩室温下进行链霉素抗生物素蛋白-过氧化酶湿盒孵育15 min,重复PBS冲洗3次,每次3 min。⑪使用DAB溶液进行显色处理,流水冲洗后使用苏木素进行染色,后逐级脱水,二甲苯进行透明处理,使用中性树胶封片。
1.4 结果判定巨噬细胞判定:CD-68染色结果呈阳性的细胞为巨噬细胞,平滑肌细胞判定:α-actin染色结果呈阳性的细胞为平滑肌细胞。肿瘤坏死因子α(TNF-α)的判定方法参照许良忠等《免疫组织化学反应结果的判断标准》[6]中对免疫组织化学反应结果的判定标准,综合分析切片中阳性细胞占所观察同类别细胞数的百分比以阳性细胞的着色强度,根据切片中阳性细胞占观察细胞总数的百分比分为4个等级:≤5%为0分;6%~25%为1分;26%~50%为2分;≥51%为3分。根据细胞染色程度判定阳性程度:基本没有着色为0分;呈淡黄色为1分;呈黄棕色为2分;呈棕褐色为3分.将每张切片着色细胞百分比得分与着色程度得分相乘得出最终得分。0~1分为阴性(-);2~3分为弱阳性(+);4~6分为中等阳性(++);6分以上为强阳性(+++)。
1.5 统计数据分析使用软件SPSS 14.0对所得数据进行统计处理分析。计数资料采用百分数(%)表示,组间比较采用χ2检验;计量资料采用均数±标准差(±s)表示,组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 巨噬细胞表达情况正常对照组中CD68几乎没有表达,阳性率为0%;在稳定斑块组表达强度为(- ~+++),阳性率为60.71%;不稳定斑块组表达强度为(-~+++),阳性率为96.77%;稳定斑块组与不稳定斑块组CD68阳性率相比差异有统计学意义(P<0.05);两组阳性率分别与正常对照组相比差异均比较明显(P<0.05)(表1)。
2.2 平滑肌细胞表达情况正常对照组中平滑肌细胞表达均为强阳性(+++),阳性率100%;稳定斑块组中表达强度为(-~+++),阳性率为53.57%;不稳定斑块组表达强度为(-~+++),阳性率为9.68%;稳定斑块组与不稳定斑块组α-actin阳性率相比差异有统计学意义(P<0.05);两组阳性率分别与正常对照组相比差异均比较明显(P<0.05)(表2)。
2.3 TNF-α在冠脉内膜的表达情况TNF-α在正常对照组内膜无表达,阳性率为0%;TNF-α在病变冠脉中表达增强,稳定斑块组中表达强度为(-~+++),阳性率为64.28%;不稳定斑块组表达强度为(-~+++),阳性率为93.54%;稳定斑块组与不稳定斑块组α-actin阳性率相比差异有统计学意义(P<0.05);两组阳性率分别与正常对照组相比差异均比较明显(P<0.05,表3)。
2.4 TNF-α在冠脉中膜的表达情况正常对照组中膜无TNF-α的表达,阳性率为0%;稳定斑块组中表达强度为(-~+++),阳性率为28.57%;不稳定斑块组表达强度为(-~+++),阳性率为61.29%;稳定斑块组与不稳定斑块组α-actin阳性率相比差异有统计学意义(P<0.05);两组阳性率分别与正常对照组相比差异均比较明显(P<0.05,表4)。
3 讨论
有研究表明[7,8],动脉粥样硬化斑块的破裂是引起一系列急性心脑血管疾病的主要因素,并且斑块的破裂几乎全部由不稳定性斑块引起,因此早期对不稳定性斑块的处理对动脉粥样硬化危险性的诊断具有重要意义。随着科学技术的发展,科学家逐渐从分子水平上对动脉粥样硬化进行更加深入的研究,一项新的研究结果表明动脉粥样硬化斑块的发生和发展,与人体的免疫反应、炎症反应以及细胞凋亡都有密切联系[9]。TNF-α是由被激活的巨噬细胞或单核细胞、淋巴细胞等产生的一种多肽,具有二聚体、三聚体或多聚体形式[10]。研究发现[11],TNF-α能与靶细胞上的上TNF-α受体相结合后发生生物学效应,在应激状态下,TNF-α可参与多种疾病的病理生理过程,可导致血栓形成,细胞凋亡,在机体的免疫调节和炎症反应中扮演着重要的角色。目前医学上广泛认为TNF-α是导致动脉内皮细胞功能絮乱、内膜增生的重要因素之一[12,13]。
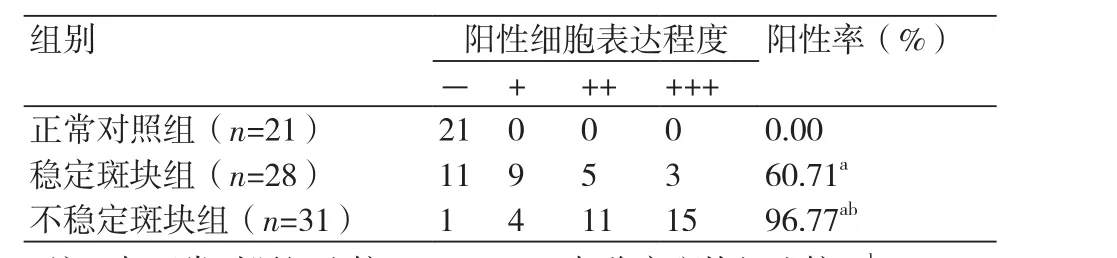
表1 CD68在三组中的表达情况
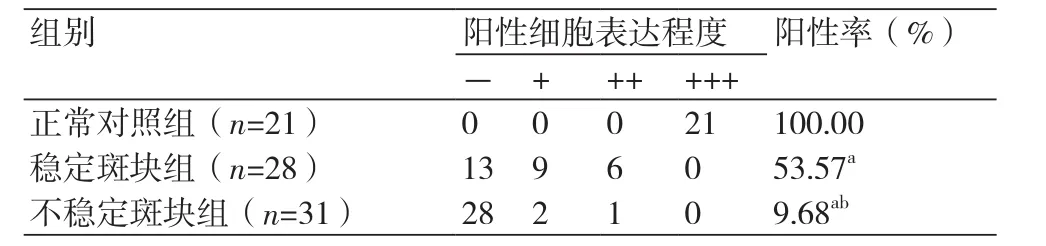
表2 α-actin在三组中的表达情况

表3 TNF-α在冠状动脉内膜的表达情况

表4 TNF-α在冠状动脉中膜的表达情况
近年来的研究发现[14],TNF-α与动脉硬化有着密切联系。TNF-α能够诱导血小板黏附,增强白细胞的趋化作用,引起病灶住址周围的细胞聚集,导致血管细胞异常增殖[15];对血管内皮细胞造成直接损伤,诱导脂质沉淀形成动脉粥样硬化斑块;导致血管炎症的发生[16]。有学者研究发现[17],TNF-α介导了动脉血管平滑肌细胞的凋亡,参与了动脉粥样硬化的进程,在对急性动脉硬化综合症患者的抗炎治疗中发现抗炎药物均能降低TNF-α的水平,由此可以推断TNF-α与动脉粥样硬化斑块的炎症有关。本次研究表明,正常人的动脉组织中没有TNF-α的表达,而病变动脉组织斑块中TNF-α的表达增强,主要表达于CD68、α-actin细胞中,不稳定斑块的内膜与中膜TNF-α的表达相对较高,且内膜表达强于中膜。
综上所述,在正常动脉组织中没有TNF-α的表达,在动脉粥样硬化斑块中存在TNF-α的表达,可推测TNF-α的表达能促进动脉粥样硬化斑块的不稳定性,是动脉粥样硬化病变形成和发展的重要因素之一。
