PCR检测痰曲霉菌在慢性阻塞性肺疾病合并侵袭性肺曲霉菌病中的诊断价值
2019-05-21严梦楠宋一祎李华茵
王 琴, 严梦楠, 宋一祎, 李华茵
复旦大学附属中山医院呼吸内科,上海 200032
侵袭性肺曲霉菌病(invasive pulmonary aspergillosis, IPA)是严重的机会性感染性疾病,多见于免疫抑制宿主,如血液系统恶性肿瘤、器官移植患者。尽管广谱抗真菌药物不断发展,IPA患者死亡率还是居高不下[1]。近年来,非粒细胞缺乏患者中IPA的报道越来越多,如慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)患者[2-3]。Guinea等[4]发现,约1.63%的住院COPD患者下呼吸道分泌物中可分离出曲霉菌,其中约22.1%拟诊IPA。COPD住院患者继发IPA多与系统性应用糖皮质激素、广谱抗生素及机械通气相关。
2007年,Bulpa等[3]提出COPD患者IPA的诊断标准,分为确诊、拟诊、疑诊和定植。其中,确诊有赖于组织病理学检查;拟诊患者要求临床依据(COPD患者近期因急性加重住院,胸部影像学提示曲霉菌感染,对常规抗感染治疗无反应)和病原学依据[下呼吸道分泌物分离出曲霉菌或者连续2次血清半乳甘露聚糖(GM)实验阳性];疑诊患者缺乏病原微生物依据;定植为患者缺乏临床表现但下呼吸道分泌物分离出曲霉菌。2016年美国感染病学会(Infectious Diseases Society of America, IDSA)更新了曲霉菌病诊治指南,强调分子生物学技术的诊断价值[5]。
大部分COPD住院患者因肺功能差、喘息、机械通气等原因,不能耐受气管镜、经皮肺活检等有创性检查,确诊IPA困难。常规的痰液培养方法耗时长、阳性率低,不能为快速诊断提供帮助。而分子生物学技术,如荧光定量PCR,具有灵敏度高、特异性强、快速检测的特点,可为临床快速诊断提供重要帮助。因此,本研究采用前瞻性观察性研究,通过收集住院COPD患者的痰液,多重荧光定量PCR检测方法检测其中的曲霉菌,探索PCR检测痰液曲霉菌在COPD患者合并IPA中的诊断价值。
1 资料与方法
1.1 一般资料 入选标准:入选2015年4月至2017年3月因COPD急性加重入住复旦大学附属中山医院的患者,其均有常规痰液真菌培养标本。本研究通过复旦大学附属中山医院伦理委员会审批(批件号码:B2016-104)。由于收集患者常规痰曲霉菌培养剩余的痰液为无创伤性,故免签署患者知情同意书。排除标准:COPD仅作为次要诊断的住院患者。收集患者的一般资料,真菌感染危险因素(糖皮质激素使用情况、广谱抗生素使用情况、机械通气等),临床症状,影像学表现,病原学检查结果,血清半乳甘露聚糖(GM)实验结果,血清1,3-β-D葡聚糖(G)实验结果。
1.2 PCR法检测痰液曲霉菌 收集患者常规痰真菌培养后剩余痰液,放置于无菌痰杯中,进行DNA提取及多重荧光定量PCR检测。检测步骤按照试剂盒说明书(翔琼生物)进行。
1.2.1 DNA抽提 取200 μL痰液,置于1.5 mL离心管,加入5倍体积的试剂A,振荡30 s,室温放置20 min;12 000 r/min(r=6 cm)离心5 min,弃上清,沉淀用1 000 μL 试剂B充分悬浮,12 000 r/min(r=6 cm),离心5 min,小心弃除上清,留沉淀;沉淀加25 μL试剂C和25 μL试剂D,充分悬浮,振荡15 s;将离心管置于水浴锅,37℃,60 min;离心管置于水浴锅,80℃,15 min;取出离心管,6 000 r/min(r=6 cm),离心5 min;取1 μL上清作为PCR模板。
1.2.2 PCR反应 配制20 μL PCR反应体系:2×Taqman酶反应液10 μL,3.3×烟曲霉检测反应液6 μL,DNA模板或阴(阳)性对照品1 μL,无菌水3 μL。将反应液混匀,2 000 r/min(r=6 cm)离心15 s,使所加试剂聚集到管底;PCR扩增。将PCR反应板放入荧光定量PCR仪器中,反应条件:95℃ 10 min;95℃ 15 s,60℃ 60 s,40个循环。信号收集:第2阶段60℃时收集荧光基团FAM,参比荧光为ROX。
1.2.3 结果质控 阴性对照的Ct值均应等于40;阳性对照的Ct值应小于或等于35,并有较好的对数增长曲线。否则,视为此次实验无效。结果判读:被检样品的Ct值小于35并有对数增长曲线为阳性结果;被检样品的Ct值等于35时,有对数生长曲线为阳性,无对数生长曲线为阴性结果;被检样品的Ct值大于35时,无对数生长曲线为阴性,有较好的对数生长曲线时加大样本量重做,重做结果同前,则判为阳性,否则为阴性。
1.3 诊断标准 参照2008年欧洲癌症研究和治疗组织(European Organization for Research and Treatment of Cancer, EORTC)/真菌病研究组(Mycoses Study Group, MSG;EORTC/MSG)和2016年IDSA曲霉病诊断临床实践指南,将曲霉菌病分为确诊、拟诊和疑诊。确诊需要组织病理学依据或正常无菌部位标本曲霉菌培养阳性;拟诊患者需符合1项宿主因素、1项临床依据和1项微生物学标准;疑诊患者须符合1项宿主因素和1项临床依据,而缺乏生物学标准。
1.4 统计学处理 采用SPSS 22.0统计软件进行分析,符合正态性和方差齐性的计量资料采用t检验,计数资料采用χ2检验或Fisher确切概率法检验。检验水准(α)为0.05。
2 结 果
2.1 一般资料 49例COPD患者中,18例诊断为IPA,其中确诊4例、临床诊断(拟诊+疑诊)14例。合并IPA的COPD组患者系统应用糖皮质激素和广谱抗生素比例高于不合并组(表1)。
2.2 临床特征对比 结果(表2)表明:与不合并IPA组患者相比,合并IPA组COPD患者发热更常见;两组呼吸系统症状差异无统计学意义。合并IPA组患者胸部CT结节、空洞更多见,不合并IPA组患者胸部CT多无特殊阳性发现。
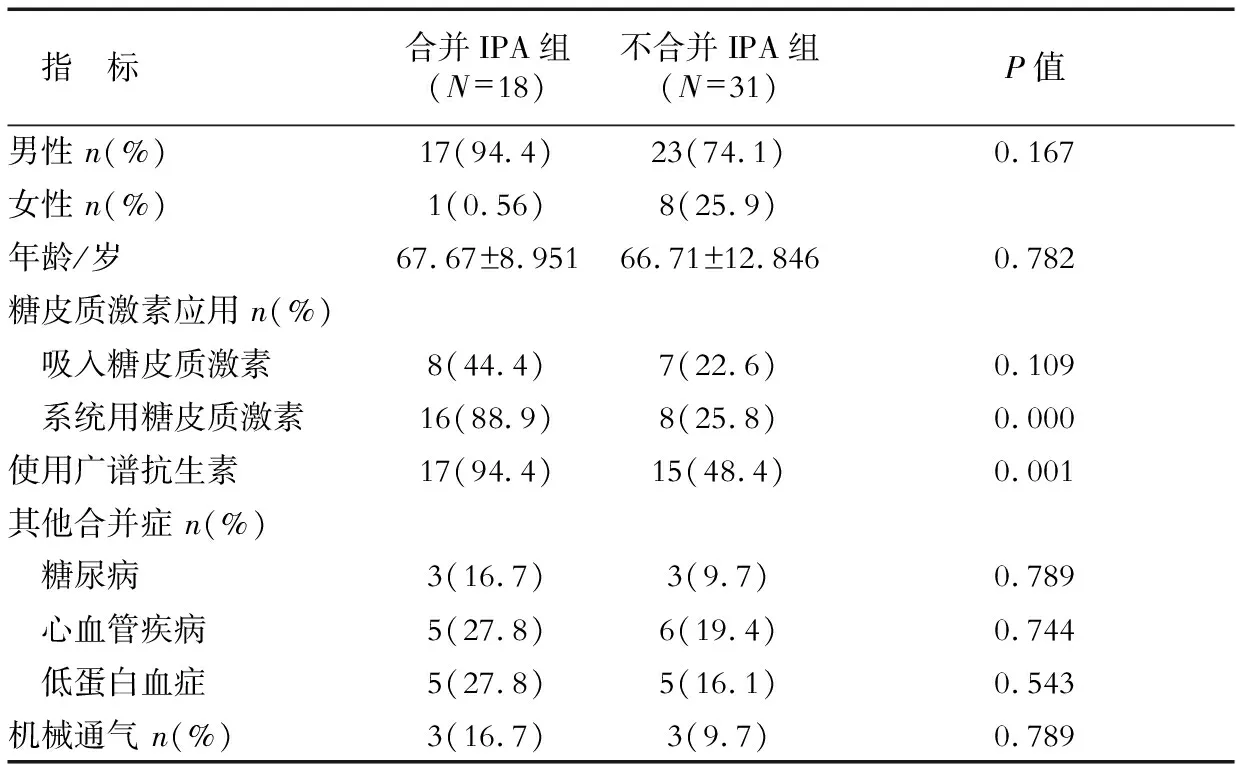
表1 COPD住院患者的一般资料
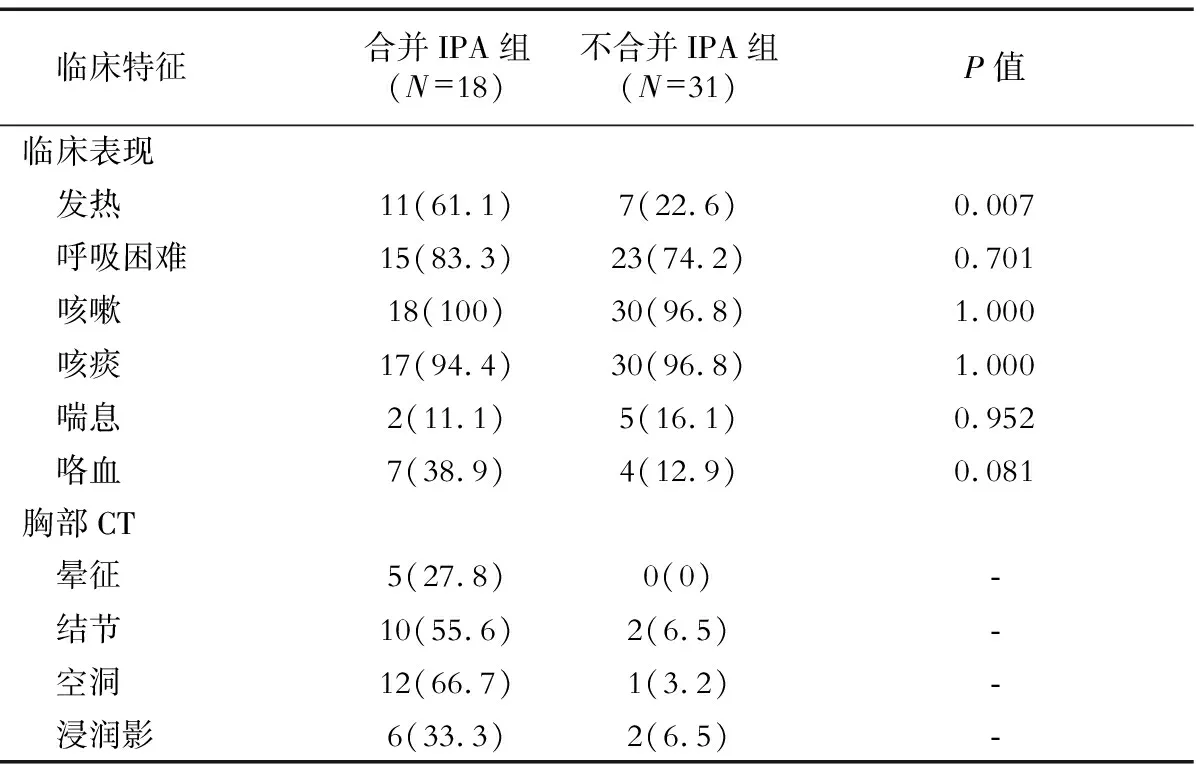
表2 两组患者临床特征的对比
2.3 病原学检查结果
2.3.1 G和GM检测 18例合并IPA的COPD患者中,15例患者进行了血清G实验,其中阳性2例、阴性13例;31例不合并IPA的COPD患者中,18例检测了血清G实验,阳性8例、阴性10例。血清G实验对于COPD患者IPA诊断的敏感性和特异性分别为13.3%(95%CI 2.3~41.6)、55.5%(95%CI 31.3~77.5),阳性预测值和阴性预测值分别为20%(95%CI 3.5~55.7)、43.4%(95%CI 23.8~65.1)。49例患者中仅7例患者进行了血清GM实验,病例数太少,未进一步计算GM实验对COPD患者IPA诊断的敏感性及特异性。
2.3.2 痰曲霉菌培养 49例患者均进行了痰液曲霉菌培养检测。18例合并IPA的COPD患者中,阳性6例、阴性12例。31例不合并IPA的COPD患者中,阳性2例、阴性29例。痰液真菌培养诊断COPD患者IPA的敏感性及特异性分别为33.3%(95%CI 14.3~58.8)和93.5%(95%CI 77.1~98.8),阳性预测值和阴性预测值分别为75%(95%CI 35.5~95.5)和70.7%(95%CI 54.2~83.3)。
2.3.3 荧光定量PCR检测痰曲霉菌 49例患者均进行痰液荧光定量PCR以检测曲霉菌。18例合并IPA的COPD患者中,阳性13例、阴性5例。31例不合并IPA的COPD患者中,阳性4例、阴性27例。荧光定量PCR检测痰液中曲霉菌诊断COPD患者合并IPA的敏感性及特异性分别为72.2%(95%CI 46.4~89.2)和87.1%(95%CI 69.2~95.7),阳性预测值和阴性预测值分别为76.5%(95%CI 49.8~92.2)和84.4%(95%CI 66.4~94.1)。
3 讨 论
COPD患者IPA的发生率报道并不一致,为1%~9%[4,6-7]。全身应用糖皮质激素在住院COPD患者发生IPA中有促进作用。研究[5]发现,应用强的松日剂量大于20 mg或累计剂量大于700 mg的患者IPA的风险显著增加;亦有研究[8]发现,长期吸入糖皮质激素增加COPD患者IPA的风险。本研究得出类似结论,在合并IPA的COPD患者中,88.9%的患者全身应用糖皮质激素;而在不合并IPA的COPD患者,仅25.8%的患者全身应用糖皮质激素。吸入糖皮质激素在两组间差异无统计学意义。其他有意义的危险因素还包括广谱抗生素的应用。而合并其他基础疾病如糖尿病、心血管疾病、低蛋白血症等在两组间差异无统计学意义。与不合并IPA的COPD患者相比,合并IPA的COPD患者临床特征以发热更常见,胸部CT以多发结节伴空洞更多见,而既往研究[3]结果提示其以浸润实变影多见,可能与本研究样本量小有关。
COPD患者合并IPA的诊断率低,组织病理学是目前最可靠的诊断方法。但因住院COPD患者肺功能差,气急明显,难以耐受气管镜及肺穿刺等有创检查,从而导致确诊率低,多依赖于临床诊断。本研究中18例诊断为IPA的患者中,仅4例患者接受了气管镜检查,得到临床确诊,其余14例均为临床诊断。病原微生物学依据在COPD患者IPA的诊断中具有至关重要的价值。1,3-β-D葡聚糖是大部分真菌细胞壁组成成分(接合菌、隐球菌除外),故其阳性并不代表一定为曲霉菌感染。G实验在诊断真菌感染中的敏感性和特异性分别为77%、85%[9]。本研究中18例患者检测了血清G实验,阳性8例、阴性10例。血清G实验对于COPD患者IPA诊断的敏感性和特异性分别为13.3%、55.5%,显著较低,可能与病例数较少、采样时间及多数患者经验性应用抗真菌药物有关。半乳甘露聚糖是曲霉菌细胞壁上的多聚抗原,与G实验相比,GM实验对曲霉菌病的诊断有较高的特异性。文献[10]报道,GM实验的敏感性和特异性分别为61%~89%和84%~95%。COPD患者肺泡灌洗液中GM实验的诊断价值与粒细胞缺乏患者血清GM实验的诊断价值相似。但本研究仅7例患者进行了GM实验,故未予进一步探讨GM实验的诊断价值。
痰液曲霉菌培养简便,易获取。在COPD患者痰液中分离出曲霉菌,尤其是反复分离获得时,需要进一步完善胸部CT检查,评估IPA的可能性。本研究所有病例均进行了痰液曲霉菌培养,痰液真菌培养对COPD患者IPA诊断的敏感性及特异性分别为33.3%、93.5%,特异性较高,但敏感性低,且痰曲霉菌培养耗时长,至少需要3 d,不利于IPA早期诊断。
荧光定量PCR检测曲霉菌方法快速、敏感性高,多在粒细胞缺乏患者中开展研究,肺泡灌洗液PCR检测的敏感性高于血清中PCR检测[11]。由于不同文献中描述的方法各不相同,缺乏统一标准,IDSA 2016年指南尚未推荐PCR检测方法常规用于临床诊断[6]。IDSA 2016指南建议临床医师根据个体情况谨慎选择PCR作为IPA的诊断。临床医师须根据PCR试剂盒的方法学和检测特点,对结果进行解读。使用PCR方法诊断IPA,应结合其他诊断方法和临床情况。目前,关于痰液PCR检测的研究较少。本研究荧光定量PCR检测痰液中的曲霉菌诊断COPD患者合并IPA的敏感性及特异性分别为72.2%、87.1%,阳性预测值和阴性预测值分别为76.5%、84.4%。敏感性显著高于常规培养方法,但特异性较痰曲霉菌培养略低,可能与检测敏感性高有关。
综上所述,COPD患者中发生IPA并不少见,多见于全身应用糖皮质激素及广谱抗生素的患者。该病确诊困难,多依赖于临床诊断,荧光定量PCR检测痰液中的曲霉菌在COPD合并IPA的诊断中的敏感性和特异性均较高,能为临床早期诊断提供重要的价值。但本研究选择的痰液标本易污染,无法区分定植与感染,且未同时检测血清及肺泡灌洗液,有待在后续研究中加以补充。
