国产硼替佐米(昕泰)治疗初治多发性骨髓瘤的初步研究
2019-05-21张怡安庄静丽王志梅王伟光季丽莉程志祥
张怡安, 庄静丽, 王志梅, 魏 征, 王伟光, 季丽莉, 程志祥, 柯 杨, 刘 澎
复旦大学附属中山医院血液科,上海 200032
多发性骨髓瘤(multiple myeloma, MM)是发病率居第2位的血液系统肿瘤[1-2]。MM发病过程中,正常浆细胞转化为骨髓瘤细胞并产生大量单克隆免疫球蛋白(M蛋白),最终导致靶器官损伤,如骨质破坏、肾功能异常、贫血及高钙血症等[2-3]。1990至2016年,全球MM的发病率增长了近1倍。仅2016年,全球就有138 509例新确诊的MM,校正年龄后的发病率为2.1/10万人。其中,MM发病率增长最快的为东亚地区[4]。
近年来,随着临床医疗新技术的应用及新药的研发,如自体干细胞移植技术[5]以及免疫调节剂(immuno-modulatory drugs, IMIDs)沙利度胺和来那度胺[6]、蛋白酶体抑制剂(proteasome inhibitors,PIs)[7-8]、单克隆抗体(daratumumab[9]、elotuzumab[10])和组蛋白去乙酰化酶抑制剂(panobinostat)[11]等,MM的治疗取得重大进展,大部分患者经积极治疗后,生存期得到明显改善。
作为一种PIs,硼替佐米(bortezomib)是目前MM一线治疗选择,但长期依赖进口,价格较昂贵。近年来,仿制的国产硼替佐米陆续上市,虽然价格低廉,但临床疗效尚未获得一致性评价,限制了其临床推广。因此,本研究对我院收治的初治MM患者采用国产硼替佐米(昕泰,豪森药业,江苏)进行治疗,初步评估其临床疗效和安全性,为其后续临床应用提供参考。
1 资料与方法
1.1 一般资料 选择2018年6月1日至2018年11月30日初次确诊的活动性MM患者。诊断标准采用国际骨髓瘤工作组的建议[12]。可评估患者为接受包含昕泰的两药(硼替佐米+地塞米松,BD)或者三药联合方案(硼替佐米+环磷酰胺+地塞米松,VCD),并至少接受2个周期治疗的患者。主要排除标准:确诊淀粉样变性;既往接受抗骨髓瘤治疗(包括放疗)。本研究经复旦大学附属中山医院伦理委员会批准,患者及家属签署知情同意书。
每例患者根据美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)MM诊疗指南[13]及《复旦大学附属中山医院多发性骨髓瘤诊疗规范》[1]完成基线数据采集,包括实验室检查、影像学检查、病理检查结果以及修正的国际分期体系(Revised International Staging System, R-ISS)等。R-ISS中细胞遗传学检测采用荧光原位杂交方法。
1.2 治疗方案 初诊MM患者经医师判断后接受BD或VCD诱导方案治疗。BD方案:昕泰 1.3 mg/m2,皮下注射,第1、8、15、22天;地塞米松40 mg,口服或静脉注射,第1、8、15、22天。VCD方案:昕泰 1.3 mg/m2,皮下注射,第1、8、15、22天;环磷酰胺,300 mg/m2,口服,第1、8、15、22天;地塞米松40 mg,口服或静脉注射,第1、8、15、22天。以上方案均28 d一疗程。合并用药:双膦酸盐预防或治疗骨病;阿昔洛韦预防性抗病毒治疗;肾功能不全者必要时行肾脏替代治疗;高钙血症紧急发生时使用降钙素;低丙种球蛋白血症患者予静脉注射丙种球蛋白;对于MM治疗后贫血改善不明显者,考虑使用促红细胞生成素。
1.3 疗效及安全性评估 采集患者基线、治疗第2周期结束后、治疗第4周期结束后血液样本及治疗24 h尿液样本,并复查骨髓穿刺涂片及骨髓活检病理。根据NCCN诊疗指南[13]及《复旦大学附属中山医院多发性骨髓瘤诊疗规范》[1]评估疗效。不良事件(adverse events, AEs)按美国国家癌症研究所常见毒性标准5.0版分级。
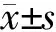
2 结 果
2.1 基线资料 共纳入符合入选标准的MM患者14例。结果(表1)显示:患者中位年龄66.5岁(40~84岁),男女比为9∶5。中位治疗周期为3个周期(2~5个周期);治疗方案中BD方案占28.6%,VCD方案占71.4%。14例患者中,ISS分期Ⅲ期者占78.6%;12例患者采用荧光原位杂交检测进行R-ISS分期,其中Ⅲ期患者5例、Ⅱ期患者6例、Ⅰ期患者1例。
2.2 疗效评估 随访至2019年1月,结果(表2)显示:14例均可行2周期疗效评估,其中3例获得非常好的部分缓解(very good partial response, VGPR),9例为部分缓解(partial response, PR),1例为微小缓解(mild response, MR),1例疾病进展(progression disease, PD),总体反应率(overall response rate, ORR;ORR=CR+VGPR+PR)为85.7%。可行4周期疗效评估者6例,均达到VGPR,ORR为100%。
2.3 安全性评估 结果(表3)显示:14例患者在接受昕泰治疗后,总体安全性良好。血液学毒性以血小板(50.0%)及淋巴细胞计数减少(78.6%)常见,白细胞及中性粒细胞减少较少见。个别出现的3~4级血液学毒性为血小板计数(2例,14.3%)、中性粒细胞(2例,14.3%)及淋巴细胞计数减少(3例, 21.4%)。治疗相关的肝功能异常(如转氨酶升高)及肾功能不全(如血肌酐升高)较少见。
消化道不良反应主要为轻度便秘与腹泻。采用乳果糖或其他通便药物后,便秘得到缓解;腹泻均为2级以下,停止治疗或口服止泻药后,症状得到控制。其他消化道不良反应包括恶心及呕吐,治疗结束后自行缓解。药物相关周围神经病变(peripheral neuropathy, PN)表现为四肢肢端皮肤感觉异常(35.7%),主要为麻木感。3例患者诉用药后头晕。6例患者诉用药后全身乏力感,一般在治疗1~2 d后出现,休息后可缓解。1例患者在治疗过程中感染带状疱疹病毒,暂停骨髓瘤治疗并接受抗病毒治疗后好转。
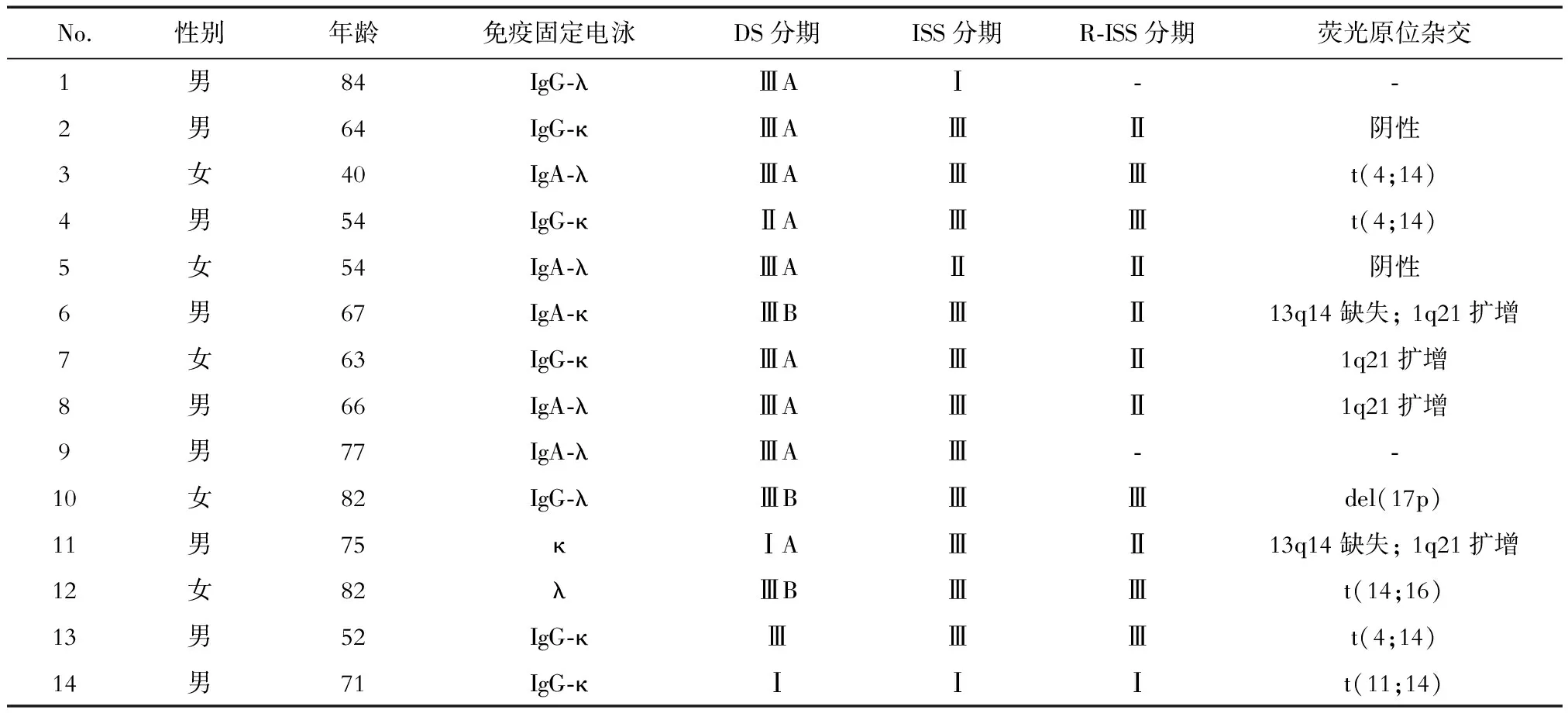
表1 接受昕泰治疗的初治MM患者的基线资料
DS分期:Durie-Salmon分期;ISS:国际分期体系;R-ISS:修正的国际分期体系
表2 初治MM患者昕泰治疗疗效评估
BD: 昕泰+地塞米松;VCD:昕泰+环磷酰胺+地塞米松.PR: 部分缓解;MR:微小缓解;PD:疾病进展;VGPR:非常好的部分缓解

表3 初治MM患者昕泰治疗安全性评估 n(%)
3 讨 论
硼替佐米是全球首个以蛋白酶体为治疗靶点的抗骨髓瘤药物。蛋白酶体负责降解细胞周期或凋亡相关蛋白[14]。这些关键蛋白首先被泛素化标记,然后被蛋白酶体降解[15]。相比于正常细胞,骨髓瘤细胞更依赖蛋白酶体,且具有更高水平的蛋白酶体活性。硼替佐米作为PIs,通过多种机制发挥抗骨髓瘤作用。正常情况下核转录因子-κB(NF-κB)的活性被IκB激酶(IKK)抑制,而骨髓瘤细胞内IKK被泛素蛋白酶体途径降解,从而使NF-κB自由进入细胞核,并诱导抗凋亡基因表达,抑制骨髓瘤细胞凋亡。硼替佐米通过可逆性阻断IKK的降解,从而抑制NF-κB信号通路,最终导致骨髓瘤细胞凋亡[16]。其他介导硼替佐米治疗作用的途径还包括免疫球蛋白错误折叠导致的内质网应激[17]和促凋亡基因与抗凋亡基因间失衡[18]。此外,硼替佐米能在转录水平上下调组蛋白去乙酰化酶基因家族的表达水平,诱导组蛋白高度乙酰化,促进骨髓瘤细胞凋亡[19]。
多项临床试验[20-22]证实,以硼替佐米为基础的治疗方案对于适合移植或不适合移植的MM患者均具有良好疗效。本研究以国产仿制药(昕泰)为基础,三药或两药联合治疗初治MM患者。可行2周期评估的14例患者的ORR为85.7%,可行4周期评估的6例患者的ORR为100%,提示昕泰治疗初治MM疗效良好。
同样以硼替佐米为基础的三药方案中,VCD方案较硼替佐米+沙利度胺+地塞米松(VTD)方案的血液学毒性更显著[23]。这可能与环磷酰胺和硼替佐米的双重血液学毒性有关。本研究中采用昕泰患者的血液学毒性主要为血小板计数减少(50.0%)及淋巴细胞计数减少(78.6%)。虽然白细胞减少、中性粒细胞减少较少见(28.6%、14.3%),但2例中性粒细胞减少均为3级以上,需要细胞因子支持治疗。结果提示,血液学毒性仍是以国产硼替佐米为基础治疗的相关AEs之一。
硼替佐米治疗相关的肝肾功能不全较少见。基线肝肾功能不全的患者在骨髓瘤治疗后未出现肝肾功能进一步恶化。部分基线肾功能不全(如血肌酐升高)的患者在昕泰治疗后血肌酐明显降低。在非血液学毒性中,消化道不良反应与原研药相似,主要为轻度的便秘与腹泻。便秘患者使用通便药物后症状可得到缓解;腹泻AE分级均为2级以下,在停止治疗或口服止泻药后,腹泻均可有效控制。治疗相关的PN主要表现为四肢肢端皮肤麻木感(35.7%)。既往文献[24]报道,在初治MM患者中,硼替佐米相关的PN(bortezomib-induced peripheral neuropathy, BIPN)发生率达47%,3~4级BIPN发生率为5%~16%。PN已成为影响MM患者生活质量及药物选择的主要AEs之一。硼替佐米直接损伤背根神经节可能是其诱导PN的主要原因[25-26]。本研究中PN的发生率为35.7%,患者AE均为1级,不伴疼痛、功能异常及工具性日常活动能力受限。本研究患者接受治疗时间短,需在后续治疗及随访过程中进一步记录PN发生率。本研究14例患者中的1例出现带状疱疹,停止治疗并予抗病毒治疗后好转。因此,与原研药相同,采用昕泰治疗的MM患者建议预防性口服抗病毒治疗。
作为一项真实世界研究,本研究的初步结果提示昕泰与原研药同样具有良好的疗效及安全性,但其长期疗效和安全性数据有待更大系列临床试验证实。
本文全体作者声明:本研究由国家自然科学基金(81570123)、重大新药创制国家科技重大专项(2017ZX09304021)和上海市卫生计生系统优秀学科带头人计划(2017BR033)支持,不受任何其他第3方的资金赞助,本研究结果无任何相关利益冲突。
