二甲双胍治疗坐骨神经结扎诱发大鼠神经病理性疼痛的效应
2019-05-21王之遥李瑋珊李艾伦
王之遥, 李瑋珊, 李艾伦, 方 芳, 仓 静
复旦大学附属中山医院麻醉科,上海 230032
神经病理性疼痛是由各种原因导致的以神经病理性改变为主的顽固性疼痛,主要表现为痛觉过敏、疼痛异常。其发病机制较为复杂,是疼痛治疗的难点之一。目前临床上常用的治疗药物包括抗抑郁药、抗癫痫药、阿片类镇痛药、局麻药以及非甾体类抗炎药等,治疗效果均不理想[1]。二甲双胍作为临床上2型糖尿病治疗的一线用药,可达到良好的降糖效果且不良反应少。近年来,二甲双胍降糖以外的作用越来越被重视。已有研究[2-6]发现,二甲双胍具有抗炎、抗肿瘤以及调节脂质代谢等作用。临床研究[7-8]表明,二甲双胍作为辅助用药联合加巴喷丁和曲马多对神经病理性疼痛患者安全有效,但相关报道有限。本研究拟评价二甲双胍治疗单侧坐骨神经神经慢性压迫损伤(chronic constriction injury,CCI)诱发的大鼠神经病理性疼痛的效应,为临床研究提供参考。
1 材料与方法
1.1 主要仪器及试剂 辐射热测试仪购自美国IITC Life Science公司,Von Frey纤毛购自美国Stoelting公司,CatWalk步态分析系统购自荷兰Noldus公司。戊巴比妥钠、二甲双胍购自美国Sigma公司。丙酮溶液(纯度>99.5%)购于国药集团化学试剂北京有限公司。
1.2 动物分组及模型制备
1.2.1 动物来源及饲养 SPF级雌性SD大鼠初始体质量180~200 g,7~9 周龄,由复旦大学上海医学院动物实验中心提供,以5只/笼饲养。所有动物可在笼内自由活动、摄食和饮水。保持饲养环境温度为23℃及相对恒定湿度;12 h昼夜循环光照并定期更换垫料。所有动物在实施手术以及行为实验时均严格遵守国际疼痛研究学会(IASP)的相关标准。采用随机数字表法,将其分为4组(n=12):正常对照组(Naive组)、假手术组(Sham组)、CCI组和CCI+二甲双胍组(Met组)。
1.2.2 神经病理性疼痛模型的建立及给药方法 根据Bennet和Xie[9]的方法建立坐骨神经CCI模型。将大鼠称质量后,将4%戊巴比妥按0.2 mL/100 g的剂量进行腹腔注射麻醉。大鼠采取侧卧位,备皮并用乙醇消毒术区。在左侧股骨下方约1 cm平行于股骨切开皮肤,钝性分离肌肉暴露坐骨神经;在神经三支分叉以上的位置用4-0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm,保证结扎神经的长度为4~5 mm,结扎的松紧度以见周围肌肉轻微抽动为佳;逐层缝合肌肉层以及皮肤;最后再次消毒手术区域。Sham组仅暴露而不结扎坐骨神经,其他组手术操作与CCI组相同。造模手术由同一人操作,以保证手术效果的均一性。Met组采用灌胃方式给药,每次剂量45 mg/kg,从CCI建模前3 d开始给药,每天上午 8:00至9:00和下午的6:00至7:00,持续至术后第7天。
1.3 疼痛行为学观察 分别于建模前(基线,D0),建模后第3、7、10、14天观察并记录大鼠伤口愈合情况及舔咬肢体、疼痛相关行为。根据文献[10]采用Von Frey法测定机械缩足反射阈值(mechanical withdrawal threshold,MWT): 在安静舒适环境中将大鼠单独放置于带金属网底(孔径0.5 cm×0.5 cm)的透明有机玻璃笼内,适应30 min后用不同标号的Von Frey丝(美国Stoeling公司)垂直刺激术侧后足足底部,将Von Frey丝弯曲至约45°并持续3~5 s。记录产生快速缩足、抬足、抖动或舔舐反应时对应的Von Frey丝标号。每种标号的Von Frey丝均被测定至少出现3次阳性反应或3次无反应,每次刺激均间隔至少10 s。逐渐增加刺激强度至同一标号Von Frey丝出现至少3次阳性反应,记录此时所用的Von Frey丝的标号作为MWT。
1.4 热缩足反射潜伏期(thermal withdrawal latency, TWL)的测定 在安静舒适环境中将大鼠单独放置于透明有机玻璃笼内,适应30 min后用热辐射疼痛刺激仪照射大鼠术侧后足足底,在照射20 s内当产生快速缩足、扬足或舔足反应时立即停止照射,并记录下此时照射的持续时间。重复测量5次,每次间隔至少5 min,将5次的持续照射时间取平均值作为TWL。
1.5 冷刺激诱发缩足次数 (number of cold-stimulated paw withdrawal,TNCW)的测定 根据文献[11]采用丙酮冷刺激法,在安静舒适环境中将大鼠单独放置于带金属网底(孔径0.5 cm×0.5 cm)的透明有机玻璃笼内,适应30 min后用0.1 mL丙酮测定大鼠的疼痛反应阈值。测定方法:用0.1 mL丙酮刺激术侧后足足底部,记录2 min内大鼠所测后足的阳性反应次数。阳性反应为后足抬起、甩腿或舔足、拭足。测试3次,测试间隔时间至少5 min,将平均3次的阳性反应次数作为TNCW。
1.6 CatWalk步态测定 采用CatWalk步态分析系统对各组大鼠进行运动步态测定。大鼠在测试前预先放在测试环境中30 min,温度控制在23℃左右,室内开红色光并保持安静。调整摄像头保证每次都能采集到至少4个站立时间。测试时,将大鼠放在CatWalk通道的一端,通道宽度设置为大鼠身宽的1.5倍,使大鼠自行走过,选取20 cm的距离进行记录,把通过时间控制在1~2 s。当大鼠的脚掌与玻璃平板的表面接触时,下方摄像头即可捕捉到脚印图像并传送到计算机,通过相应程序(Cat Walk XT 10.0)进行分析。每只大鼠至少重复测试3次。合格的测试需满足以下条件:脚印数≥10个,动物总行走时间控制在1~8 s,速度方差小于60 cm/s。
足印面积指在站立时相脚掌接触平板的总面积,与完整足印的平均强度均可反映行走时肢体的承重情况。而站立时间和摆动时间与受累侧肢体的疼痛和动物的保护性行为相关。站立时间指大鼠脚掌每次接触底板的时间。摆动时间指大鼠脚掌2次接触平板的间隔时间。另外记录步周长。
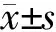
2 结 果
2.1 大鼠建模情况 各组大鼠术后皮肤切口愈合良好,未发生舔咬肢体现象。大鼠CCI建模后3 d逐渐出现术侧足趾并拢轻度外翻,后肢行走无力,呈跛行步态。结果(表1)表明:与Naive组相比,CCI组和Met组大鼠在建模后3 ~14 d左足MWT显著降低(P<0.05),Sham组左足MWT无明显改变;与CCI组相比,Met组大鼠3~14 d左足MWT明显升高(P<0.05)。
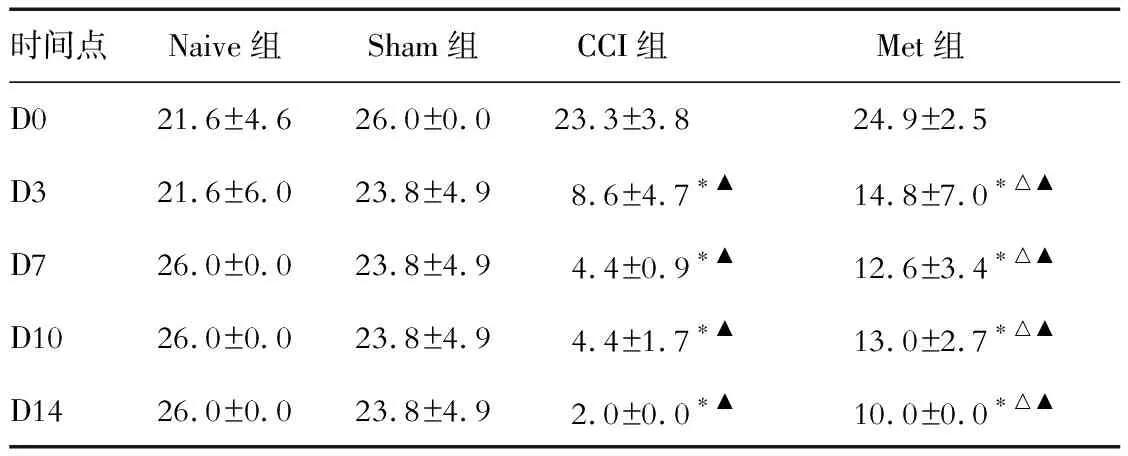
表1 各组大鼠左足机械缩足反射阈值 m/g
*P<0.05与Naive组比;△P<0.05与CCI组相比;▲P<0.05与D0相比
2.2 各组大鼠左足TWL的对比 结果(表2)表明:与Naive组相比,CCI组和Met组大鼠在建模后3~14 d左足TWL缩短(P<0.05),Sham组TWL未见明显改变;与CCI组相比,Met组大鼠3~14 d左足TWL明显延长(P<0.05)。
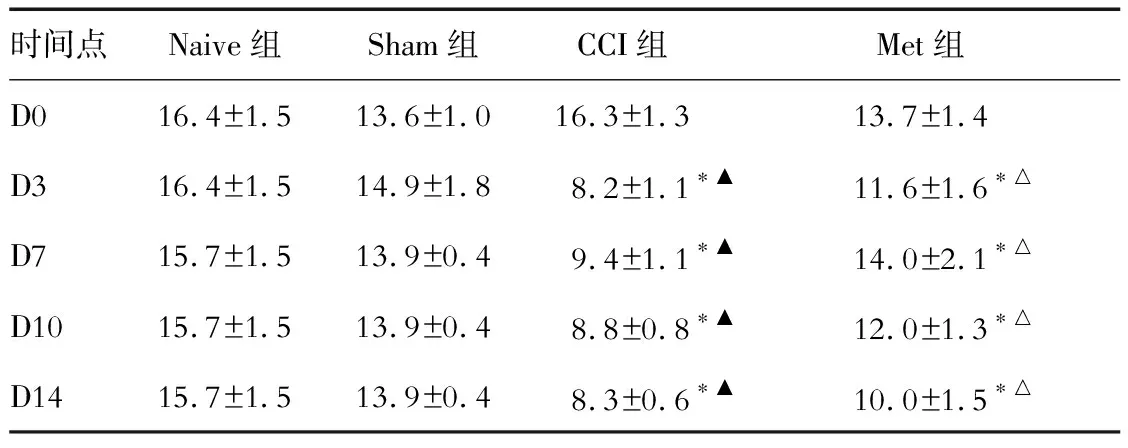
表2 各组大鼠左足热缩足反射潜伏期 t/s
*P<0.05与Naive组比;△P<0.05与CCI组相比;▲P<0.05与D0相比
2.3 各组大鼠左足TNCW的对比 结果(表3)表明:与Naive组相比,CCI组和Met组大鼠在建模后3~14 d左足TNCW减少(P<0.05),Sham组TNCW未见明显改变;与CCI组相比,Met组大鼠3~14 d左足TNCW明显增加(P<0.05)。
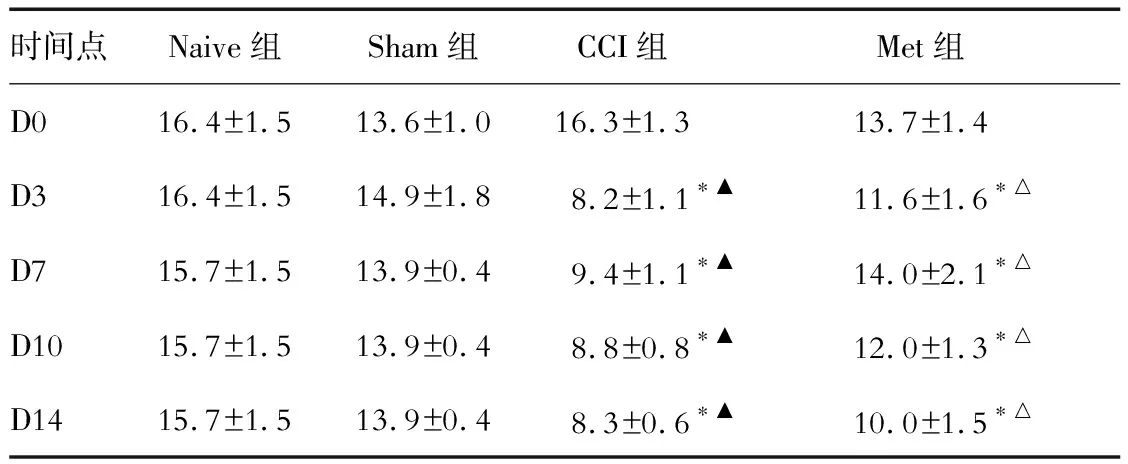
表3 各组大鼠左足冷刺激诱发缩足次数 f/次
*P<0.05与Naive组比;△P<0.05与CCI组相比;▲P<0.05与D0相比
2.4 各组大鼠左侧足印面积、完整足印的平均强度、站立时间及步周长的对比 结果(表4)表明:与Naive相比,CCI组大鼠左侧足印面积缩小、完整足印的平均强度减弱、站立时间缩短、步周长减小、摆动时间延长,并持续至建模后第14 天(P<0.05);Met组大鼠左侧足印面积缩小、完整足印的平均强度减弱。与CCI组相比,Met组大鼠左侧足印面积增加、完整足印的平均强度增强、站立时间延长及步周长增加(P<0.05),摆动时间无明显改变。Sham组上述指标在造模前后的各时间点均与对照组差异无统计意义。
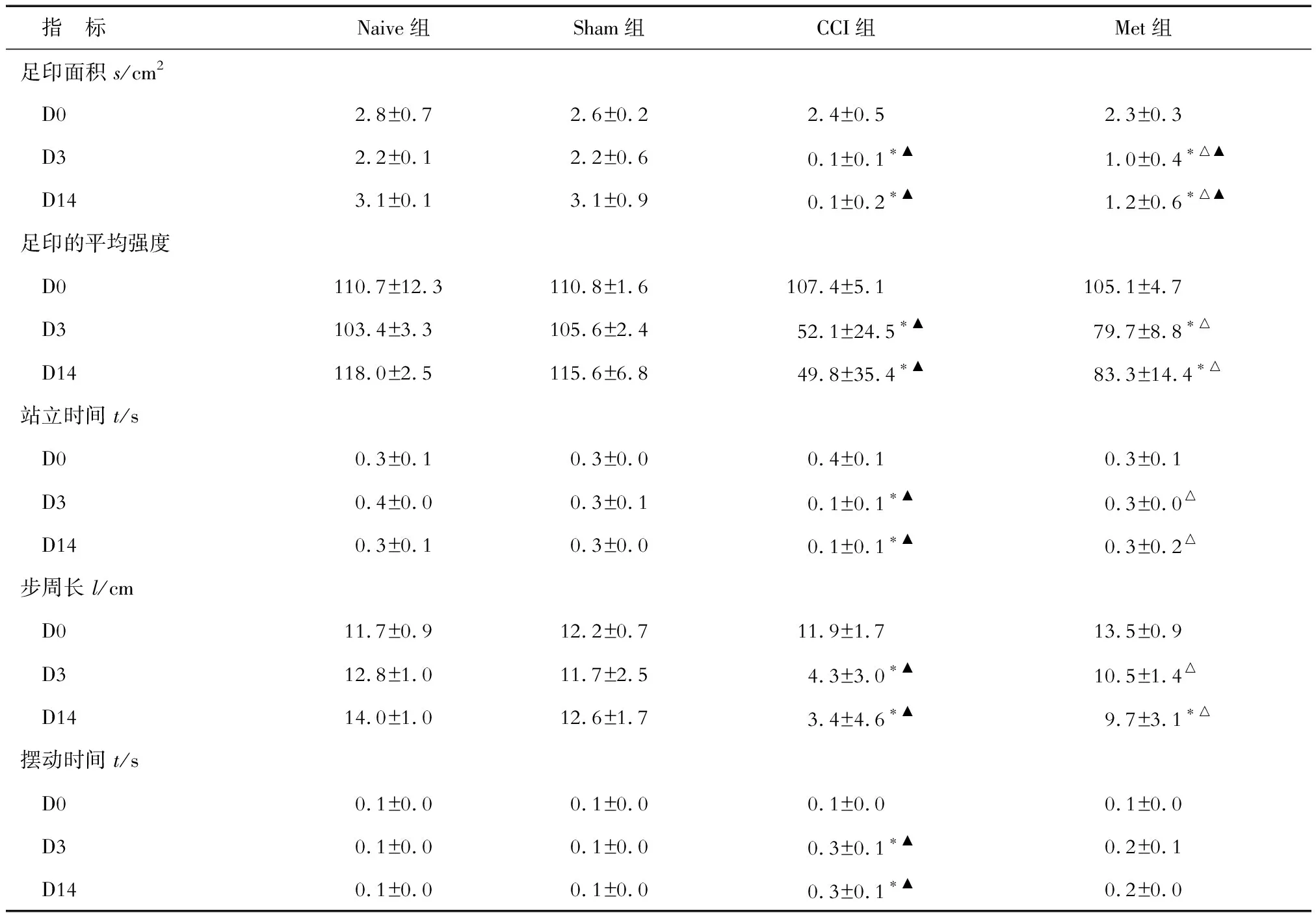
表4 各组大鼠左侧足印面积、完整足印的平均强度、站立时间、步周长等的对比
*P<0.05与Naive组比;△P<0.05与CCI组相比;▲P<0.05与D0相比
3 讨 论
坐骨神经CCI大鼠模型是最经典的神经病理性疼痛动物模型。该模型的优点在于与神经病理性疼痛患者的临床表现接近,并且为选择性的较粗的有髓鞘的神经纤维损伤,而参与痛觉传递C纤维保留[9]。轴突损伤的异位放电和神经结扎的炎性反应共同导致疼痛的产生。此外,由于低龄和低体质量的雌性大鼠对于伤害性刺激更为敏感[12-13],故本研究选择7~9周龄、体质量180~200 g的雌性大鼠作为研究对象。行为学的结果发现,与Naive组相比,CCI组大鼠在建模后3 d左足MWT降低、TWL缩短、TNCW减少,而Sham组大鼠各指标无明显改变,提示大鼠CCI模型建立成功。
除机械和冷热触发痛之外,本研究还进一步分析了CCI模型大鼠的步态变化。已有文献[14-15]报道,CatWalk步态分析中的足印面积以及完整足印的平均强度等参数与Von Frey法检测结果明显相关,说明其可作为一种更为客观的方法评估疼痛行为,避免了Von Frey方法的主观影响。本研究结果证实CCI组大鼠左侧足印面积缩小、完整足印的平均强度减弱及站立时间缩短,而摆动时间延长。另外,本研究还发现,CCI组大鼠的步周长减小以及站立时间缩短,说明造模后大鼠会由于患侧后肢疼痛而减少该侧肢体承重以及与地板接触的时间,并且行走时步伐会缩短。
既往研究[16]显示,磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)作为控制能量代谢的重要内源性激酶在痛觉调节中发挥至关重要的作用,其经典的激动剂包括白藜芦醇、二甲双胍等。Inyang等[17]利用成年雄性BALB/c小鼠建立SNI神经病理性疼痛小鼠模型,予以腹腔注射二甲双胍,结果发现,二甲双胍治疗后的神经病理性疼痛小鼠术侧机械痛阈比给药前明显升高,提示二甲双胍能减轻SNI神经病理性疼痛雄性小鼠的痛觉。葛安琪等[18]发现,腹腔注射二甲双胍可明显逆转骨癌痛大鼠的机械痛阈;二甲双胍治疗后,大鼠脊髓背角p-STAT3的表达显著降低。Lu等[19]发现,在损伤神经的周围局部注射AMPK激动剂也可升高神经病理性疼痛大鼠的MWT,其治疗作用可能与巨噬细胞释放内啡肽有关。然而,上述研究均仅对神经病理性疼痛大鼠的机械痛阈进行评估,方法较为单一。
本研究神经病理性疼痛大鼠采取二甲双胍灌胃的方法(模拟临床常用的给药方式)来进行疼痛干预,并且对神经病理性疼痛大鼠进行行为学评估。结果表明,二甲双胍可缓解CCI诱发神经病理性疼痛大鼠机械痛觉过敏,与既往研究结果相仿。此外,本研究结果还发现,二甲双胍同样可以改善CCI大鼠的冷热痛觉过敏及步态,说明二甲双胍可对不同种类的痛觉神经通路产生抑制效应。该效应的机制可能为:一方面,二甲双胍可通过激活中枢神经细胞(小胶质细胞、星型胶质细胞)AMPK通路,抑制白细胞介素1β(IL-1β)、IL-6等促炎介质释放,进而产生中枢性镇痛效应;另一方面,二甲双胍通过抑制细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)活性,降低电压门控通道Nav1.7的磷酸化水平,减少损伤后外周神经的异位放电,进而减轻疼痛[20]。然而,二甲双胍调控神经病理性疼痛的具体机制及是否在神经免疫方面产生影响,仍需进一步证实。
