F-NaF PET/CT骨显像在甲状旁腺功能亢进性骨病中的应用
2019-05-20杨玲蔡亮丁浩源陈跃
杨玲 蔡亮 丁浩源 陈跃
西南医科大学附属医院核医学科,泸州 646000
甲状旁腺功能亢进性骨病是由于甲状旁腺功能亢进而导致骨骼异常的全身性代谢性骨病。患者多以不明原因全身或局部骨关节疼痛、骨骼畸形或病理性骨折等为首发症状而行局部影像学检查(X射线、CT及MRI),其表现缺乏特异性,甚至部分患者无明显骨关节症状或仅有轻微症状,但已伴严重骨骼并发症[1]。该病漏诊及误诊率较高,常常被延误治疗及过度治疗[2-3],准确诊断及评估其严重程度并采取合适的治疗措施对患者预后极为重要。99Tcm-MDP全身骨显像以其高灵敏度及全身骨骼成像的优势被广泛应用于代谢性骨病的诊断中,但其缺乏解剖学信息,且特异度较低。18F-NaF PET/CT骨显像实现了全身骨代谢特点与清晰解剖结构的有机结合。本研究主要观察甲状旁腺功能亢进性骨病18F-NaF PET/CT骨显像的影像学特点,并通过与99Tcm-MDP全身骨显像进行对比,探讨其临床应用的价值。
1 资料与方法
1.1 一般资料
回顾性分析2016年6月至2017年12月经我院临床及术后病理确诊为甲状旁腺功能亢进症且均行18F-NaF PET/CT骨显像和99Tcm-MDP全身骨显像检查的30例患者,其中男性11例、女性19例,年龄 18~71(52.5±13.5)岁。30 例患者中 15 例为甲状旁腺腺瘤、15例为甲状旁腺增生;原发性甲状旁腺功能亢进症(primary hyperparathyroidism,PHPT)16例、继发性甲状旁腺功能亢进症(secondary hyperparathyroidism,SHPT)14例(均继发于肾衰竭患者)。纳入标准:结合实验室检查(血清甲状旁腺素)、甲状旁腺病变术后病理结果、影像学表现及随访结果,明确诊断为甲状旁腺功能亢进症的患者。排除标准:合并其他良恶性骨病,图像质量差、污染,生理性摄取等患者。临床表现为全身多处或局部骨关节疼痛或乏力者15例;胸廓变形、身高明显下降伴骨端杵状变者5例;骨质疏松病史4例;病理性骨折病史3例。30例患者中10例以骨关节症状为首诊原因,行骨显像检查后,高度怀疑甲状旁腺功能亢进性骨病,再行进一步检查后确诊,其中5例患者行骨显像检查前分别疑诊为骨囊肿、朗格汉斯组织细胞增生症、骨巨细胞瘤、骨质疏松及骨转移瘤。
检查前均与所有患者进行沟通交流,并签署知情同意书。
1.2 99Tcm-MDP 全身骨显像
静脉注射99Tcm-MDP(钼锝发生器由原子高科股份有限公司提供,注射用亚锡亚甲基二膦酸盐由北京师宏药物研制中心生产)740~925 MBq,嘱咐患者多喝水、多排尿,注射显像剂后3 h嘱患者排空膀胱、摘除身上的各种高密度器物,患者取仰卧位,使用德国 Siemens公司 Symbia T16型 SPECT/CT仪对患者全身(从头到足)行前、后位显像,扫描速度15~20 cm/min,窗宽20%,采集矩阵256×1024,利用工作站自带软件进行图像处理。
1.3 18F-NaF PET/CT 骨显像
按患者体重注射18F-NaF(由我院核医学科生产合成,加速器为德国Siemens公司Eclipse HP/RD医用回旋加速器)约 3.7 MBq/kg,注射后 60 min 进行PET/CT扫描,扫描前准备与99Tcm-MDP全身骨显像相同。采用荷兰 Philips公司 Gemini TF/16 PET/CT仪,首先进行CT扫描(从头到足),扫描条件为:电压 120 kV,电流 80~250 mA,螺距0.81,层厚5.0 mm,旋转时间 0.5 s。CT扫描完成后立即行同机PET图像采集,采集时间为70 s/床位。PET图像采用有序子集最大期望值法重建,迭代次数3次,子集数33,矩阵512×512,用CT图像进行衰减校正得到冠状、矢状、横断面及最大密度投影图。采用Philips工作站进行图像分析。
所有患者99Tcm-MDP全身骨显像和18F-NaF PET/CT骨显像的时间间隔在1周以内。
1.4 图像分析
由1名放射科及2名核医学科有5年以上工作经验的高年资医师联合阅片,经协商一致诊断或排除甲状旁腺功能亢进性骨病。骨显像阳性:排除其他良恶性骨病,骨骼骨代谢和(或)骨解剖学异常,诊断甲状旁腺功能亢进性骨病较明确;骨显像阴性:排除其他良恶性骨病后,余全身骨显像未见异常。①观察并记录每例患者两种骨显像中全身及局部骨代谢异常特点及18F-NaF PET/CT骨显像上病灶部位具体的解剖学表现。②根据18F-NaF PET/CT骨显像特点进行分型[4]:I型为骨显像阴性(全身骨显像未见异常);Ⅱ型为骨显像局灶性(单发或多发)放射性异常浓聚;Ⅲ型为全身多骨弥漫放射性增加;Ⅳ型为Ⅲ型基础上还伴局部骨代谢异常。③将诊断为甲状旁腺功能亢进性骨病患者经两种显像方法检测出的局部异常显像剂摄取灶纳入分析,根据局部CT表现对局部骨骼并发症进行分类(排除局部退行性骨关节病及其他局部骨良性病变)并各自计数。结合患者临床症状及18F-NaF PET/CT图像,采用Mirels标准对长骨的棕色瘤的骨折风险进行评分。
2 结果
2.1 18F-NaF PET/CT 骨显像表现
18F-NaF PET的最大密度投影图像结果显示:骨显像阴性15例(即Ⅰ型,其中PHPT 9例、SHPT 6 例),骨显像阳性 15 例(PHPT 7 例、SHPT 8 例)。阳性患者中有5例全身多处骨骼显像剂摄取普遍增高,骨与软组织对比增强,尤其是颅骨、下颌骨、胸骨、中轴骨和四肢长骨对称性显像剂摄取增加,肾影浅淡或不显影(即Ⅲ型,典型病例图像见图1);8例除了伴上述多种表现外,还伴多发局灶性显像剂异常分布区(即Ⅳ型,典型病例图像见图2、3);另2例表现为全身多发局灶性显像剂异常分布(即Ⅱ型,典型病例图像见图4、5)。另外,颅骨放射性摄取增加呈“黑颅”征9例(其中4例伴下颌骨放射性异常浓聚);胸骨放射性摄取增加呈“领带”征2例;脊柱放射性浓聚12例;肋骨软骨连接处放射性摄取增加呈“串珠”肋3例;四肢骨对称性显像剂浓聚13例;肾影浅淡或不显影15例;多发局灶性放射性异常分布8例。
18F-NaF PET/CT融合图像结果显示:全身多骨不同形式、不同程度骨质吸收15例(典型病例图像见图1、3、5),PET表现为全身多骨显像剂摄取普遍增高,同机CT示骨膜下、皮质内、软骨下、内膜下骨质吸收。其中,骨膜下骨吸收表现为骨皮质内外缘毛糙,多见于颅骨、骨盆骨及四肢长短骨等;皮质内骨吸收主要表现为骨皮质松化,多见于长骨;软骨下骨吸收表现为软骨下关节面毛糙,关节间隙增宽,多见于胸锁关节及骶髂关节。①全身不同程度骨质疏松13例(典型病例图像见图1、3),PET表现与骨质吸收相同,同机CT示全身骨骼骨质密度广泛减低,骨小梁稀疏。②棕色瘤7例(典型病例图像见图3、5),PET表现为局灶性显像剂浓聚、显像剂稀疏或病灶中心显像剂分布缺损伴边缘显像剂不均匀浓聚,同机CT示单发或多发大小不一囊状或不规则的溶骨性骨质吸收破坏区,边界较清,部分呈稍膨胀性,部分边缘轻度硬化,其内呈明显高于骨髓的均匀或不均匀软组织密度影,部分病灶内见高密度骨嵴及钙化影,周围骨皮质吸收变薄或完全吸收消失,无骨膜反应。③骨质硬化6例(典型病例图像见图1、3、5),PET表现为相应部位显像剂摄取增高,同机CT示颅骨、脊柱及四肢骨多发结节状高密度影1例(PHPT);部分棕色瘤边缘骨质硬化3例;椎体上下缘致密而中心密度减低,呈夹心椎样改变3例(均为SHPT);长骨干骺端皮髓质分界不清,骨小梁增粗融合,骨结构消失,见片状密度增高影3例(均为SHPT)。④骨质软化3例(均为SHPT,典型病例图像见图1),PET部分表现为显像剂摄取增高,部分显像剂摄取未见明显异常,同机CT示肋骨排列紊乱,胸廓畸形2例;双侧耻骨坐骨支向内上移位,骨盆入口呈三角形3例;耻骨上支、股骨颈骨样骨质缝隙,形成假骨骨折线2例。⑤病理性骨折3例,其中肋骨1例、肱骨1例、股骨1例,PET表现为局部显像剂浓聚,同机CT示骨质不连续。

图1 继发性甲状旁腺功能亢进性骨病患者(女性,56 岁)的18F-NaF PET/CT 显像图(分型:Ⅲ型,全身型) 病史:肾功能不全采用血液透析10余年,全身骨痛2余年,身高明显下降约10 cm。图中,A:最大密度投影图,示颅骨、下颌骨、脊柱、四肢骨显像剂摄取普遍增高,双肾及膀胱未见显影;B~M:断层融合图像,示颅骨骨质吸收伴小结节状骨质硬化(B、C,箭头所示),下颌骨膨胀,骨质密度降低,呈磨玻璃样(D、E,箭头所示),椎体上下缘骨质硬化,部分压缩性骨折(F、G,箭头所示),双侧股骨颈线条样低密度影,假骨折征(H、I,箭头所示),骨盆变形,呈三叶草形(A、H、I,箭头所示),膝关节骨小梁稀疏、增粗、紊乱(J、K),胫腓骨边缘不规则,骨质松化(L、M,箭头所示)。PET/CT:正电子发射断层显像计算机体层摄影术。Fig.1 18F-NaF PET/CT imaging of patient with secondary hyperparathyroid bone disease(female,56 years old)
2.2 18F-NaF PET/CT 骨显像与99Tcm-MDP 全身骨显像对比结果
所有患者两种骨显像图像的阴性和阳性结果一致,但18F-NaF PET/CT骨显像最大密度投影图较99Tcm-MDP全身骨显像图像更清晰,显示出的病灶范围更大、病灶数目更多(典型病例图像见图2、4)。15例骨显像阳性患者共检出局部骨骼病灶(棕色瘤、骨硬化、病理性骨折、假骨折)共53个,其中,18F-NaF PET/CT骨显像全部检出,99Tcm-MDP全身骨显像检出32个,明显低于前者。7例骨显像阳性患者伴多发棕色瘤,位于长骨的棕色瘤病灶共24个,其中9个Mirels评分大于9分。
3 讨论
各类型甲状旁腺功能亢进性骨病均由于甲状旁腺素持续分泌过多,激活了破骨细胞,导致破骨细胞和成骨细胞均增生活跃,全身骨转换率明显增加,而破骨细胞活动超过成骨细胞,使骨吸收超过骨形成。甲状旁腺功能亢进性骨病通常表现为不同程度普遍性及局限性骨质溶解吸收伴相应部位纤维组织反应性代偿增生,即纤维性骨炎,当骨溶解区不断扩大形成局限性骨质吸收破坏区时,其内血运丰富的增生纤维组织若出现囊性变和出血,进而形成含铁血黄素的棕红色的病变组织,称为纤维囊性骨炎(又名棕色瘤)[5-6]。部分患者还伴骨质硬化、骨质软化、骨质疏松、病理性骨折及异位钙化等[7-9]。
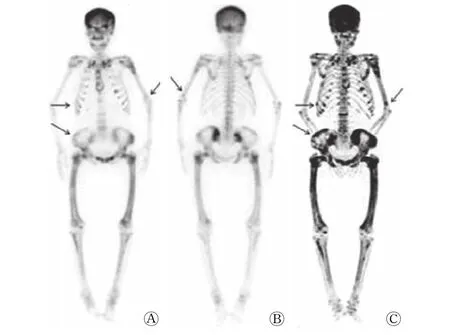
图2 甲状旁腺功能亢进性骨病患者(女性,65 岁)的99Tcm-MDP全身骨显像(A、B)及18F-NaF PET/CT骨显像全身最大密度投影图(C)(分型:Ⅳ型,全身+局部型) 病史:全身多处疼痛2余年。图中,颅骨、骨盆骨、四肢骨弥漫性显像剂摄取增高,双侧锁骨、肋骨、左侧肱骨、骨盆骨及股骨多发局灶性显像剂异常浓聚,双肾显影浅淡,膀胱未见显影;C较A、B更清晰,显示骨骼累及范围更广及病灶数目更多(箭头所示)。MDP:亚甲基二膦酸盐;PET/CT:正电子发射断层显像计算机体层摄影术。Fig.2 18F-NaF PET/CT and 99Tcm-MDP whole-body bone scintigraphy of patient with hyperparathyroid bone disease(female,65 years old)

图3 甲状旁腺功能亢进性骨病患者(女性,65岁,与图2为同一患者)的18F-NaF PET/CT骨显像断层融合显像图 图中,胸骨、右侧肋骨、左侧肱骨上段(A~C,箭头所示)、右侧髂骨(D~F,细箭头所示)、右侧股骨干(G~I,箭头所示)等多处膨胀性、溶骨性骨质破坏,伴显像剂浓聚、稀疏并存,双侧侧骶髂关节间隙增宽、毛糙,以左侧为著(D~F,粗箭头所示)。PET/CT:正电子发射断层显像计算机体层摄影术。Fig.3 18F-NaF PET/CT imaging of patient with hyperparathyroid bone disease(female,65 years old)
甲状旁腺功能亢进性骨病全身骨转化率增加,在骨显像上表现为全身骨骼对显像剂摄取普遍增高,骨与软组织对比增强,肾影浅淡或不显影,当颅骨显像剂摄取增高时呈 “黑颅”征,胸骨摄取增高时呈“领带”征,肋软骨连接处摄取增高时呈“串珠”肋。本研究甲状旁腺功能亢进性骨病患者的18F-NaF PET/CT骨显像图像大部分表现为上述多种代谢性骨病征象,并发棕色瘤、骨硬化、病理性骨折及假骨折等时表现为单发或多发局灶性显像剂异常分布区,其中棕色瘤可表现为局灶性显像剂浓聚、显像剂稀疏或病灶中心显像剂分布缺损伴边缘显像剂不均匀浓聚。朱瑞森等[4]将甲状旁腺功能亢进性骨病患者的99Tcm-MDP全身骨显像按显像特点分为4型,即正常型(Ⅰ型)、局部型(Ⅱ型)、全身型(Ⅲ型)及全身+局部型(Ⅳ型)。18F-NaF的显像机制与99Tcm-MDP相似,本研究患者的18F-NaF PET/CT骨显像最大密度投影图像与99Tcm-MDP全身骨显像大体相似,也可大致分为上述4型,但是在Ⅱ型(局部型)患者中,除上述朱瑞森等[4]报道的2种亚型外,还发现2例表现为全身多发局灶性显像剂浓聚而不伴颅骨和下颌骨放射性浓聚。本研究发现18F-NaF PET/CT骨显像较99Tcm-MDP全身骨显像图像更清晰,显示出的病灶范围更大,且对局部骨骼并发症有更高的检出率,这与18F-NaF具有更好的药代动力学特征(较99Tcm-MDP具有更快的血浆清除率及更高的骨摄取)、PET/CT具有更好的空间分辨率及其能将全身骨骼的骨代谢特点与CT显示的清晰解剖结构有机结合相关。
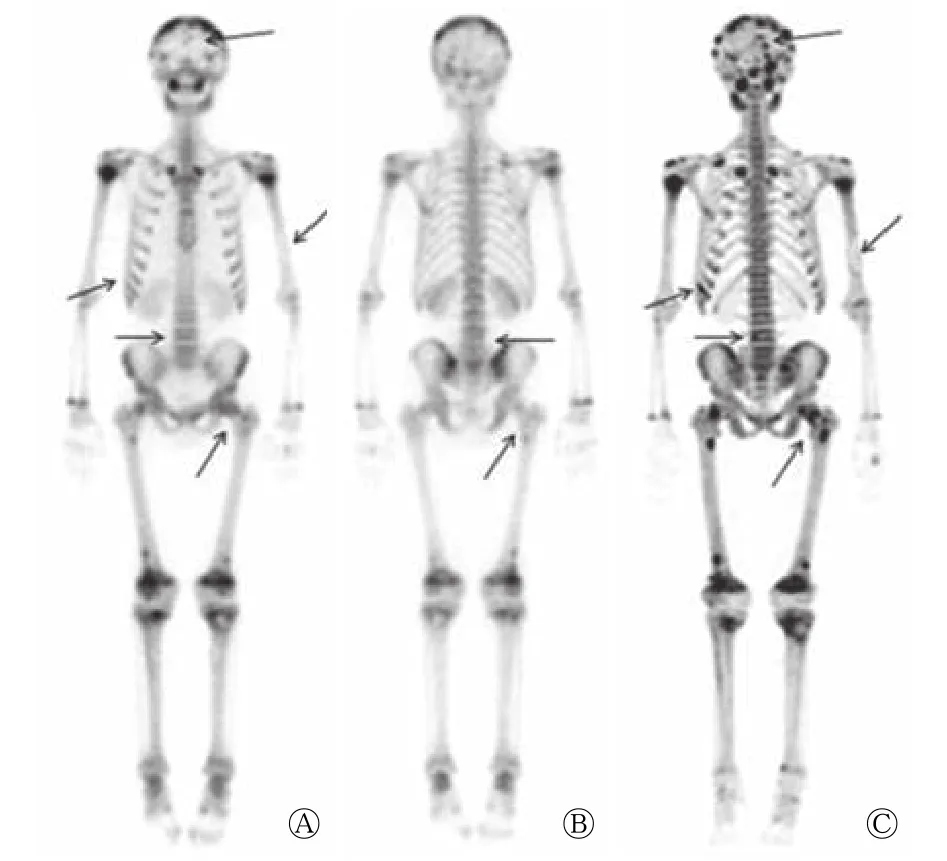
图4 原发性甲状旁腺功能亢进性骨病患者(男性,18岁)的99Tcm-MDP全身骨显像(A、B)及18F-NaF PET/CT骨显像全身最大密度投影图(C)(分型:Ⅱ型,局部型) 病史:髋部疼痛1年,髋关节CT及MRI怀疑骨嗜酸性肉芽肿。图中,全身骨骼多发结节状、团片状显像剂异常浓聚灶,部分病灶区伴显像剂分布缺损,双肾显影浅淡,膀胱未见显影;C较A、B更清晰,显示病灶范围及病灶数目更多(箭头所示)。MDP:亚甲基二膦酸盐;PET/CT:正电子发射断层显像计算机体层摄影术。Fig.4 18F-NaF PET/CT and 99Tcm-MDP whole-body bone scintigraphy of patient with primary hyperparathyroid bone disease(male,18 years old)
既往较多文献报道了甲状旁腺功能亢进性骨病的局部影像学(X射线、CT或MRI)特征性表现[7-8,10-11],包 括骨 质吸 收、 棕 色瘤、骨质硬化及骨质软化等。本研究甲状旁腺功能亢进性骨病患者的18F-NaF PET/CT骨显像同机CT上均可见多骨多种形式骨质吸收;棕色瘤7例,均为多发,除了典型表现外,部分伴软组织肿块及不规则骨化及钙化2例,与方义杰等[8]研究结果一致。软组织肿块甚至可突破骨质呈肿瘤样扩张,向内累及骨髓,向外累及软组织[12]。骨质硬化的具体病理机制尚不明确,继发性患者多见于长期透析者,本研究患者除典型表现外,发现以颅骨为主的全身多发结节状硬化1例(PHPT),极为少见,有学者认为这可能与过量甲状旁腺素导致全身各骨成骨细胞活性不一和年轻患者的高骨转换率相关[13]。本研究中继发性甲状旁腺功能亢进性骨病患者均继发于慢性肾功能不全,除了因甲状旁腺素增高所致高转化性骨病,还多伴有维生素D不足和铝中毒引起的低转换型及铝型骨病,成人主要表现为骨软化症[9]。本研究中继发性甲状旁腺功能亢进性骨病患者均有慢性肾病史,骨质硬化发生率较原发性甲状旁腺功能亢进性骨病患者高,骨软化致骨骼变形及假骨折也均见于继发性甲状旁腺功能亢进性骨病患者,这与文献报道一致[9]。
甲状旁腺功能亢进性骨病为全身性代谢性骨病,伴棕色瘤的患者临床表现与发生部位、病变大小及累及范围相关,患者常因局部疼痛、病理性骨折就诊而行局部影像学检查,棕色瘤虽为增殖性、修复性和反应性骨良性病变,但其表现为溶骨性骨质破坏,局部影像学表现多样,缺乏特异性,需与其他溶骨性病变相鉴别,病理组织学检查虽可排除恶性病变,但也无特异性,与其他巨细胞病变也很难区分,故对其误诊率较高[3,14]。99Tcm-MDP全身骨显像虽然可一次性全身显像,但其不能准确定位病灶且无法显示病灶的精细解剖学特征,与部分具有相似骨显像表现的其他骨病在鉴别诊断上存在一定困难。18F-NaF PET/CT能更好地显示甲状旁腺功能亢进性骨病的全身骨骼代谢及多种特征性解剖学表现,对于因局部影像学及组织学无明显特异性而最易误诊的棕色瘤,18F-NaF PET/CT骨显像可显示与之并存的多种形式的骨质吸收,有助于排除其他骨病,避免不必要的治疗及后期严重并发症的发生。本研究有10例患者行18F-NaF PET/CT骨显像后(5例患者之前误诊为其他骨病),高度怀疑甲状旁腺功能亢进性骨病,而进一步检查最终确诊为甲状旁腺功能亢进症,故18F-NaF PET/CT骨显像在一定程度上可以决定诊断的结果。
通常患者在甲状旁腺病灶切除术后,相关骨病会逐渐修复,但有少数棕色瘤在术后不能愈合,较大的棕色瘤易发生病理性骨折,累及临近神经或脊髓时,可导致严重疼痛,这时骨科干预也是有必要的。桑尚等[2]认为对于确诊甲状旁腺功能亢进性骨病的患者,应参考Mirels评分系统来评估患者有无严重的病理性骨折以及出现骨折的风险。18F-NaF PET/CT骨显像可以通过显示全身骨骼病灶的具体情况,对甲状旁腺功能亢进性骨病进行全面评估,有助于采取合理保护及治疗措施,避免严重骨相关事件的发生,改善早期局部疼痛症状,提高患者的生活质量[5,14-15]。本组7例甲状旁腺功能亢进性骨病患者伴长骨棕色瘤,其中9个病灶Mirels评分大于9分。18F-NaF PET/CT骨显像还能通过对病灶进行半定量分析(SUV测定)及结合血浆清除率来定量评估局部骨形成,从而对各种骨病进行疗效评估[4,9,16-18]。

图5 原发性甲状旁腺功能亢进性骨病患者(男性,18岁,与图4为同一患者)的18FNaF PET/CT骨显像断层融合显像图 图中,颅骨及双侧股骨多发结节状密度增高影伴显像剂浓聚(A~F,箭头所示为典型病灶);颅骨内外板增宽,骨质密度减低(B、C,箭头所示为典型病灶);双侧股骨头、双侧股骨下段及胫骨上端多发大小不一囊状、不规则骨质破坏区,边界较清,部分边缘硬化,其内可见软组织密度影,伴显像剂浓聚、稀疏或二者并存(D~I,箭头所示为典型病灶)。PET/CT:正电子发射断层显像计算机体层摄影术。Fig.5 18F-NaF PET/CT imaging of patient with primary hyperparathyroid bone disease(male,18 years old)
甲状旁腺功能亢进性骨病在PET上多表现为代谢性骨病征象,部分还表现为多发局灶性显像剂分布异常,需结合全身同机CT表现与以下疾病相鉴别:①多发骨转移瘤。该病以中老年患者为多见,部分患者有原发肿瘤病史,多累及骨盆、椎体,累及颅骨及四肢较少见,骨质破坏区边缘模糊不清,常形成软组织肿块,与邻近组织分界不清,进展快,破坏区内无骨化或钙化影,无骨硬化边及骨膜反应。②多发性骨髓瘤。该病常为老年发病,常侵犯富含红骨髓的骨骼,中轴骨多受累,髓腔常呈多发穿凿样或鼠咬状骨质破坏,内部无钙化或骨化,无骨质硬化边,部分患者尿中可见本周蛋白。③骨嗜酸性肉芽肿。该病好发于3~10岁儿童,单发或多发骨质破坏,伴或不伴软组织肿块,病变膨胀性生长,破坏边缘清晰伴有不同程度硬化,发生于长骨时可形成葱皮样骨膜反应。④Paget病。患骨增粗变形,皮质增厚,颅骨进行性增大,出现绒球样骨增生。上述疾病均无甲状旁腺功能亢进性骨病特征性的全身多骨多种形式的骨质吸收表现,且无在此基础上伴棕色瘤、骨质硬化或骨质软化等一种或多种局灶性骨质改变的特征性表现。研究结果显示18FFDG PET/CT在甲状旁腺功能亢进症患者病因诊断及伴骨骼或全身其他系统并发症中均有一定的应用价值[19-20],其他几种显像剂(99Tcm-MIBI、11C-蛋氨酸、18F-氟甲基胆碱)对甲状旁腺病灶具有更好的诊断价值[21-23],但是18F-NaF为亲骨性显像剂,对骨骼病灶具有独特的优势。
总之,18F-NaF PET/CT骨显像在甲状旁腺功能亢进性骨病的诊断、鉴别诊断及病情评估中具有重要价值,且在疗效和预后评估中具有潜在价值。
