室管膜下瘤1例报告☆
2019-05-20唐洪兴于鸿远尹剑
唐洪兴 于鸿远 尹剑○☆
室管膜下瘤是一种罕见的中枢神经系统良性肿瘤,其生长缓慢,发病率低,多发生于脑室内系统,好发于第四脑室,侧脑室次之,三脑室、透明隔和脊髓少见,脑实质内室管膜下瘤极为罕见。我科于近日收治右侧脑室占位1例,术后病理证实为室管膜下瘤(WHO I级)。由于不少临床医师对此种疾病相对陌生,导致容易出现误诊。本例室管膜下瘤病例典型,具有一定的代表性,现结合本例复习相关文献,以期指导提高对本病的认识,降低临床误诊。
1 资料
患者,女,69岁,确诊非霍奇金淋巴瘤 1年余,以“头痛伴头晕1个月”人院。入院后行3.0 MRI颅脑增强示:右侧额叶占位,T1低、T2高信号,大小约 29 mm×20 mm,与侧脑室相通,病灶周围见水肿区,DWI示病灶稍低信号,增强扫描可见斑点样强化(图1)。查体:神经系统未见异常。心、肺及各项血生化指标均未见明显异常。术前诊断:淋巴瘤颅内浸润或星形胶质细胞瘤。入院第5天行开颅手术,术中见皮层下黄色肿瘤性病变,质地韧,未见明显包膜,边缘呈囊性,血供差,肿瘤深部与右侧脑室额角相通,期内可见室性结节,大小约 1.0 cm×1.0 cm×1.0 cm,显微镜下予以切除全部室性结节及部分囊壁。术后标本经4%中性甲醛溶液固定,石蜡包埋,5 μm切片,分别行HE染色及免疫组化检查(图2)。光学显微镜:肿瘤背景为丰富的胶质纤维,可见少量形态温和的胶质细胞呈簇状分布于胶质纤维中,血管周围可见囊性变及灶状出血伴含铁血黄素沉着。免疫组化:肿瘤细胞 GFAP (+),EMA 局灶(+),神经元NeuN(-)、S-100(+)、NF(-)、P53(-)、IDH1(-),、ATR(-)、CD20(-)、CD79 a(-)、CD3(-),Ki67 指数约 1%。血管周围淡粉染均物质:AAT(-),PSA 染色(-),刚果染色(-)。术后病理诊断:考虑室管膜下瘤(WHO I级),不除外混合性室管膜瘤/室管膜下瘤。
2 讨论
室管膜下瘤由SCHEINKER等在1945年首次报道[1],约占所有中枢神经系统肿瘤的0.2%~0.7%[2]。在2016年WHO神经系统肿瘤分类中,属室管膜肿瘤的一种罕见亚型,生物学行为属WHO I级,好发于中老年人,儿童少见,男性略多于女性。发病率约为0.055~0.070/10万,多发生于脑室内,以第四脑室、侧脑室(Monro孔附近)多见,少见于第三脑室、透明隔及脊髓等处[3-4],发生在脑实质的室管膜下瘤罕见。肿瘤细胞可起源于室管膜下胶质细胞、室管膜下星形细胞、室管膜细胞以及混合星形细胞和室管膜细胞,目前认为室管膜下胶质细胞前体细胞起源可能性最大[4]。
本例患者以头痛为主要临床症状,术后病理及免疫组化结果提示诊断:室管膜下瘤。术前存在误诊主要是对该病的临床特点认识不足。该病起病隐匿,一般无明确的神经系统定位症状,可以长期无临床症状,甚至终生无症状,尸检可发现偶发病例[5]。其症状的出现与肿瘤的位置及大小有关,当肿瘤位于室间孔(Monro氏孔)、透明隔及第四脑室等位置往往可早期出现临床症状,表现为头痛、恶心、呕吐、视力改变、记忆和认知障碍,平衡障碍、步态不稳等一系列症状[2],其主要原因是由于阻塞脑室脑脊液循环,引起脑积水和明显颅内压增高征。肿瘤直径小于2 cm,通常无明显临床症状,当肿瘤继续增大至直径超过3 cm以上时可出现相应的临床症状[6]。
该病例影像学表现为右侧脑室囊性占位长入右侧额叶脑实质,表现无特异性。回顾文献,该瘤多为脑室内生长,CT平扫可见肿瘤边界清楚,呈圆形、类圆形或分叶状,以等或低密度为主,通常无明显占位效应。MRI扫描,肿瘤在T1WI一般呈低或等信号,肿瘤内可见多个小囊状低信号区,以囊实性表现多见,个别可见较大的囊状低信号区;T2WI一般呈均匀一致的高信号,DWI成等或低信号,一般无脑实质水肿,肿瘤缺乏血管,血供较差,增强扫无强化或仅轻微强化[7],少数病例表现为罕见的瘤内出血[8]。在影像学上,需要与颅内室管膜瘤、室管膜下巨细胞星形细胞瘤、脉络丛乳头状瘤、中枢神经细胞瘤、毛细胞型星形细胞瘤及髓母细胞瘤等相鉴别[3,7]。本例室管膜下瘤在MRI上表现为T1WI呈低信号,T2WI均匀一致的高信号,病灶周围可见少量水肿,DWI示病灶稍低信号,增强扫描未见明显强化。与国内外既往研究结果报道一致。

图1 a、b、c:轴位 MRI示右额占位性病变,T1低信号、T2高信号,大小约29 mm×20 mm,与侧脑室相通,病灶周围见轻微水肿区,增强扫描可见斑点样强化。d、e、f:DWI示病灶稍低信号,矢状位、冠状位增强MRI示占位中心囊性区未见强化,周围可见部分强化
该瘤典型病理特征为显微镜下形态一致的簇状细胞核埋入致密的胶质纤维基质中,常伴微囊形成。核分裂相偶见或缺如,可见钙化和出血,肿瘤微血管可增生并可伴有血管的玻璃样变性,偶尔细胞突起可围绕在血管周围,形成室管膜假菊形团。有些还可见到其他室管膜瘤成分,这种混合性肿瘤可诊断为混合性室管膜瘤/室管膜下瘤WHO II级。本例患者术后病理与上述典型病理大致相同。免疫组化中肿瘤细胞 GFAP (+),EMA局灶 (+),神经元NeuN(-)、S-100(+),Ki67 指数约 1%,符合典型室管膜下瘤病理,但EMA(+)提示可能混合室管膜瘤,因此最终病理诊断:考虑室管膜下瘤(WHO I级),不除外混合性室管膜瘤/室管膜下瘤。
本例患者临床症状明显,影像学提示颅内占位,有明显手术指征,术后患者头痛症状明显缓解。治疗上,考虑到该瘤良性性质,生长非常缓慢,对于偶然发现的无症状的室管膜下瘤可采取密切观察策略,而对于有脑积水等临床症状或有进展可能等肿瘤应首选手术治疗[3,9]。手术入路因肿瘤部位不同而异,应根据具体病例的需要而定。如第四脑室肿瘤可以采用枕下开颅术,侧脑室内肿瘤可以采用经胼胝体入路切除等。近年来神经导航、荧光技术辅助显微外科技术及立体定向放射外科的应用有利于更精确的切除肿瘤,减少术后并发症,改善预后。对于放射治疗,目前存在争议,但大多数研究结果表明,放疗对于室管膜下瘤无明显治疗效果,且术后放疗对于患者的预后无明显改善。在实际临床工作中,很多专科医生一般不建议术后进一步行放射治疗[2]。此外,该瘤Ki-67指数通常较低,预后良好,术后很少见肿瘤复发[10]。有研究发现[3],较年轻的年龄、女性性别和脑室内或脑干附近的肿瘤位置可能是预后良好的指标。
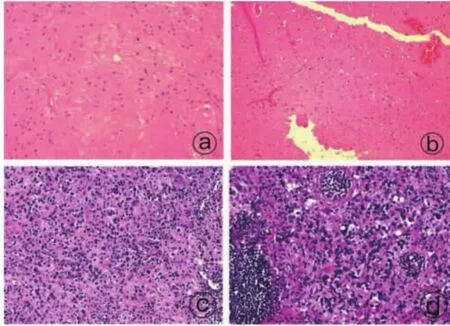
图2 术后病理及免疫组化(a、b、c、d):肿瘤背景为丰富的胶质纤维,可见少量形态温和的胶质细胞呈簇状分布于胶质纤维中,血管周围可见囊性变及灶状出血伴含铁血黄素沉着(HE,×200)
