豆腐加工废水发酵物的抑菌作用
2019-05-18陈跃文王怡然崇云青刘飞建
陈跃文 王怡然 陈 铮 朱 炫 陈 杰 崇云青 陈 怡 刘飞建
(1 浙江工商大学食品与生物工程学院 杭州310018 2 浙江工商大学 国家级食品工程与质量安全实验教学中心 杭州310018 3 中国食品科学技术学会 北京100048)
豆腐是中国的传统食品,因营养丰富,故易滋生各种微生物而不易存放,导致豆腐产量无法提升及后续加工卫生状况无法改善。研究豆腐保鲜技术,延长豆腐保质期,缓解豆腐储存运输压力,有利于提高经济效益。目前,有人利用高压灭菌法和加压蒸煮法以及无菌充填法等来延长豆腐保质期,然而,这些方法可能改变豆腐风味,使豆腐的品质下降。
浙江省的大豆制品厂在生产过程中,各股黄水量和浓度随着生产工艺、产品类别、生产习惯等不同而不同。我国的豆腐产量大,每天均有大量豆腐黄水排出。由豆腐生产而排放的大量废水中有机物污染物浓度高,每生产1t 豆腐,就会产生至少10 t 的废水,而废水的COD 值极高,超过2 000 mg/L,对环境污染极大。这种黄水一般经过简单处理之后直接排放到下水道中,对水环境污染严重,目前还没有专业化处理技术。豆腐废水处理一直是豆腐生产行业面临的难题。
豆腐黄水中含还原糖1.2~1.3 g/L,总糖5.2~8.0 g/L,总氮0.7~0.8 g/L[1],这些成分可以为微生物的生长提供营养支持,因此可用于培养微生物。
基于以上几点,利用豆腐废水中含有的单糖、寡聚糖、钾、磷、钙、铁、维生素、有机酸、水溶性蛋白、氨基酸和脂类等营养成分[2]进行微生物的培养,通过微生物发酵的方法得到抑菌物质,再将发酵产物反加回豆腐中,这种方法不仅可以很好地解决黄水排放的问题,而且在保证豆腐风味的同时解决了豆腐保质期短的问题,实现了环境和经济的双赢[3]。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 丙酸菌(Propionibacterium shermannii,PS)、 费氏丙酸杆菌(Propionibacterium freudenreichii,PF)、罗伊氏乳杆菌(Lactobacillus reuteri,LR)、大肠埃希氏菌(E.coli)、金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(Bacillus)。
1.1.2 培养基
1)LB 固体培养基:胰蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L,琼脂15.0 g/L。
2)LB 液体培养基:胰蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L。
3)MRS 培养基:蛋白胨10.0 g/L,牛肉粉10.0 g/L,酵母粉5.0 g/L,葡萄糖20.0 g/L,硫酸镁0.1 g/L,醋酸钠5.0 g/L,柠檬酸铵2.0 g/L,磷酸氢二钾2.0 g/L,硫酸锰0.05 g/L,吐温80 1.0 g/L。
4)平板计数琼脂(PCA)培养基:胰蛋白胨5.0 g/L,酵母浸粉2.5 g/L,葡萄糖1.0 g/L,琼脂15.5 g/L。
5)LB 半固培养基为LB 液体培养基另加入琼脂7.5 g/L。
配制好的培养基121 ℃高压蒸汽灭菌15 min。
1.1.3 主要仪器和设备 纯净工作台SW-CJ-2FD,苏净集团苏州安泰空气技术有限公司;恒温恒湿培养箱(BSC-250);自动高压灭菌器(TOMY SX-500);离心机;pH 计;血球计数板;显微镜;分光光度计。
1.2 试验方法
1.2.1 豆腐黄水发酵试验 取出豆腐黄水分别盛放于3 个锥形瓶中,高温蒸汽灭菌锅中121 ℃条件下灭菌15 min。
用血球计数板计算PS、PF、LR 的数量级。根据发酵菌数量级分别向灭菌后冷却至45 ℃左右的黄水中接入PS、PF、LR。PS、PF 接种液在30 ℃恒温培养箱中培养,LR 接种液在37 ℃恒温培养箱中培养,培养过程中每天取样(上清和全液),用于抑菌试验[4]。
1.2.2 豆腐黄水发酵优化试验 在接种发酵菌的同时,PS,PF 接种液中添加10%的葡萄糖,LR 接种液中加入比例为1∶3 的葡萄糖∶甘油,其余均同
1.2.1 节豆腐黄水发酵试验。
1.2.3 发酵产物抑菌试验 灭菌后的LB 半固培养基接入指示菌,倒平板,待培养基凝固后用打孔器在培养基上打孔,放入4 ℃冰箱中冷藏半小时,取出,向圈中加入200 μL 抑菌剂,放入4 ℃冰箱中冷藏3 h,取出后放进37 ℃恒温培养箱中培养12 h[5-6]。12 h 后取出培养皿,拍照并测量抑菌圈大小,记录数据。
1.2.4 豆腐保质期试验 市售新鲜豆腐切成大小为2 cm×2 cm 的块状若干,喷洒抑菌剂,并设置1组空白对照。室温培养[8]。
1.2.5 抑菌剂稳定性试验 每天用平板计数法测定抑菌剂在室温中抑制豆腐其他微生物的情况,通过比较空白的菌落数测定其是否还稳定存在。并取样测定豆腐pH 值,观察豆腐风味变化。
1.2.6 抑菌剂在豆腐中抑菌效果 将豆腐中常见的大肠埃希氏菌 (E.coli)、 金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(Bacillus)作为指示菌每天加入室温放置的豆腐中,用平板计数法测定抑菌剂随时间的增加,抑制指示菌的效果。取样测定豆腐pH 值[9]。
1.2.7 豆腐黄水发酵产物高产试验 通过改变发酵条件(微生物接种量,黄水pH、碳源含量),得到最适发酵条件[10-11]。
2 结果与分析
2.1 豆腐黄水发酵试验及优化试验理化指标
PS、PF、LR 3 种微生物在豆腐黄水中发酵4d,每天测量3 种菌的菌液的pH 及OD 值,结果见表1[12]。从表1中可知3 种微生物优化与未优化的菌液的pH 值和OD 值均有一定程度的增大[13]。
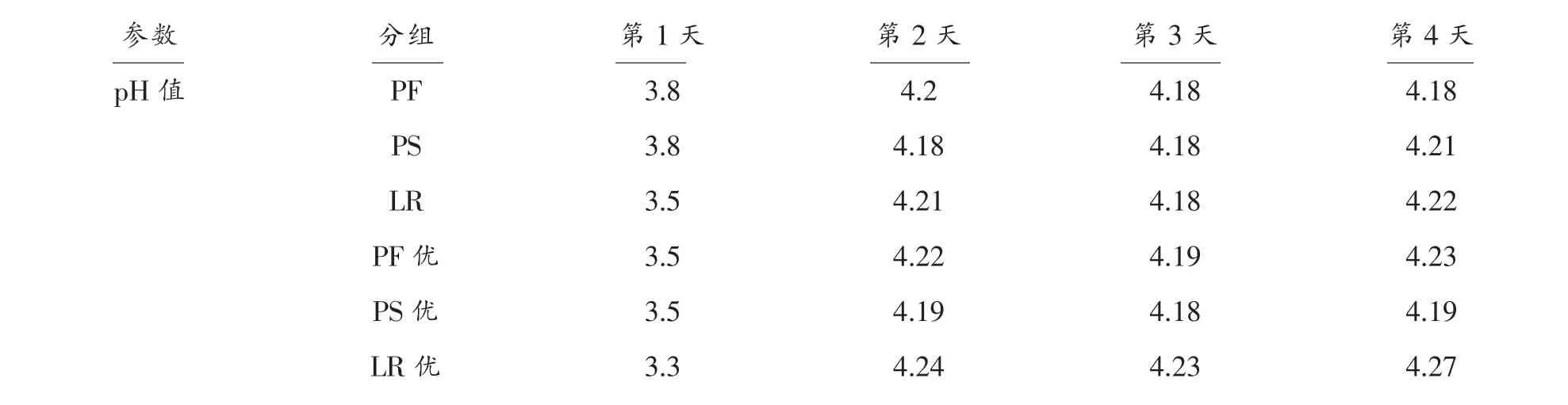
表1 豆腐黄水发酵试验及优化试验pH 与OD 值Table 1 The pH and OD in the fermentation experiments and optimization of the experiments with tofu waste water
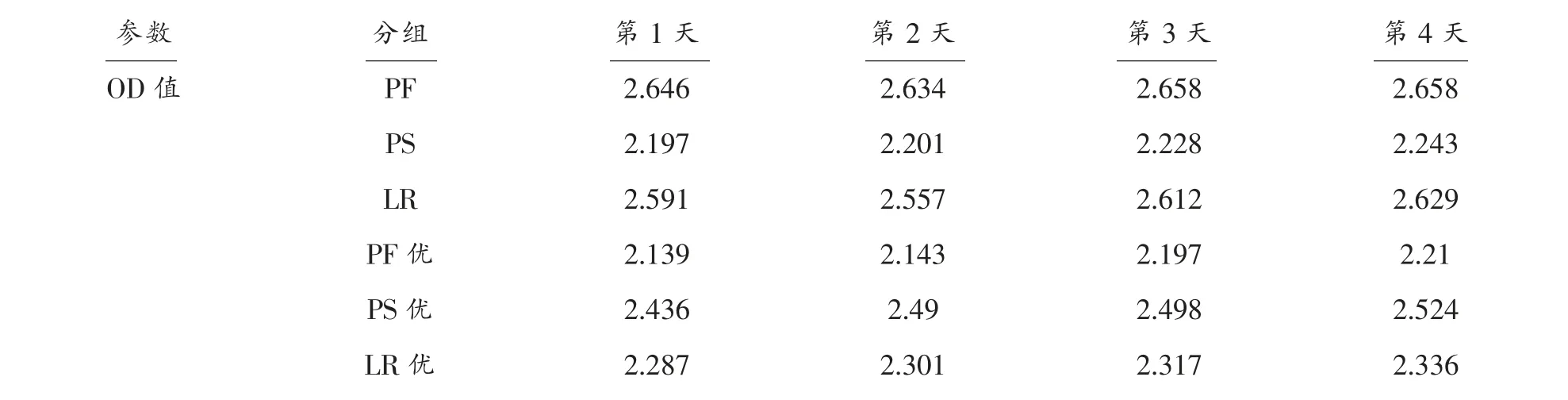
(续表1)
2.2 发酵产物抑菌试验
2.2.1 指示菌活均数 从-80 ℃中取出的3 种指示菌活化扩培1 d 后,用血球计数板测量活菌数,结果见图1。据图可知,抑菌试验中为保持3 种指示菌同一数量级,大肠埃希氏菌需稀释5 倍,与金黄色葡萄球菌、枯草芽孢杆菌基本一致[16-17]。
2.2.2 抑菌试验结果 从表2可知,优化试验组的抑菌效果普遍好于未优化的试验组。其中,对金黄色葡萄球菌抑菌效果最好的是发酵第2 天的LR 优菌液与PF 优的清液;对大肠埃希氏菌抑菌效果最好的是发酵第2 天的PS 优菌液与PS 优清液;对Bacillus 抑菌效果最佳的是发酵第2 天的PS 优菌液与LR 优清液。经过比较发现发酵第2天的PS 优菌液是所有试验组中抑菌效果最好的一组[20-21]。
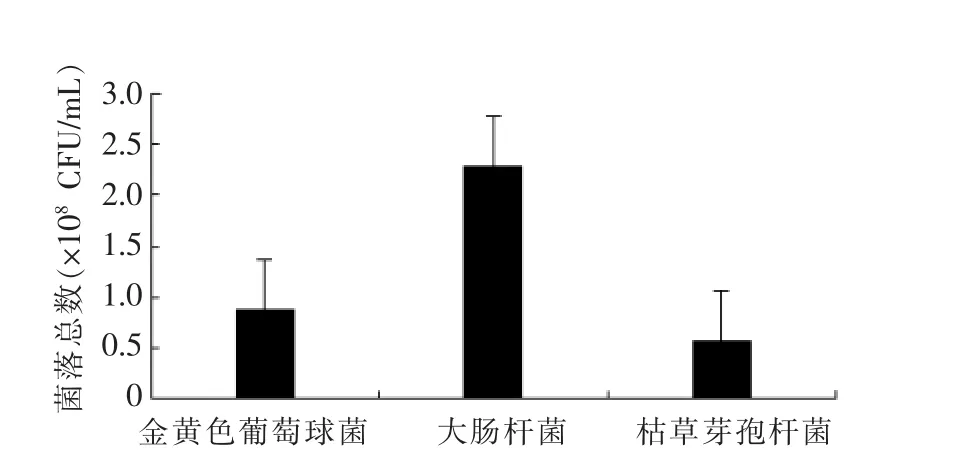
图1 指示菌活菌数Fig.1 The number of live indicator bacteria

表2 抑菌剂抑菌试验抑菌圈直径Table 2 The circle diameter of inhibiting bacteriostatic experiment
2.3 豆腐保质期试验结果
2.3.1 抑菌剂回加豆腐pH 值 豆腐中主要的致病菌为枯草芽孢杆菌,因此我们选择将发酵2 d的PS 优菌液与LR 优清液回加入到豆腐中,室温放置3 d[18-19],测定每天的pH 值(表3)可知pH 均明显增大,而到第3 天时pH 大部分超过7,因此可以基本断定抑菌剂活性消失。
2.3.2 抑菌剂回加豆腐抗菌性结果 由表4可知,通过豆腐黄水发酵制得的抑菌剂回加入豆腐后,LR 优清与PS 菌液均有较好的抗菌效果,无论是对空气中其他微生物的抑菌作用还是当加入枯草芽孢杆菌作为指示菌时,PS 菌液抑菌效果均优于LR 清液。稳定性试验与抑菌效果试验中,第3天的抑菌效果较第2 天并没有明显减弱,甚至进一步加强。加入抑菌剂的豆腐其保质期相对市售豆腐保质期延长了2 d。
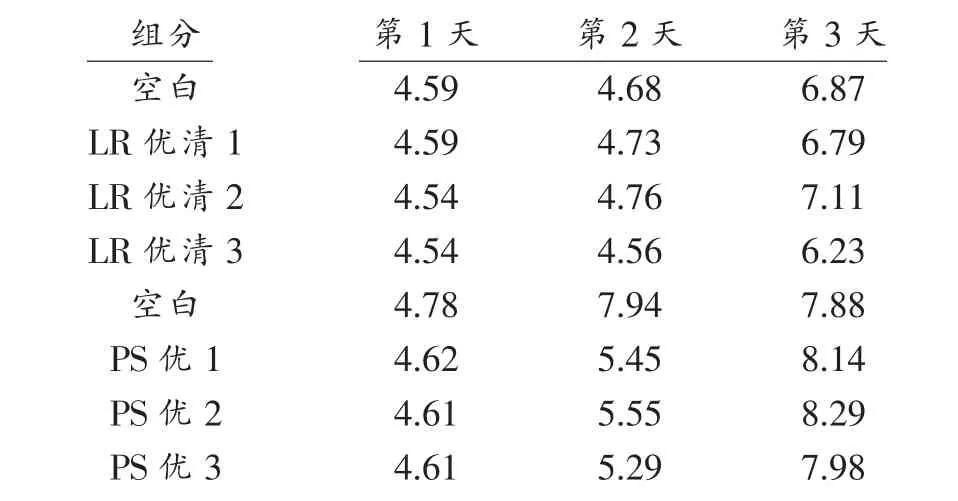
表3 抑菌剂回加豆腐3 d pH 值Table 3 Bacteriostatic agent to add tofu pH for three day
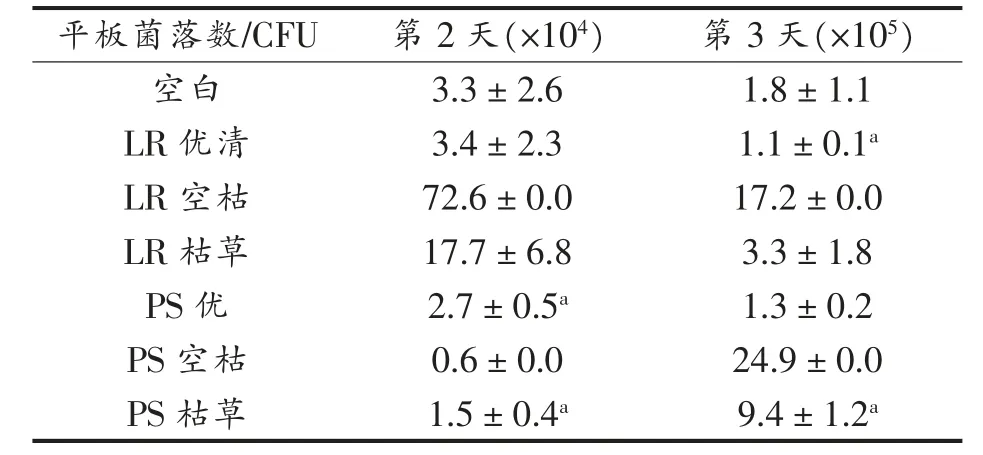
表4 抑菌剂回加豆腐平板菌落数Table 4 Bacteriostatic agent to add tofu plate colony count
2.4 菌落总数与各品质指标的相关性分析
豆腐在25 ℃下微生物指标和理化指标随着贮藏时间的延长而不断变化,由表5中pearson 相关系数可以确定各腐败指标之间的关系。当P=0.05 时,各个指标中菌落总数与pH 值极显著相关,并且相关系数在0.85 以上,因此可以看出菌落总数是影响豆腐品质的重要因素。

表5 豆腐在25 ℃下各品质指标的Pearson相关系数 (P=0.05)Table 5 Pearon correlation coefficient of quality characteristics of tofu at 25 ℃(P=0.05)
3 结论
试验前期,根据文献查阅资料,优化PS、PF、LR 3 种微生物的发酵条件,通过比较优化试验组与未优化试验组的理化指标以及相应的抑菌效果,初步断定出优化后发酵2 d 的PS 菌液对3 种指示菌具有较好的抑菌效果。后将抑菌剂喷洒至豆腐,无论是未加指示菌的组别还是加入了枯草芽孢杆菌作为指示菌的试验组别,发现PS 菌液的抑菌效果优于LR 清液。且豆腐加入抑菌剂后延长其保质期2 d。因此优化发酵2 d 的PS 菌液综合考虑适合作为一种新型抑菌剂加入豆腐中。
