大豆分离蛋白溶液/乳液酸化过程的微观流变学研究
2019-05-18吕瑞鹤苏春霞冯有楠方亚鹏
叶 晶 吕瑞鹤 苏春霞 冯有楠 李 静 杨 楠,2,3* 方亚鹏,2,3
(1 菲利普斯亲水胶体研究中心 生物工程与食品科学学院 湖北工业大学 武汉430068 2 工业发酵湖北省协同创新中心 湖北工业大学 武汉430068 3 湖北省食品胶体国际科技合作基地 湖北工业大学 武汉430068)
微流变学是近年来在国际上发展起来的新兴技术,主要是利用观察置于样品中的探测粒子(或称示踪粒子)在热涨落或外力(电、磁等作用力)作用下的微小尺度上的运动,来研究复杂流体微观流变学特性[1-2]。根据控制力的不同,微观流变学可以分为主动微流变学和被动微流变学。主动微流变学中示踪粒子的运动通过外加力场来控制,比如电场或者磁场[3-7],而被动微流变学中示踪粒子只是在热涨落驱动力下的热运动。这些运动可以利用显微镜成像或者光散射技术进行观察,通过记录和统计分析,得到粒子运动的均方位移、微观模量、微观黏度等微观流变学参数[8-9]。相对于传统流变学,微观流变学有很多优点,比如试验所需样品量少,频率范围大,可测不均一的材料等。微流变学的应用涉及物理、化学、统计、显微技术以及图像分析等,在软物质领域倍受人们重视,被逐渐应用到胶体科学、生物、医药、食品等领域[2,10]。
大豆分离蛋白 (Soybean protein isolate,SPI)是从大豆油脂工业副产物——豆粕中提取出的一种蛋白质。作为一种重要的食品工业原料,大豆分离蛋白具有多种优良的功能特性,例如凝胶性、乳化性、起泡性、持水性、吸油性、黏弹性等。在传统食品加工中,大豆分离蛋白的凝胶特性占据着重要位置,它使大豆分离蛋白具有较高的黏度、弹性和可塑性,既可作水的载体,也可作风味剂、糖及其它配合物的载体。生活中常见的豆腐即利用硫酸钙(CaSO4)或葡萄糖醛酸内酯(Glucono deltalactone,GDL)诱导大豆分离蛋白凝胶得到的产品。对于大豆分离蛋白稳定的乳液体系,因大豆分离蛋白以及乳滴间的相互作用而产生凝胶行为。乳液的凝胶行为影响乳液的稳定性,并赋予产品特殊的质构特性,因此对大豆分离蛋白及其稳定的乳液的凝胶行为的研究具有非常重要的意义。近年来,已有诸多学者应用不同研究手段,从多个方面对大豆分离蛋白的凝胶性质及乳化性质进行研究[11-17]。然而,目前还未有将微流变学手段与宏观流变学手段结合研究大豆分离蛋白溶液及乳液酸化过程的报道。
本试验中采用粒子示踪微流变学方法来研究大豆分离蛋白溶液/乳液酸化过程中微观尺度下的流变学性质,并与宏观流变学结果进行比较,阐述其溶液及乳液酸致凝胶的形成和发展。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,实验室自提;中链甘油三酯(MCT),马来西亚KLK OLEO 公司;葡萄糖醛酸内酯(GDL),日本TCI 公司;聚苯乙烯荧光微球,美国Thermo Fisher 公司。
1.2 仪器与设备
Direct Q3 型超纯水机,美国Merck Millipore公司;EL204 分析天平,梅特勒-托利多仪器 (上海)有限公司;DELTA320 型pH 计,梅特勒-托利多仪器(上海)有限公司;磁力搅拌器,上海司乐仪器有限公司;PT-MR 2100 型高速剪切匀浆机,瑞士Kinematica 公司;M-110L 型高压纳米微射流,美国Microfluidics 公司;Haake Rheostress 6000型旋转流变仪,美国Thermo Fisher 公司;XH-B型漩涡混合器,江苏康健医疗用品有限公司;Olympus IX73 荧光显微镜,日本奥林巴斯公司;Zyla 553-taps CMOS 高速相机,英国Andor 公司;ORION 4 STAR pH 计,梅特勒-托利多仪器(上海)有限公司;Zetasizer Nano-ZS 型纳米粒度及电位分析仪,英国Malvern 公司。
1.3 方法
1.3.1 大豆分离蛋白的提取 试验中使用的大豆分离蛋白通过“碱溶酸沉法”制备,具体步骤如下:1.将脱脂豆粕粉碎(1 min)过筛(80 目)与蒸馏水按质量比1 ∶10 混合,用NaOH 调节至pH 9,充分搅拌(2 h,室温),离心分离(5 000 r/min,30 min),收集上清液;2.用HCl 调节上清液至pH 4.4~4.6,沉淀得到蛋白,离心分离 (5 000 r/min,30 min),收集沉淀;3.将沉淀与蒸馏水按质量比1 ∶10 重新溶于蒸馏水中,调节至pH 7,室温,磁力搅拌至充分溶解(此过程中需不断调节维持pH 7±0.5),最后搅拌过夜;4.按质量比为万分之二加叠氮化钠防腐,进行透析(8 000 u,2 d,冰水浴);5.-24 ℃快速冷冻;6.进行冷冻干燥,得到蛋白样品。用烘干称重法对产量进行表征,大豆分离蛋白产量为83%。用电泳对蛋白成分进行了表征,主要含有分子质量为81,72 和51 ku 的7S,和分子质量为41,37.5,19.6,16 ku 的11 S 大豆分离蛋白,符合试验要求。
1.3.2 大豆分离蛋白溶液的制备 将一定质量的SPI 粉末溶解于超纯水中,在室温下低速充分搅拌过夜至充分溶解,最终得到质量分数为2%和2.5%的蛋白溶液备用。
1.3.3 大豆分离蛋白乳液的制备 取适量质量分数为2.5%的蛋白质溶液,加入适量MCT,配制得到含油量为20%,SPI 浓度为2%的混合液。将该混合液利用高速剪切乳化机在26 000 r/min 下预乳化3 min,利用高压纳米均质机将预乳化液进行均质,75 MPa 下循环两次制备得到新鲜乳液。整个过程在冰水浴下进行。基于前期预试验及文献查阅,选择此浓度是由于在此油相浓度与蛋白浓度下,乳液凝胶过程中油相和蛋白质的作用均有较好的体现。
1.3.4 大豆分离蛋白溶液/乳液酸化过程中pH变化的测定 分别向1.3.1 节和1.3.2 节配制好的蛋白溶液和乳液中,准确添加适量GDL (SPI 与GDL 质量比为1 ∶2)。GDL 在水溶液中水解为葡萄糖酸,形成葡萄糖酸和葡萄糖酸内酯的平衡溶液,葡萄糖酸释放的H+使溶液酸化。其水解过程和酸化过程可以使用pH 在线检测装置监测pH的连续变化。从加入GDL 固体粉末开始计时,磁力搅拌1 min 后,迅速放入ORION 4 STAR pH计,连续测定6 000 s 内SPI 溶液以及SPI 乳液样品在酸化过程中pH 值随时间的变化,并记录下出现第一个数据点的时间。测定温度为25 ℃±0.5℃。
1.3.5 大豆分离蛋白溶液/乳液酸化过程中聚集体粒度的测定 利用Zetasizer Nano-ZS 型纳米粒度及电位分析仪对样品粒度及粒度分布进行测定。进样前将样品轻微振荡摇匀,并稀释至0.1%,用移液枪移取1 mL 稀释后的样品加至样品池。试验中均使用超纯水作为分散剂。
1.3.6 大豆分离蛋白溶液/乳液酸化过程中宏观流变学表征 SPI 溶液和乳液样品酸化过程中黏弹模量随时间t 的变化由旋转流变仪测定。取适量样品,加入准确称量的GDL 固体粉末并开始计时,磁力搅拌1 min 后迅速加样至流变仪夹具上,进行小振幅振荡时间扫描,并记录下出现第一个数据点的时间。转子型号为圆筒(Z41),频率设定为1 Hz,固定应变为1%(此应变位于样品线性黏弹区内),扫描时间6 000 s,每30 s 采点一次,温度控制在25.0 ℃±0.5 ℃。
1.3.7 大豆分离蛋白溶液/乳液酸化过程中微观流变学表征 使用载玻片切割得到3 片适宜大小的小玻璃片,用紫外固化胶牢固贴于另一载玻片上,得到U 型槽,并用盖玻片密封。将直径为1 μm 的荧光小球(激发波长540 nm,发射波长630 nm)按照体积浓度为5×10-5(V/V)加入至样品中,再加入准确称量的GDL 固体粉末,并开始计时,迅速密封,置于旋涡振荡器上振荡30 s 后,取适量装入载玻片的U 型槽并小心排出气泡,之后用绝缘硅脂密封,置于荧光显微镜玻片台上进行数据采集,并记录下采集每一组数据的时间。荧光小球的运动由CCD 相机记录,拍摄帧速为每秒15 张,拍摄时长为34 s。试验温度为25 ℃±0.5 ℃。被记录下来的图片由Matlab 程序进行处理,得到示踪粒子运动的均方位移 (mean squared displacement,MSD)[18-19]。试验中对附着在玻璃片上的固定示踪粒子也进行了分析,得到体系的系统误差为MSD 等于0.004 μm2。
对于牛顿流体,在其中运动的示踪粒子MSD(用Δr2(t)表示)满足Stokes-Einstein 关系:

m 为双对数坐标下MSD 曲线对时间的斜率。对粒子在牛顿流体中的扩散运动,m=1;对亚扩散运动,0<m<1;在纯弹性介质中运动被限制,m=0;而对超扩散运动,m>1。Mason 等[23]推广了Stokes-Einstein 方程至黏弹性牛顿流体,并给出了模量的计算方法:
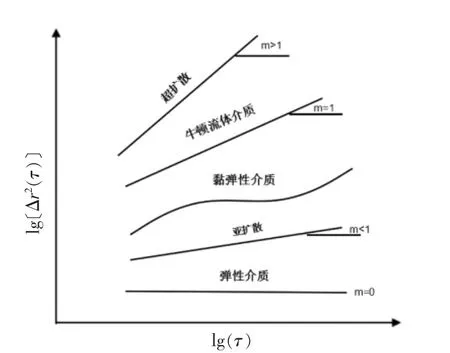
图1 典型流体的均方位移与时间关系示意图[24]Fig.1 Typical mean-squared displacement curves of embedded microspheres as a function of lag time τ in different media
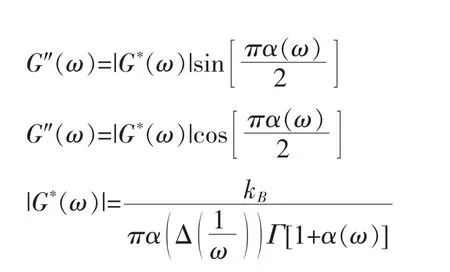
其中G″与G′分别为介质的黏性模量和弹性模量;α(ω)为MSD 在频率空间(ω=1/t)幂指数;Γ为拉普拉斯算符。
2 结果与分析
2.1 大豆分离蛋白溶液/乳液酸化过程中聚集体粒度
不同pH 值下的SPI 溶液/乳液粒度,如图2所示。可以看出,随着pH 的减小,SPI 溶液/乳液的粒度均呈现先增大后减小的趋势,说明存在一定聚集体的形成与破坏。SPI 溶液在pH=4.2 时,溶液聚集体粒径达到最大,而对于SPI 乳液,当pH=4.7时,乳液聚集体粒径达到最大。
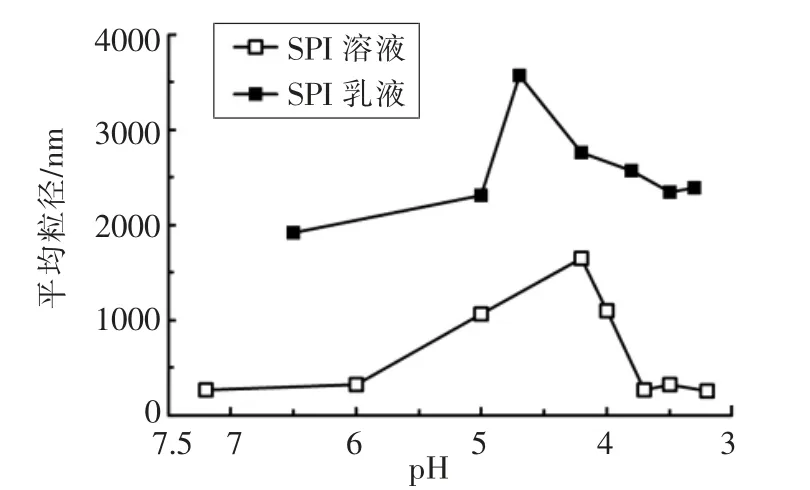
图2 SPI 溶液/乳液不同pH 值下聚集体粒度Fig.2 Size of aggregates in SPI solution/emulsion at different pH values
2.2 大豆分离蛋白溶液酸化过程宏观/微观流变学结果
2.2.1 宏观流变学 图3给出了旋转流变仪测得的SPI 溶液酸化过程中剪切模量的变化。由图3(a)可以看出,体系的弹性模量G′在酸化过程中呈现出迅速上升,并且达到最大值,之后又出现明显降低。由纵轴对数坐标图3(b)可以看到,酸化开始时,很短的时间内体系就表现出G′大于G″,溶液呈现凝胶状态,直至酸化进行到约2 600 s时,模量出现交点,G′开始小于G″,SPI 凝胶发生解凝。

图3 SPI 溶液酸化凝胶过程中宏观模量随酸化时间的变化Fig.3 Development of macro-modulus of SPI solution during acid-induced gelation process
2.2.2 微流变学

图4 示踪粒子在SPI 溶液酸化凝胶过程中的MSDFig.4 MSD of tracer particles during acid-induced gelation process of SPI solution
2.2.2.1 均方位移曲线 图4给出了示踪粒子在SPI 溶液酸化过程中时间分别为0,1 020,2 159,3 145 及5 259 s 的均方位移曲线(MSD)。可以看出,SPI 溶液体系在0 s 时,MSD 与时间成线性关系,即双对数坐标系中MSD 对时间斜率为1,说明粒子在溶液中表现为自由扩散;酸化进行到1 020 s 时,MSD 出现平台区,示踪粒子在短时的扩散被强烈限制,MSD 斜率为0,溶液表现出黏弹性;随着酸化的继续进行,2 159 s 时,样品中示踪粒子的MSD 值又升高,双对数坐标中MSD 斜率升高,即黏弹性又出现降低;在3 159 和5 259 s时,MSD 斜率继续增大,斜率接近于1,但小于1,示踪粒子运动相对自由。
2.2.2.2 连续位移相关函数 从示踪粒子的连续位移相关函数(x12)(图5)可以看出示踪粒子的运动在不同酸化时间是不同的。连续位移相关函数的定义是位移矢量r12在前一时间的位移矢量r01方向的投影。如果粒子运动是随机的,则(x12)等于0;如果粒子的运动受到周围介质的限制,则r12与r01具有很强的相关性,表现为(x12)为负值[10]。因此(x12)表征的是示踪粒子在样品中运动受限制的程度。尖括号表示对系综平均。由图5可以看出,0 s 时,(x12)值在0 附近,即r12和r01不存在相关性,示踪粒子在样品中的运动不受限制,溶液表现为牛顿流体行为;在酸化进行到1 020 s 时,(x12)为负值,即r12和r01存在强负相关性,即示踪粒子运动受到强烈限制,体系表现出黏弹性行为;在酸化继续进行到2 159 s 时,(x12)依旧为负值,r12和r01存在一定的负相关性,即示踪粒子运动依旧受到一定程度的限制;随着酸化的继续进行,体系在3 145 s 及5 259 s 时(x12)值又回到0 附近,即示踪粒子运动受到限制的作用减弱,体系表现出接近牛顿流体的行为。
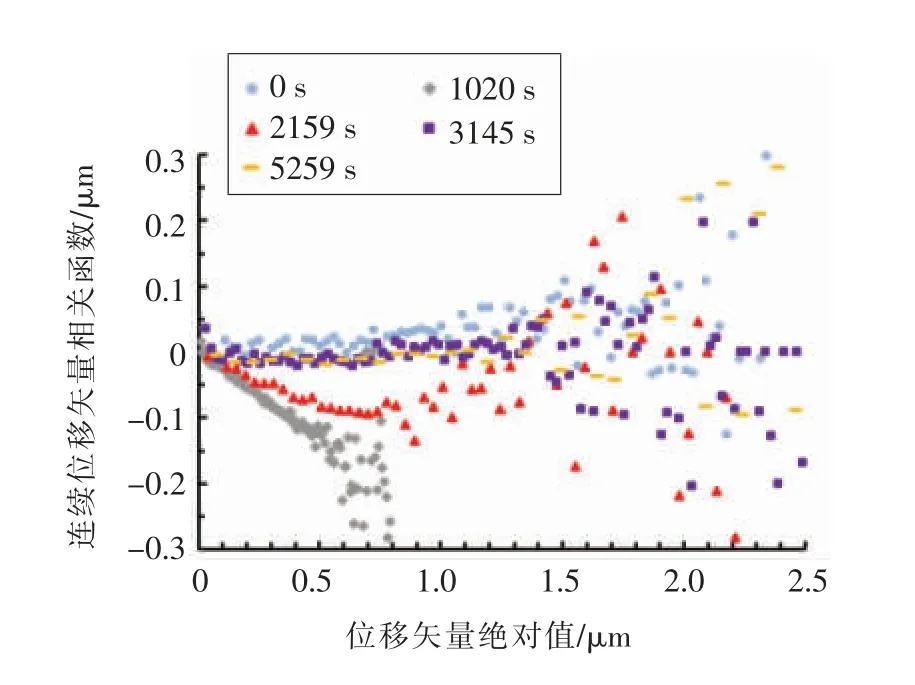
图5 SPI 溶液酸化凝胶过程中不同时间点的示踪粒子连续位移相关性Fig.5 Corelation between the successive displacements of probe particles at different times during acid-induced gelation process of SPI solution

图6 SPI 溶液酸化凝胶过程中不同时间点的微观模量Fig.6 The micro-modulus of SPI solution at different times during acid-induced gelation
2.2.2.3 微观模量 图6给出了SPI 溶液酸化过程中分别在0,1 020,2 159,3 145 及5 259 s 时刻的微观模量。可以看出,体系在0 s 时,G″>G′,即样品呈黏性流体行为;在酸化进行到1 020 s 时,G′与G″出现交点,G′>G″,样品表现出黏弹性行为;随着酸化的继续进行,2 159 s 时样品模量降低,且开始G″>G′,在3 145 s 及5 259 s 时,完全G″>G′,体系表现出接近流体行为。
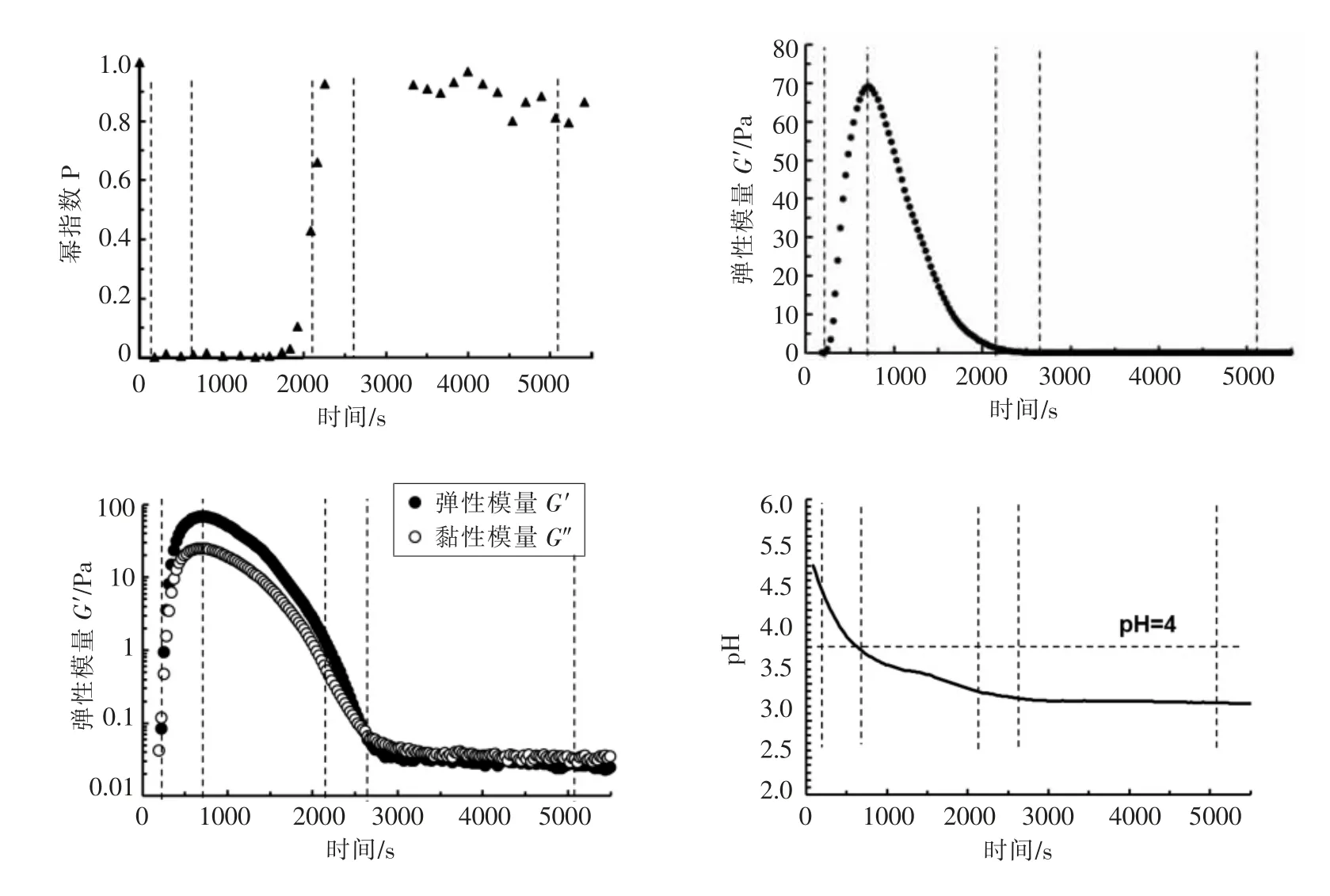
图7 SPI 溶液酸化凝胶过程微/宏观流变学结果比较Fig.7 Comparison of micro-/macro-rheology results of SPI solution during acid-induced gelation process
2.2.3 微观/宏观流变学结果比较与分析 利用MSD 与时间的幂数关系式(Δr2(t))∝tp计算得到酸化时间段内不同时刻样品的幂指数p,即在双对数坐标中MSD 对时间的曲线斜率。将P 值变化与宏观模量变化、pH 变化进行比较,如图7所示。可以看到,(1)当体系pH 值下降到SPI 等电点(pH 4.4)附近时,SPI 溶液体系的凝胶强度达到最大。这是因为当体系的pH 值在蛋白质等电附近时,蛋白质表面电荷被中和,蛋白质与蛋白质之间发生强烈的相互作用,聚集形成一定的网络结构。(2)在酸化初期,微观流变学与宏观流变学观察到的SPI 溶液凝胶点相近。但随pH 继续下降,宏观流变学观察到G′与G″的交点,约为2 600 s,晚于微观流变学观察到的P 值开始回到0.8 附近的时间2 300 s,这说明微观流变学对于体系解凝过程中黏弹性结构的变化更敏感。Stefan Schuldt 等人[13]也观察到SPI 溶液在GDL 诱导酸化过程中类似的宏观模量变化。他们通过控制SPI 与GDL 的比例,酸化一定时间后,使体系pH 稳定在4.5 与3.6,分别将体系的凝胶离心,取上清液进行电泳分析,发现,pH=3.6 的样品的上清液中存在较多的多肽物质,说明了等电点后pH 值的持续降低带来的模量的下降是由于凝胶网络中蛋白质的解聚。这里微观流变学观察到SPI 溶液在酸化后期,MSD 的P 值未回到P=1 处,说明体系中仍存在一定黏弹性结构。(3)凝胶形成过程中,可以由宏观流变学清晰地看到凝胶体系模量值的变化,而微流变学在凝胶强度较大时示踪粒子运动强烈受限,P 一直处于接近于0 的状态,无法准确给出G′和G″;但在酸化后期,体系模量较低,宏观流变学此时不能检测到准确的模量值,而微观流变学可以计算得到。两种流变学方法的试验结果可以互为补充互相分析。
2.3 大豆分离蛋白乳液酸化过程宏观/微观流变学
2.3.1 宏观流变学结果 图8给出了旋转流变仪测得的SPI 乳液酸化过程中宏观模量的变化。由图8(a)可以看出,体系的G′在酸化过程中也呈现出迅速上升并且逐渐达到最大值,之后又出现明显降低。由纵轴对数坐标图8(b)可以看到,体系在仪器检测到的时间段内,G′一直大于G″,只是强度随时间呈现出先升高至最大值再下降的变化趋势。
结合酸化过程中pH 值的变化可以发现,体系G′在pH 为4.7 附近即达到最大,高于SPI 的等电点。这可能是由于乳滴的存在,导致了SPI 乳液乳滴及SPI 聚集体在较高的pH 下形成网络结构,达到体系凝胶最大强度。
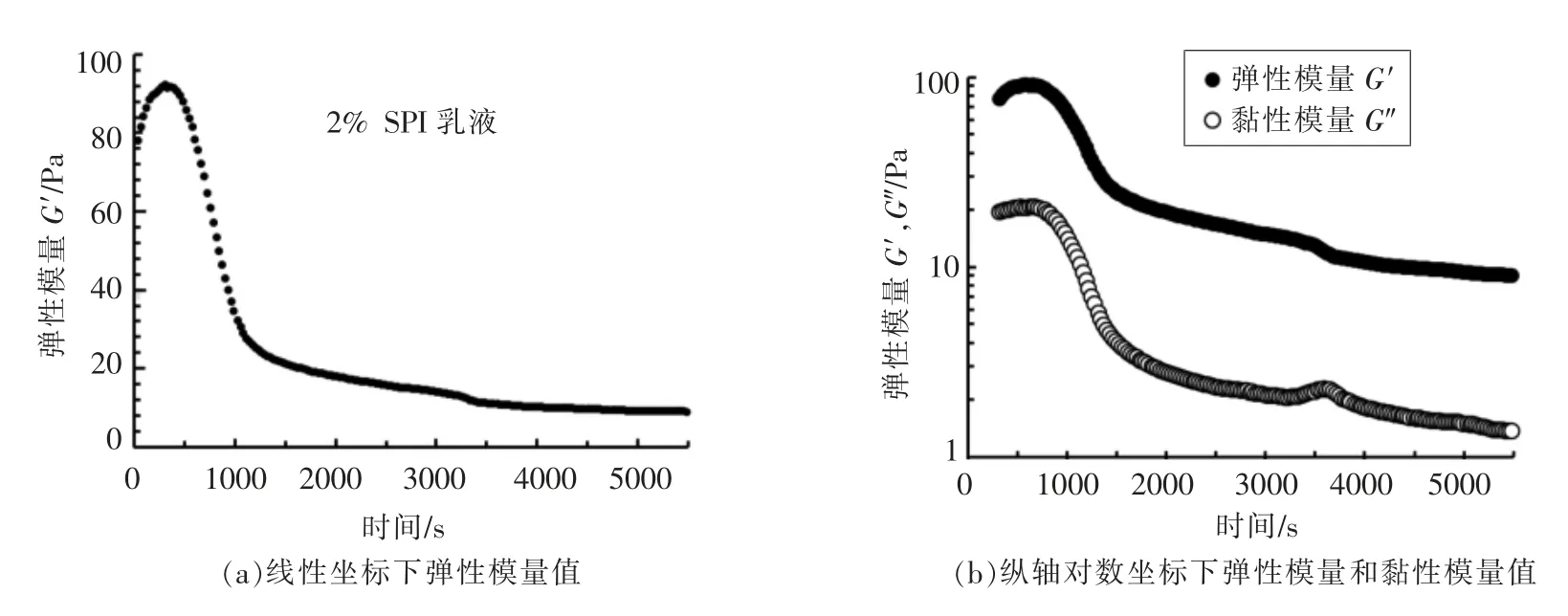
图8 SPI 乳液酸化凝胶过程中模量的变化Fig.8 Development of modulus of SPI emulsion during acid-induced gelation process
2.3.2 微流变学结果
2.3.2.1 均方位移曲线 图9给出了时间分别为0,1 084,2 160,3 135 及5 159 s 的示踪粒子在SPI乳液酸化过程中的均方位移曲线。可以看出,体系在0 s 时,MSD 对时间斜率略小于1,说明粒子在溶液中运动相对自由;酸化进行到1 084 s 时,MSD 出现平台区,示踪粒子在短时的扩散被强烈限制,MSD 斜率为0,溶液表现出黏弹性;随着酸化进行至2 160 和3 135 s,MSD 值依旧表现出强烈的黏弹性;在5 159 s 时,MSD 对时间的斜率升高,但小于1,示踪粒子在乳液中表现出亚扩散的行为。
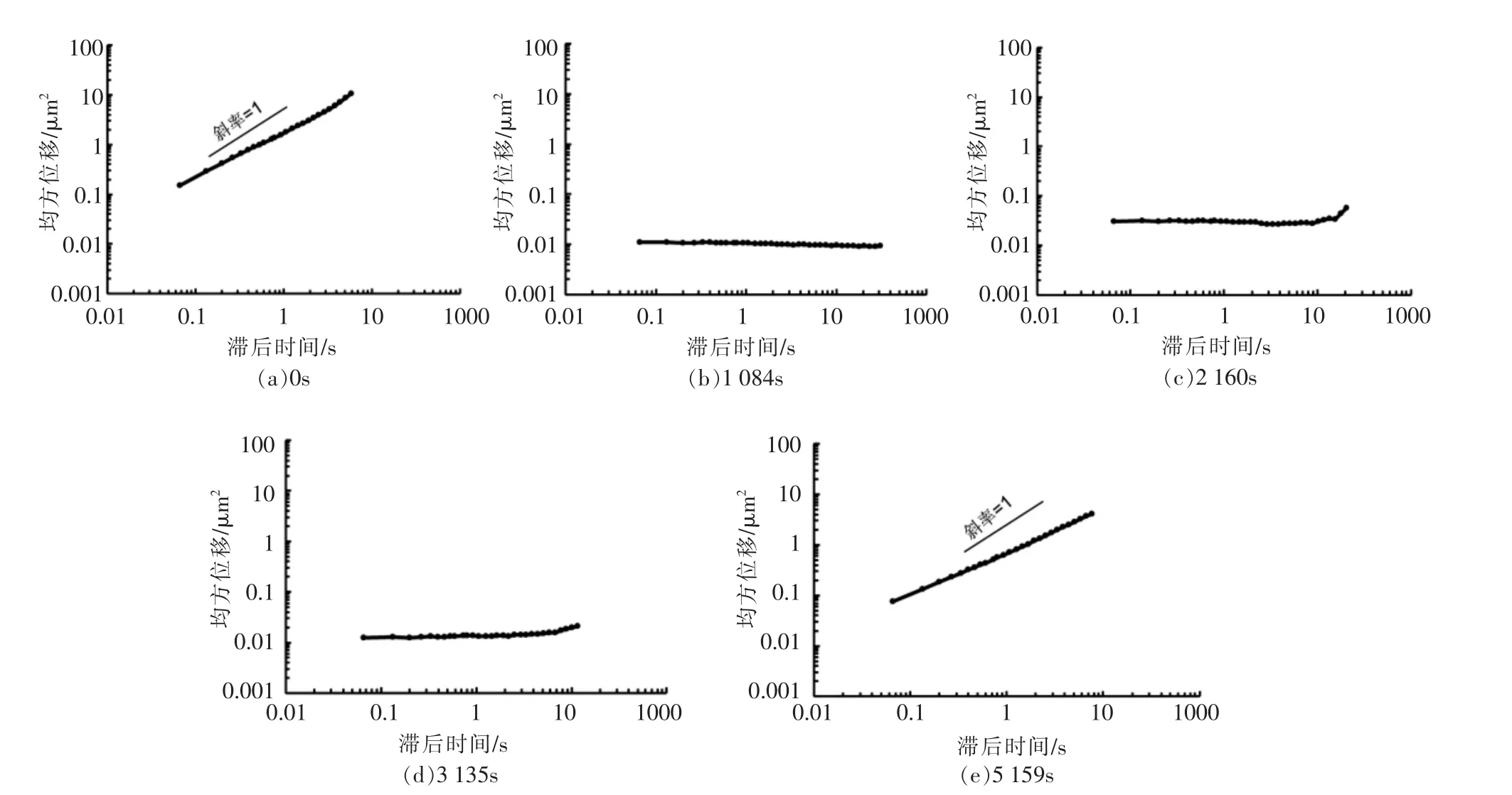
图9 示踪粒子在SPI 溶液酸化凝胶过程中的MSDFig.9 MSD of tracer particles during acid-induced gelation process of SPI emulsion
2.3.2.2 连续位移相关函数 图10给出了SPI 乳液中示踪粒子的平均连续位移相关函数(x12)。0 s时,(x12)在0 附近,说明此时示踪粒子运动为扩散性,在随后的几个特征时刻1 084,2 160,3 135 及5 159 s,(x12)<0,即r12和r01存在负相关性,说明示踪粒子运动均受到限制。特别在5 159 s 时,仍有(x12)<0,说明r12和r01仍存在负相关性。但SPI 溶液在相近时刻,r12和r01不存在负相关性(图5),说明5 159 s 时刻,SPI 乳液体系有相对更强的网络结构残留。这与体系P 值变化一致(图12)。
2.3.2.3 微观模量 图11给出了酸化过程中样品分别在0,1 084,2 160,3 135 及5 159 s 时刻的微观模量。可以看出,体系在0 s 时,样品G″>G′,即体系表现为流体行为;在1 084 s 及2 160 s 时,G′>G″,样品弹性行为占主导;至3 135 s,样品依旧表现出弹性行为占主导,但此时G″增大;在5 159 s 时,G″>G′,样品又表现出黏性流动占主导的现象。

图10 SPI 乳液酸化凝胶过程中不同时间点的示踪粒子连续位移相关性Fig.10 Correlation between the successive displacements of probe particles at different times during acid-induced gelation process of SPI emulsion
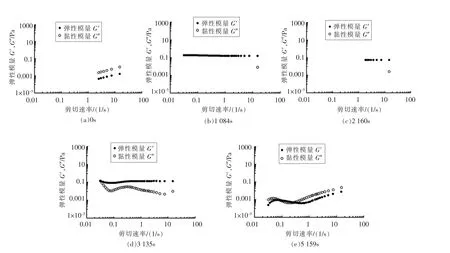
图11 SPI 乳液酸化凝胶过程中不同时间点的微观模量Fig.11 The micro-modulus of SPI emulsion at different times during acid-induced gelation
2.3.3 宏观/微观流变学结果比较与分析 大豆分离蛋白乳液酸化过程中P 值变化、 宏观模量变化、pH 变化对比如图12所示,可看到,(1)体系pH 值下降到高于SPI 等电点时,乳液体系的凝胶强度即达到最大,与单纯SPI 溶液体系在SPI 等电点附近模量达到最大不同。由于乳液主要是靠油滴表面蛋白质的静电相互作用和空间位阻来稳定的,酸化过程中不断释放的H+屏蔽掉了蛋白质表面的电荷,降低了蛋白之间静电排斥作用,一方面使得蛋白质之间相互聚集,另一方面乳滴之间也会发生聚集,整体使得SPI 乳液体系在高于蛋白质等电点即可形成网络结构,达到凝胶强度最大。(2)酸化过程,宏观流变观察到G′与G″表明乳液体系在检测时间内一直处于凝胶的状态,只是强度随时间呈现出先升高再下降的变化趋势。而微流变学结果显示体系P 值由0 s 时接近0.9,先下降至0 附近,后又升高至0.8 左右,即体系黏弹性先升高后降低。且由示踪粒子连续位移相关性看到,乳液体系在经历较长时间后,r12和r01依旧存在负相关性,即酸化后期SPI 乳液体系仍然存在一定的网络结构,这与宏观流变学结果一致。相较于SPI 溶液,由于SPI 溶液体系在经历较长时间后r12和r01不存在明显负相关性,说明在较长时间后SPI 乳液体系有相对更强的网络结构残留。(4)凝胶形成过程中,可以由宏观流变学清晰地看到凝胶体系模量值的变化,而微流变学在凝胶强度较大时P 一直处于接近于0 的状态,示踪粒子运动强烈受限,无法准确给出G′和G″;但在较长时间后,体系模量较低,宏观流变学此时不能检测到准确的模量值,而微观流变学可以计算得到。两种流变学方法的试验结果可以互为补充互相分析。

图12 SPI 乳液酸化凝胶过程微/宏观流变学结果比较Fig.12 Comparison of micro/macro-rheology results of SPI emulsion during acid-induced gelation process
2.4 SPI 溶液/乳液体系酸化过程体系结构变化示意图
由试验结果综合比较分析得到SPI 溶液/乳液酸化过程中微观结构变化,如图13所示。对大豆分离蛋白溶液(图13(a-c)),随着酸化的进行,体系pH 值不断下降,体系中的蛋白质先聚集后又解聚,使得体系的黏弹性发生先升高后降低的变化,由微观/宏观流变学结果均可看出。而特别地,微观流变显示,体系最初状态,P 值约为1,说明蛋白质完全溶解,如图13(a)所示;酸化过程后期,体系的P 值小于1,约为0.8~0.9,说明体系仍存在一定的未解聚的结构,如图13(c)所示。对于大豆分离蛋白乳液(图13(d-f)),随着酸化的进行,体系pH值下降,蛋白质与乳滴发生聚集,随着pH 值的继续下降,聚集结构又发生解聚,使得体系的黏弹性发生变化,也由微观/宏观流变学结果均可看出。但微观流变尤其显示,体系最初状态,P 值小于1,约为0.9,这说明可能由于乳液体系的耗散絮凝,乳滴在初期形成了一定的聚集体,如图13(d)所示;而酸化过程后期,体系的P 值约为0.8,说明体系存在较强的未完全解聚的结构,如图13(f)所示。

图13 SPI 溶液(a)~(c)/乳液(d)~(f)体系酸化过程结构变化示意图Fig.13 Schematic model of micro-structure change of SPI solution (a,b,c)and emulsion(d,e,f)during acid-induced gelation process
3 结论
本研究首次将粒子示踪微流变学手段与宏观流变学手段相结合,研究了大豆分离蛋白溶液及乳液的酸化凝胶过程的流变学性质变化,获得酸化凝胶过程的体系结构变化的微观信息。研究表明,SPI 溶液酸化过程中,蛋白质先聚集后又解聚,体系的黏弹性先增大后减小。由微观流变结果可以看出,酸化过程后期,体系仍存在一定较弱的蛋白质聚集体结构;SPI 乳液酸化过程中,蛋白质与乳滴发生聚集,之后聚集结构又发生解聚,体系的黏弹性先增大后减小。由微观流变可以看出,体系在最初状态,存在一定的乳滴的聚集体,酸化过程后期,体系仍存在一定的未完全解聚的乳滴聚集体和蛋白质聚集体;凝胶过程中两种流变学方法的试验结果可以互为补充。
