cART治疗完全应答HIV-1感染者血浆外泌体对CD8+ T细胞的免疫调节作用及与CD4/CD8比值的相关性
2019-05-17周明菊李华杰黄辉煌徐若男
杨 涛,周明菊,李华杰,黄辉煌,徐若男,施 明
自1981年在美国首次发现HIV-1以来,目前针对HIV-1感染的治疗方案中,联合抗反转录病毒治疗(combination antiretroviral therapy, cART)的效果明确,使艾滋病逐渐转变成慢性疾病。但HIV感染后过度的免疫活化和持续的炎症反应很难通过cART得到有效逆转,表现为艾滋病相关和非相关事件频发[1]。cART可帮助患者免疫重建,恢复CD4+T细胞数量,但CD8+T细胞数量居高不下,导致CD4/CD8比值不能复常[2]。目前研究显示,CD8+T细胞、CD4/CD8比值均应作为评估机体免疫功能的指标。尤其是CD4/CD8比值与机体过度的炎症反应和免疫超活化密切相关[3-6]。CD4/CD8比值复常是一个非常缓慢的过程,越早开始cART(CD4+T细胞计数高),CD4/CD8复常相对越容易[7]。而除了CD4+T细胞的基线水平外,机体中可能还存在其他的免疫因素能够影响CD4/CD8比值复常[6]。
外泌体存在于关节滑液、母乳、血液等体液中,介导细胞间核酸、蛋白质及脂质等生物活性分子的交换,从而影响受体细胞或亲本细胞中的各种生理和病理过程。外泌体具有抗原递呈功能,可以携带或递呈主要组织相容性复合体-抗原复合物来调控抗原特异性CD8+T细胞的免疫应答[8-9]。在HIV感染过程中,外泌体既能保护机体免受病毒感染,又可增强HIV的感染能力[10-14]。已有研究证明外泌体可调节CD8+T细胞功能[15-17]。本研究拟探讨HIV-1慢性感染者接受长期有效cART后的完全应答(complete response, CR)患者血浆中外泌体对CD8+T细胞的潜在作用,及其与CD4/CD8比值的关系,阐述外泌体与HIV感染者炎症反应、持续免疫活化的关系,为艾滋病的临床治疗提供新的研究思路。
1 对象与方法
1.1 对象 纳入2018年2—10月于中国人民解放军总医院第五医学中心爱心门诊随访的HIV-1慢性感染且接受长期有效cART的 CR患者19例。根据CD4/CD8比值将患者分为异常组(CD4/CD8<0.8)10例和复常组(CD4/CD8>0.8)9例。入组标准:参照中华医学会感染病学分会《中国艾滋病诊疗指南(2018版)》[18],入组HIV-1慢性感染的CR患者为接受cART 2年以上,血浆病毒载量持续2年以上低于检测下限(20 copies/ml), CD4+T细胞计数> 350个/μl。排除标准:①当前存在机会性感染;②合并HBV或者HCV等其他病毒感染;③妊娠期妇女或产褥期妇女;④患有精神类疾病或其他严重疾病患者。另以同期5例健康者作为健康对照(healthy control, HC)组。上述研究对象均签署知情同意书,其基本特征见表1。
1.2 方法
1.2.1 血浆外泌体的提取鉴定及粒径分析 将患者血浆样本解冻备用,依据血浆外泌体提取试剂盒要求提取血浆中的外泌体。电镜检测:滴加外泌体悬液至载样铜网上,以2%磷钨酸染液负染外泌体,电镜下观察外泌体形态。粒径分析(nanoparticle tracking analysis, NTA):以PBS缓冲液稀释外泌体,检测外泌体粒径和浓度,利用ZetaView 8.04.02软件分析并记录数据。Western blot鉴定:利用Jurkat细胞系作为对照,鉴定外泌体中标志性蛋白CD63、TSG101和阴性标志性蛋白GM130的表达。
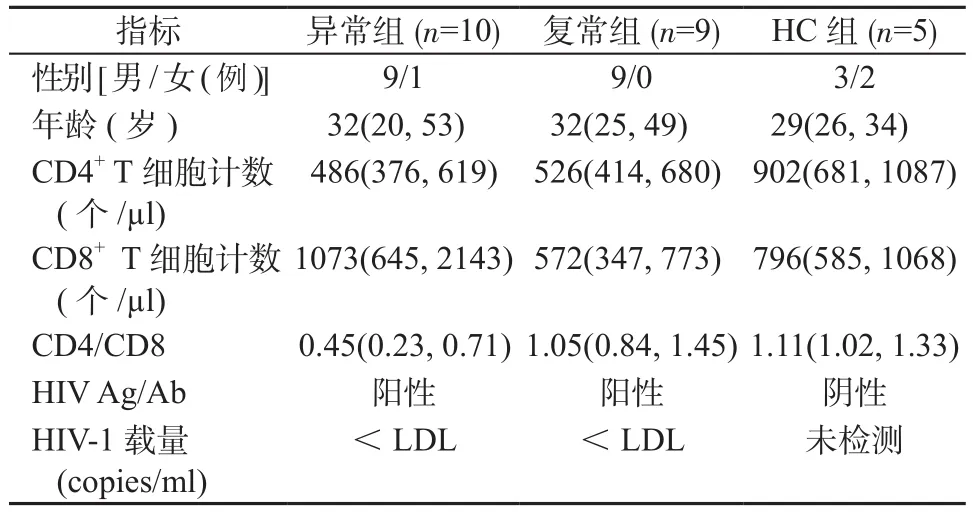
表1 研究对象临床资料Table 1 Clinical data of study subjects
1.2.2 细胞体外培养 获取健康人外周血单个核细胞(peripheral blood mononuclear cell, PBMC),用含10%无外泌体血清的1640培养基重悬PBMC至合适浓度,在24孔细胞培养板中每孔添加100万细胞,各孔加入不同组患者的血浆外泌体,置于5% CO2的37 ℃恒温培养箱,2 h后加入CD3单抗(1 µg/ml)、CD28 单抗(1 µg/ml)和 IL-2细胞因子(200 IU/ml),培养48 h后检测细胞活化和胞内因子水平。
1.2.3 细胞增殖效率检测 获取健康人PBMC,调整细胞浓度,用羟基荧光素二醋酸盐琥珀酰亚胺脂(carboxy fl uorescein diacetate succinimidyl ester, CFSE)标记,无外泌体血清洗去多余染料后用培养基重悬细胞,取少量细胞用流式细胞仪检测标记效率,其余细胞分组与外泌体共培养,60 h后检测细胞增殖效率。
1.2.4 流式细胞染色 表型染色:收集培养后的细胞,PBS洗涤后,加入CD4、CD8及CD38、HLA-DR抗体,避光孵育20 min,PBS洗涤后用1%多聚甲醛固定,24 h内流式细胞仪检测。胞内因子染色:CD4、CD8表型染色后加入细胞破膜剂,混匀,4 ℃静置40 min。破膜洗液洗涤后重悬细胞,加入IFN-γ、IL-2抗体,避光孵育20 min。破膜洗液洗涤细胞后用1%多聚甲醛固定,24 h内流式细胞仪检测。使用FlowJo_V10软件对所有流式数据进行分析。
1.3 统计学处理 应用SPSS 19.0软件对所得数据进行统计学分析,用GraphPad Prism 5.0绘制统计学图形。定量资料符合正态分布用±s表示,多组间比较采用Kruskal-Wallis 检验,相关性分析采用Pearson相关分析。P<0.05表明差异有统计学意义。
2 结 果
2.1 CR患者血浆外泌体的特性分析 在透射电子显微镜下能观察到呈球状或杯状的血浆外泌体,可见明显的封闭膜结构,大小不一,直径约100 nm(图1A)。采用NTA检测血浆外泌体的粒径分布,结果显示其颗粒分布较为集中,峰值约为85 nm(图1B)。Western blot实验显示血浆外泌体表达CD63和TSG101,而不表达GM130(图1C)。
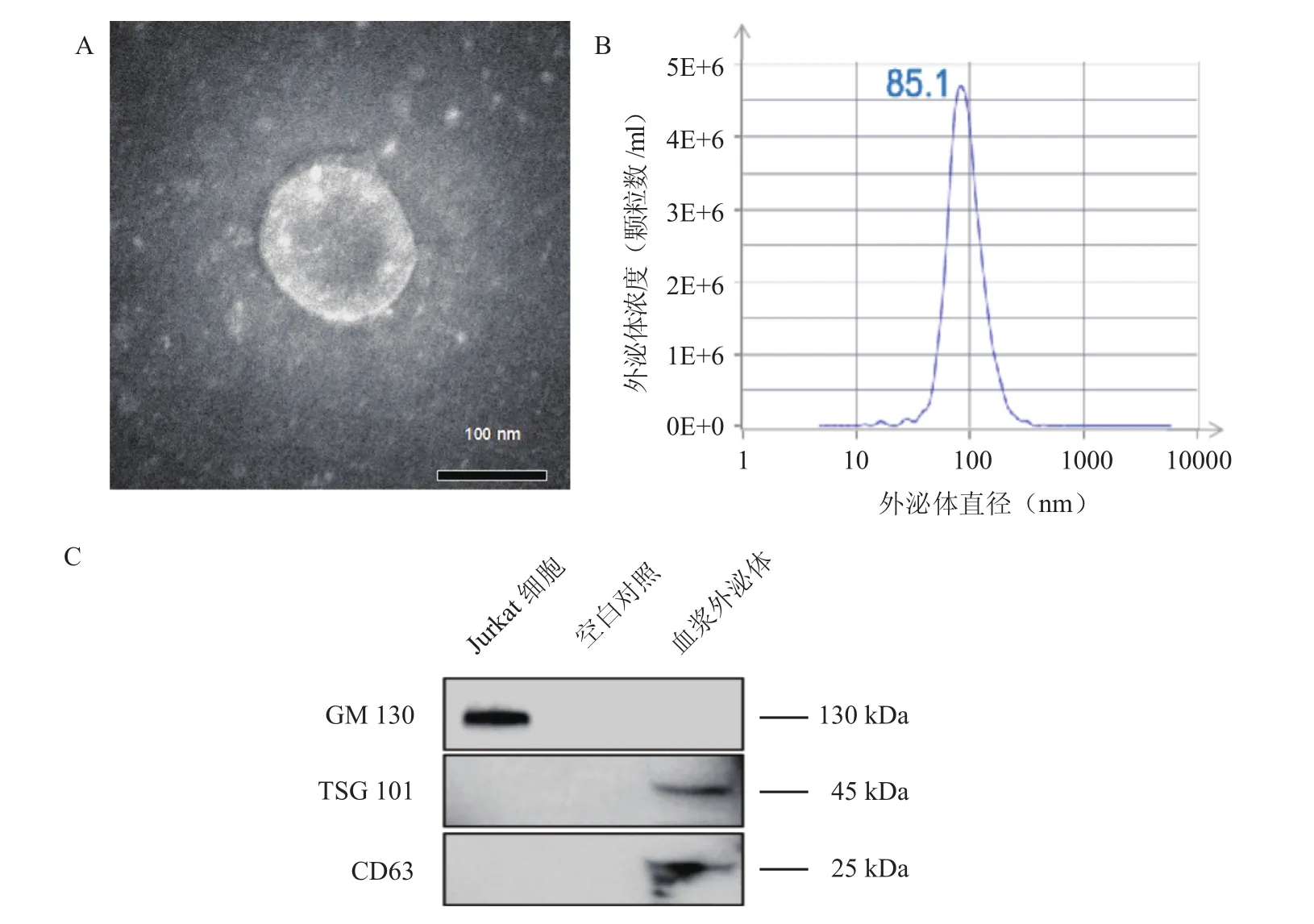
图1 血浆外泌体的鉴定Figure 1 Identification of plasma exosomes
2.2 各组血浆中外泌体的粒径分布与浓度 利用NTA技术检测了3组受试者(每组各5例)血浆中的外泌体浓度,发现3组间外泌体浓度有差异,异常组患者血浆中外泌体浓度显著高于复常组(U=0,P=0.008)和HC组(U=2.000,P=0.032)(表2)。CR患者血浆外泌体的浓度与CD4/CD8比值呈负相关(r=-0.648,P=0.043)(图2)。
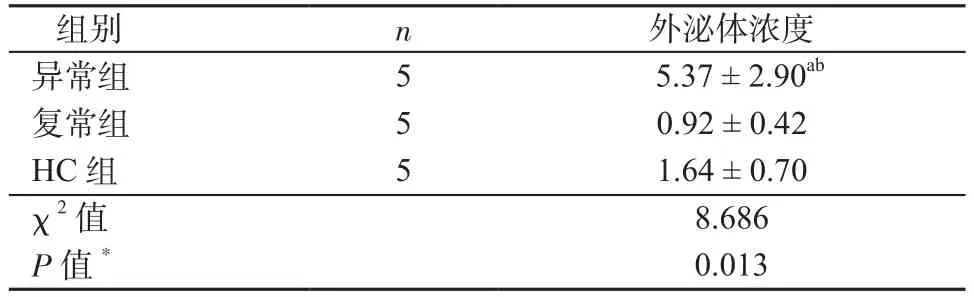
表2 各组外泌体浓度比较(×1011颗粒数/ml)Table 2 Comparison of exosome concentration in different groups(×1011 particles/ml)
2.3 CR患者血浆外泌体对CD8+T细胞的影响
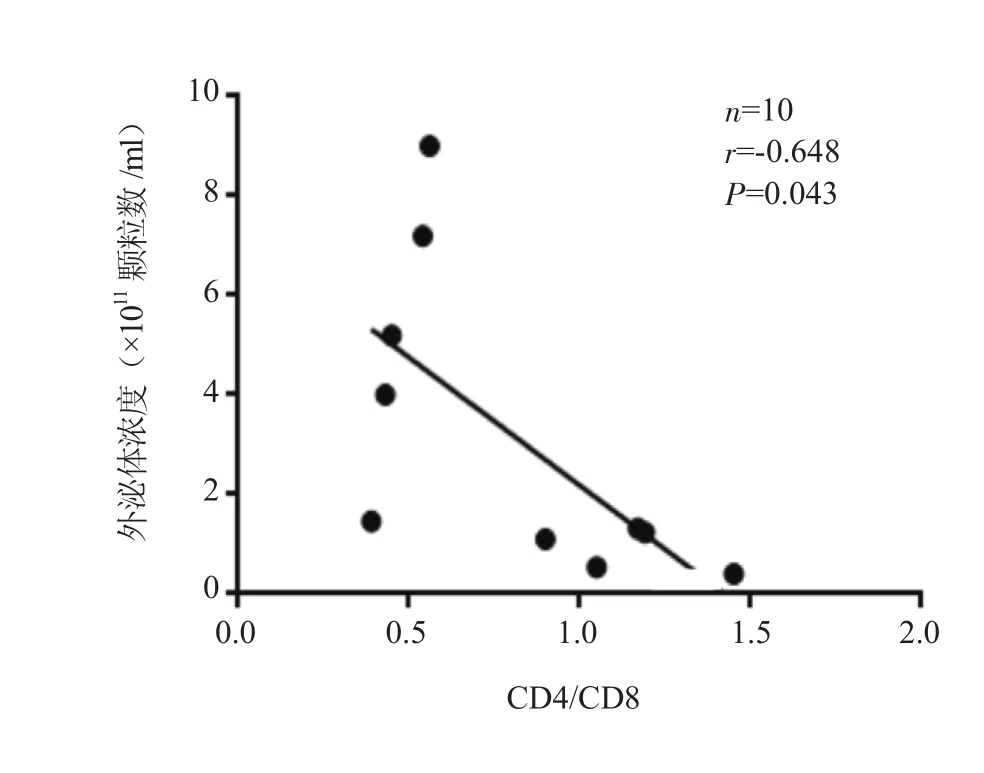
图2 血浆外泌体浓度与CR患者CD4/CD8比值的相关性Figure 2 Correlation between the concentration of plasma exosomes and the CD4/CD8 ratio in CR patients
2.3.1 CR患者血浆外泌体对CD8+T细胞活化的影响 将不同组受试者外泌体(异常组10例,复常组9例,HC组5例)与健康人PBMC共培养,检测外泌体对CD8+T细胞上的CD38和HLA-DR分子的共表达的影响。结果表明3组外泌体对CD8+T细胞活化水平的影响有显著差异,异常组CD8+T细胞表面CD38+HLA-DR+的共表达水平明显低于复常组(U=13.500,P=0.008)和HC组(U=1.000,P=0.001)(表3)。进一步相关性分析显示,CD8+T细胞的活化水平与CR患者CD4/CD8比值呈正相关(r=0.478,P=0.039)(图3)。

表3 外泌体对CD8+ T细胞活化水平的影响(%)Table 3 Effects of plasma exosomes on the activation of CD8+ T cells(%)

图3 CD8+ T细胞活化水平与CR患者CD4/CD8比值的相关性Figure 3 Correlation between the activation of CD8+ T cells and the CD4/CD8 ratio in CR patients
2.3.2 CR患者血浆外泌体对CD8+T细胞分泌细胞因子的影响 通过对胞内细胞因子染色,检测CD8+T细胞内的IFN-γ、IL-2。结果发现3组外泌体对CD8+T细胞分泌细胞因子水平的影响有显著差异,异常组CD8+T细胞分泌IFN-γ的能力弱于复常组(U=17.000,P=0.022)和HC组(U=1.000,P=0.001);此外,异常组CD8+T细胞分泌IL-2的能力也弱于复常组(U=8.500,P=0.001)和HC组(U=4.000,P=0.008)(表4)。CD8+T细 胞分泌IFN-γ和IL-2的水平与CR患者CD4/CD8比值均有显著相关性(r=0.654,P=0.002;r=0.700,P<0.001)(图4)。

表4 外泌体对CD8+ T细胞分泌细胞因子的影响(%)Table 4 Effects of plasma exosomes on the secretion of cytokines from CD8+ T cells(%)
2.3.3 CR患者血浆外泌体对CD8+T细胞增殖的影响 3组受试者的外泌体对CD8+T细胞增殖水平的影响有显著差异,异常组外泌体处理的CD8+T细胞增殖能力弱于复常组(U=0.000,P<0.001)和HC组(U=3.000,P=0.005)(表5)。CD8+T细胞增殖能力与CR患者的CD4/CD8比值呈显著正相关(r=0.716,P<0.001)(图5)。
3 讨 论
CD4+T细胞计数是临床评估艾滋病进展和疾病状态最重要的预测指标,但是该指标不能全面评估HIV感染者体内免疫过度激活的风险。对于CR患者,CD4/CD8比值的高低与疾病发生进展、机体慢性炎症和免疫活化密切相关[3-6]。但目前还不清楚是否存在独立于cART之外的免疫调节效应分子以对抗机体过度的炎症反应。
外泌体作为细胞间信号和物质交流的重要载体,其释放受机体复杂炎症环境的影响,同时可以影响机体的免疫微环境,对疾病进程产生重要影响[19-20]。本研究发现CD4/CD8比值异常的CR患者体内外泌体的浓度明显高于CD4/CD8比值复常患者,且与CD4/CD8比值呈负相关。随着CD4/CD8的复常,外泌体的浓度也明显降低到接近HC水平。由此推测CD4/CD8异常患者体内的慢性炎症状态可能是导致血浆中的外泌体水平升高的重要原因。
本研究发现,来源于CD4/CD8比值异常HIV感染者的血浆外泌体与CD8+T细胞体外共孵育时,CD8+T细胞的活化水平降低,CD8+T细胞分泌IFN-γ和IL-2的能力均受到了抑制,且CD8+T细胞的增殖功能明显减弱,说明CD4/CD8比值异常的HIV感染者体内升高的外泌体水平对机体过度的免疫活化和炎症发挥抑制效应,但是其表达水平升高的主动性和被动性值得我们思考。
此前对外泌体在HIV-1感染中作用的研究主要聚焦于未受感染细胞来源的外泌体对HIV-1感染的抑制,以及感染细胞来源的外泌体增强病毒感染的能力[10-14]。关于外泌体在接受长期有效cART患者免疫重建过程中所发挥作用未见报道。本研究结果提示,在CD4/CD8比值异常的HIV感染者体内,血浆外泌体对CD8+T细胞发挥了较强的免疫抑制效应。近期一些研究表明,对免疫稳态至关重要的调节性T细胞可以分泌具有类似功能的外泌体发挥免疫调节作用,形成免疫抑制性环境[21-22]。在HIV感染过程中,外泌体作为重要的细胞间信号传导和功能分子,在抑制CD8+T细胞的功能方面发挥重要作用,可能是机体应对过够反映经过长期cART的患者体内免疫平衡是否恢复良好。依据现有的结果,可以在后续研究中进行验证和扩展,以利用血浆外泌体作为cART后相关免疫恢复的生物标志物或治疗靶点,为艾滋病的功能性治愈提供新的研究思路。本研究不足之处在于入组患者例数较少,后续研究有待进一步扩大样本量。HIV感染者血浆中存在来自各种组织细胞的许多外泌体亚群,如何区分患者样品中不同细胞来源的外泌体是最主要的挑战,后期的研究将探讨各种未解决的问题。度免疫活化和炎症反应的自身负反馈效应分子。借助自身的主动或者被动性高表达,实现抑制CD8+T细胞过度活化增殖的目的,但其具体效应机制仍须深入研究。
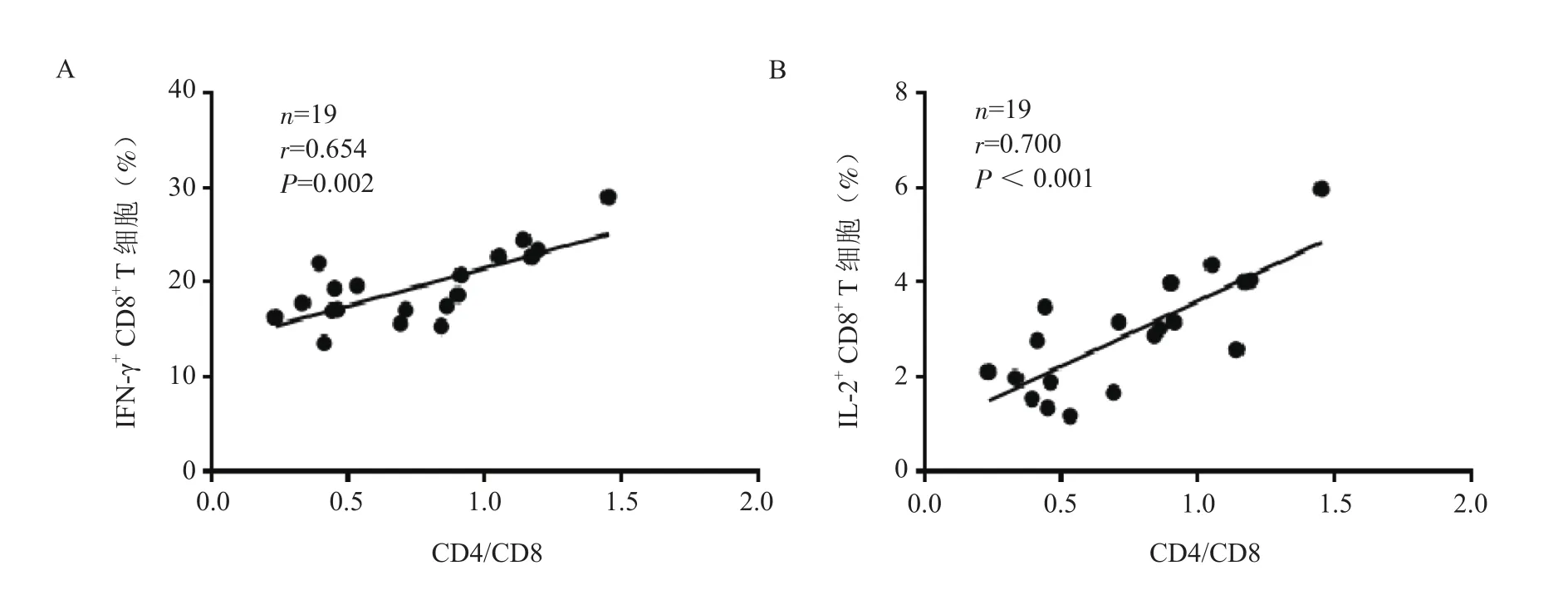
图4 CD8+ T细胞分泌因子水平与CR患者CD4/CD8比值的相关性A. CD8+ T细胞分泌IFN-γ水平与患者CD4/CD8比值之间的相关性分析; B. CD8+ T细胞分泌IL-2水平与患者CD4/CD8比值之间的相关性分析Figure 4 Correlation between the secretion of cytokines from CD8+ T cells and the CD4/CD8 ratio in CR patients

表5 外泌体对CD8+ T细胞增殖的影响(%)Table 5 Effects of plasma exosomes on the proliferation CD8+ T cells(%)
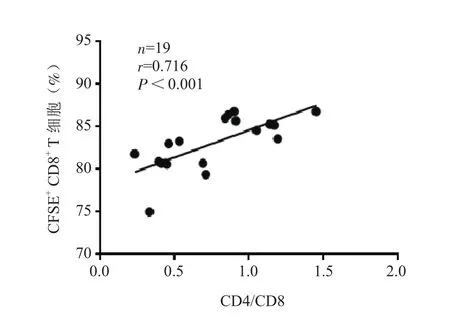
图5 CD8+ T细胞增殖能力与CR患者CD4/CD8比值的相关性Figure 5 Correlation between the proliferation of CD8+ T cells and the CD4/CD8 ratio in CR patients
本研究阐明了CR患者血浆外泌体的浓度与CD4/CD8比值的相关性,通过体外实验证实了外泌体对CD8+T细胞功能的影响。血浆外泌体的特性,包括浓度、对正常免疫细胞功能的影响,能
