河北地区中国荷斯坦牛DGAT1 基因多态性与泌乳性状遗传效应分析
2019-05-17王思伟王学清石少轻马亚宾王昆
王思伟,王学清,石少轻,马亚宾,王昆,3
(1.河北省农林科学院粮油作物研究所,石家庄 050000;2.河北省畜牧良种工作站,石家庄 050000;3.河北省牛种质资源技术创新中心,石家庄 050000)
乙酰辅酶A∶二酰甘油酰基转移酶(Acyl CoA∶diacylglycerol acyltransferase,DGAT1)是由 DGAT1基因编码的一种完整的细胞膜酶,其主要功能是在脂肪细胞甘油三脂合成反应的最后步骤起催化作用,也是合成甘油三脂的唯一关键酶[1]。DGAT1在机体组织中普遍存在,特别是在脂肪、乳腺、小肠、睾丸和皮肤中表达[2],在肠道中的脂肪吸收、脂蛋白组装、血浆中的甘油三酯浓度调节[3]、脂肪细胞中的脂肪贮存[4]、肌肉中的能量代谢[5]以及乳脂合成、禽蛋及卵母细胞的形成[6]等过程中发挥着重要作用。
牛的DGAT1基因位于牛14号染色体的端粒区[7],序列长8.6Kb,由17个外显子和16个内含子组成,其mRNA序列由245bp的5’UTR、1 470bp的编码序列和275bp的3’UTR构成,编码的蛋白质为489个氨基酸[8]。研究发现,牛DGAT1基因第8外显子中存在一个K232A变异位点。研究者们认为,该位点的突变是14号染色体上影响奶牛乳脂率的QTL效应的分子机制[7,8],并于2004年得到了验证[9]。此后其他实验室以DGAT1为候选基因在不同的奶牛群体进行了研究,并得到相似结论[10~12]。Kaupe[13]等人对分布于世界五大洲37个普通牛和瘤牛品种的分析发现,DGAT1基因中K232A位点的等位基因K在不同品种中的分布不同,在奶牛群体中的分布频率差异很大。
候选基因与数量性状的连锁关系通常在某一群体或特定群体的特定世代中出现,且与该群体的特殊遗传背景相作用。因此,为了将候选基因遗传效应应用于畜禽经济性状的标记辅助选择中,就需要在不同或同一品种的不同群体中不断进行验证,甚至在同一群体中也要经过多个世代的验证[14]。河北省是我国重要的奶牛养殖区域,2016年全省奶牛存栏约180.6万头,奶类总产量达448.0万t,居全国第三位。但是至今尚未有关于河北地区荷斯坦牛DGAT1基因与奶牛泌乳性状的研究报道。本研究旨在探讨河北地区荷斯坦牛DGAT1基因的遗传多态性及其与主要泌乳性状的关系,为奶牛分子标记辅助选择提供理论依据。
1 材料与方法
1.1 试验动物血样的采集
870头中国荷斯坦母牛血样分别采自河北省石家庄鹿泉、藁城、正定、唐山芦台县和保定的5个牛场,产奶性状表型记录和系谱记录由河北省畜牧良种工作站DHI中心提供。每头牛采集血液5mL,即刻放入抗凝离心管中,上下摇动,编号,于冰盒中保存,回到实验室后采用血液基因组DNA提取试剂盒(北京全式金生物技术有限公司,北京)提取奶牛基因组DNA,于-20℃冷冻保存。
1.2 引物合成与PCR扩增
根据牛DGAT1基因的已知序列(GenBank登录号:AJ318490),采用Oligo 6.0软件对其K232A突变侧翼序列设计引物,上、下游引物序列分别为5′-GTCAACCTCTGGTGCCGAGA-3′和5′-GGAAGGAAGCAAGCGGACAGT-3′,预期扩增片段为484bp。
PCR反应体系为25µL:其中12.5µL MasterMix;上游引物和下游引物各0.5µL;基因组DNA模板1.0µL,加超纯水10.5µL至25µL。PCR反应程序为:95℃预变性5min;94℃变性45 s,68℃退火30s,72℃延伸40s,34个循环;72℃延伸10min;降温至4℃保存。扩增产物用2.0%琼脂糖凝胶电泳(120v,30min)检测。
1.3 RFLP分析
酶切反应总体积为10µL:EaeⅠ限制性内切酶0.5µL、10×Buffer 1.0µL、PCR产物8.5µL,37℃条件下酶切1h。酶切产物用2%琼脂糖凝胶电泳(160v,40min)分离,EB染色,紫外灯下观察拍照,记录结果。
1.4 测序分析
经PCR-RFLP分析后,对不同基因型随机选择2个个体的PCR产物进行回收纯化, 送至北京六合华大基因科技有限公司进行正反方向直接测序。
1.5 数据统计与分析
1.5.1 基因型频率和等位基因频率的计算
基因型频率 = 基因型个体数/测定群体总数
等位基因 A 的频率:p(A) = (D+1/2H)
等位基因 T 的频率:q(T)= (R+1/2H)
D、H、R 分别为AA、TA和TT基因型频率。
遗传杂合度( He) 计算:

式中: pi为群体中第i个等位基因的频率,m为等位基因数。
有效等位基因数(Ne)计算:

式中: pi为群体中第i个等位基因的频率,n 为等位基因数。
多态信息含量( PIC) 计算:

式中 :pi和 pj分别为群体中第 i 和第 j 个等位基因的频率,m 为等位基因数。
皮尔逊卡方检验:

式中:O 代表群体中每个基因型的观测数目,E 代表假定 Hardy-Weinberg 平衡定律成立时每个基因型的期望个体数。
1.5.2 基因型与泌乳性能相关性分析
产奶性状和基因型的关联分析采用SAS(8.02)软件的MIXED过程进行,动物模型为:

式中:y为产奶性状表型记录,µ为群体平均值,F是场次效应,T是胎次效应,G是基因型效应,a是加性遗传效应,E是随机残差效应。
1.5.3 等位基因加性效应、显性效应和替代效应
等位基因加性效应的计算:

等位基因显性效应的计算:
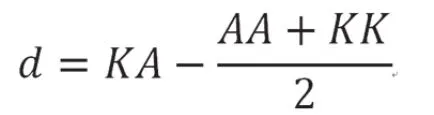
等位基因替代效应的计算:

式中:p为A等位基因频率,q为K等位基因频率,KK、AA和KA分别为各基因型的表型最小二乘均值。
等位基因替代效应的显著性检验利用线性回归模型(SAS),通过泌乳性状对K等位基因拷贝数(0、1、2)的回归来计算,分别将基因型KK、KA和AA定义为2、1和0。
2 结果与分析
2.1 DGAT1基因K232A位点的遗传多态性分析
以中国荷斯坦牛基因组DNA为模板,通过设计引物对DGAT1基因K232A位点进行扩增,获得1条484bp的片段。采用限制性内切酶EaeⅠ消化后显示3种基因型:484bp;484、320、164bp和320、164bp,分别命名为KK、KA和AA。PCR-RFLP的琼脂糖凝胶电泳结果如图1所示。经统计,基因型KK、KA和AA的频率分别为0.0402、0.9276和0.0321;等位基因K和A的频率分别为0.5040和0.4960。多态信息含量PIC为0.37(0.25<PIC<0.5),为中度多态。杂合度He为0.4990,有效等位基因数Ne为2.0000,该位点在群体中极显著地偏离Hardy-Weinberg平衡状态(P<0.01)。

图1 DGAT1 基因 K232A 位点 PCR-RFLP 扩增
2.2 DGAT1基因K232A位点扩增片段的测序
序列分析结果表明:KK基因型的核苷酸序列与GenBank中DGAT1基因的序列(GenBank登录号:AJ318490)一致,AA基因型在第10 433和10 434bp位点发生了AA-GC双碱基突变。测序结果见图2。

图2 不同基因型的测序结果
2.3 DGAT1基因K232A位点与泌乳性状关联分析
DGAT1基因的K232A位点不同基因型对乳脂率、乳脂量、乳蛋白率、乳蛋白量、305d产奶量5个产奶性状的最小二乘均值及标准误见表1。由结果可知,该突变位点极显著影响乳脂率(P<0.01),显著影响305d产奶量(P<0.05),对乳脂量、乳蛋白率和乳蛋白量的影响不显著(P>0.05)。多重比较结果表明,KK基因型的乳脂率极显著高于KA和AA基因型(P<0.01);KA和AA基因型的305天产奶量显著高于KK基因型(P<0.05);KK基因型的乳脂量和乳蛋白量均低于其他两个基因型,但未达显著水平(P>0.05);AA和KA基因型之间无显著差异(P>0.05)。等位基因替代效应显示,每个A等位基因替代K等位基因会导致乳脂率降低0.151%,乳脂量提高5.345kg,乳蛋白率降低0.02%,乳蛋白量提高8.973kg,305d产奶量提高324.515kg。A等位基因是305d产奶量的优势等位基因,K等位基因是乳脂率的优势等位基因。

表1 DGAT1基因K232A位点不同基因型与泌乳性状的关联分析
3 讨论
3.1 等位基因频率的差异
国外许多学者均对K232A变异位点的基因频率进行了检测分析。Kaupe等[13]通过对五大洲13个国家共37个品种进行检测发现,K等位基因的频率在奶牛品种中差异较大。Schennink等[15]检测了荷兰1 779头荷斯坦牛,其等位基因A和K的频率分别为0.6和0.4。Oikonomou等[15]检测的希腊497头荷斯坦牛中,A和K基因频率分别为0.38和0.62,且无AA基因型。Spelman等[10]检测发现,K 等位基因在新西兰1 527头荷斯坦牛中的频率为0.6,在113头爱尔夏牛中的频率为0.22,在1 053头娟姗牛中的频率是0.88。Pareek等[16]研究显示,K等位基因在波兰105头人工授精公牛中的频率为0.6,在139头青年公牛中的频率为0.68,在213头黑白花母牛中的频率为0.48。Naslund等[17]发现K等位基因在瑞典红牛中频率为0.09。我国学者对该位点也进行了大量研究。结果显示,K232A变异位点在我国不同地区不同群体奶牛中的分布频率差异较大(见表2),大部分地区的奶牛群体中KK基因型频率低于0.1[18~24],但新疆[19]、甘肃[25]、贵州[26]的中国荷斯坦牛,内蒙古的澳系、新系荷斯坦牛[20]以及江西吉安西杂母牛[27]的KK基因型频率较高。本研究对河北地区5个牛场的870头中国荷斯坦牛进行检测分析,结果显示,K和A等位基因的基因频率分别为0.5040和0.4960,在河北奶牛群体的分布较为平衡,与贾晋[14]、周利华[19]、张晓东[20]等研究结果一致;KA基因型的频率为0.9276,为优势基因型,与贾晋等[14]研究结果相似,但是,纯合基因型在河北地区奶牛群体中的分布极少。该位点处于中度多态,遗传改良潜力较好,等位基因分布均匀,极显著偏离H-W平衡,说明该位点在群体中存在非自然选择。综合分析表明,该位点在河北荷斯坦牛群体中处于被非自然选择因素破坏了平衡的状态,是适合应用于遗传选育的候选位点。

表2 我国不同地区不同奶牛品种DGAT1基因遗传多态性
3.2 K232A位点遗传效应的差异
Grisart等[8]和Winter等[7]研究发现,DGAT1基因的K232A位点突变对新西兰和荷兰黑白花奶牛的乳脂性状有重大影响。Winter等[7]对荷斯坦牛、瑞士褐牛和德系西门塔尔牛,Thaller等[11]对德国荷斯坦牛,Weller等[12]对以色列荷斯坦牛的研究也报道了相似的结果。Pareek等[16]对波兰荷斯坦牛的研究表明,K223A 突变对牛奶中低的脂肪含量和高的蛋白含量有显著作用。我国学者对DGAT1基因K232A位点不同突变类型与不同地区不同品种奶牛的泌乳性状的关联分析结果表明,该基因突变对不同奶牛群体泌乳性能的影响不尽相同。贾晋[14]、毛永江[24]、马彦男[25]等人的分析结果表明,K等位基因是影响奶牛乳脂率的优势基因,A等位基因是影响产奶量和乳蛋白率的优势基因,与国外大部分研究结果相同。但是,部分学者认为该位点并非对乳脂率、乳蛋白率和产奶量均有影响,殷骥[23]等人研究认为该位点对乳蛋白率无显著影响,周利华[19]、张晓东[20]的分析结果则显示该位点对产奶量无显著影响,而邹荣婕[28]则认为该位点仅影响奶牛的乳脂率,对乳蛋白率、产奶量无显著影响。此外,还有学者得到了相反的研究结果,李峥[22]的研究结果表明,K等位基因是乳蛋白率的优势基因,而张驭伟[26]则认为A等位基因是乳脂率的优势基因。本研究结果表明,K232A突变位点对乳脂和305d产奶量有显著影响,对乳脂量、乳蛋白率和乳蛋白量无显著影响。K等位基因是乳脂率的优势等位基因,A等位基因是305d产奶量的优势等位基因,与殷骥等的研究结果一致。环境条件、奶牛品系杂交和奶牛选育背景等可能是造成结果差异较大的原因。
DGAT1是甘油三脂合成过程中唯一的关键酶,对动物机体脂肪代谢、脂类在组织中的沉积起着重要作用。作为影响奶牛泌乳性状的候选基因之一,明确该基因的遗传多态性及其对经济性状的影响,进行分子标记辅助选择,对提高奶牛产奶性状,加快育种进程,实现优质品种改良具有深远意义。近年来,随着GWAS等技术的应用[30,31]及相关研究的不断深入,研究者们认为DGAT1基因除了影响奶牛的产奶量、乳脂率和乳蛋白率外,对奶牛乳糖率[32]、乳脂肪酸[33~35]以及空怀天数、输精次数、初配年龄等繁殖性状[15,36]也有显著影响。今后应围绕该基因对乳成分及繁殖性状的影响展开研究。
4 结论
本研究针对DGAT1 基因 K232A 位点,采用 PCRRFLP法分析了河北省鹿泉、藁城、正定、唐山芦台县和保定的5个地区共870头中国荷斯坦牛的遗传多态性,利用混合动物模型对该突变位点与乳脂率、乳蛋白率、乳脂量、乳蛋白量及305d产奶量5个泌乳性状进行了遗传效应分析。研究结果表明,该位点基因型及基因频率分布与我国其他地区荷斯坦牛的差异较大。DGAT1 基因 K232A 位点突变对河北地区中国荷斯坦牛泌乳性状有较大的遗传效应,可用于其泌乳性状的分子标记辅助选择,但有关该位点遗传效应差异及突变对乳成分和繁殖性状方面的影响值得进一步深入研究。
