芦丁对D-半乳糖诱导衰老小鼠认知功能的保护作用研究
2019-05-17石茜何守玉霍丽霞徐永强王翔
石茜 何守玉 霍丽霞 徐永强 王翔
衰老是一个渐进缓慢的过程,常见的相关性疾病有帕金森病(PD)和阿尔茨海默病(AD)。据报道,活性氧(ROS)的产生与抗氧化酶活性之间的不平衡导致的氧化损伤在衰老过程中起关键作用[1]。芦丁是许多传统中草药中常见的黄酮类化合物,具有显著的抗氧化特性[2-3]和抗炎活性[4],已证明芦丁可对6-羟基多巴胺(6-OHDA)诱导的PD样和A-β42诱导的AD样损伤具有保护作用[3]。但芦丁在衰老引起的认知功能下降中的作用和机制很少有报道。维生素E很早就被证明是亲脂类自由基的清除剂,在神经保护方面发挥重要作用[5]。黄榕祥等[6]证明维生素E可通过抗氧化作用保护海马神经元,改善衰老大鼠空间认知功能。因此在本研究中,笔者利用维生素E作为阳性对照,利用D-半乳糖(公认的衰老模型诱导剂[7])构建小鼠衰老模型,研究芦丁对衰老小鼠认知功能的保护机制,以期为衰老引起的认知功能障碍提供新的治疗和预防思路。
1 材料和方法
1.1 试剂 芦丁、D-半乳糖和维生素E(美国Sigma公司);尼氏染色试剂盒(中国碧云天公司);总超氧化物歧化酶(T-SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、一氧化氮(NO)和一氧化氮合酶(NOS)试剂盒(南京建成生物工程研究所);一抗:兔微管相关蛋白-2(MAP-2)抗体(美国 Millipore公司,1∶200)、抗半胱天冬酶-3(Caspase-3)抗体(美国 Bioworld 公司,1∶200)和鼠胶质纤维酸性蛋白(GFAP)抗体(美国Millipore公司,1∶600);二抗:羊抗兔 IgG(重链+轻链)(美国 Bioworld公司,1∶200);羊抗鼠超敏二步法(polink-2)加聚合物(北京中山金桥公司)。
1.2 动物和药物处理 雄性ICR小鼠80只,体重18~22g,均购自南通大学实验动物中心。实验前这些动物适应本实验室环境1周。所有流程均已通过南通大学动物保护与利用委员会和江苏省动物保护伦理委员会批准[批准文号:SYXK(SU)2007-0021]。
1.2.1 动物分组及模型构建 衰老小鼠评价指标中,SOD活力降低是最重要的参考指标[8],目前给药剂量无统一规定,一般 50~500mg·kg-1·d-1不等,连续 6~8 周即可构建小鼠衰老模型[9]。本研究采用直接抽取法将小鼠分成对照组、D-半乳糖组、D-半乳糖+芦丁组和D-半乳糖+维生素E组,每组20只,其中8只用于T-SOD、GSH-PX活性检测和MDA水平测定,8只用于NOS活性和NO水平检测,4只用于制作多个脑组织冷冻切片,进行海马神经元计数及MAP-2等指标检测。对照组接受每日皮下注射0.9%氯化钠注射液和0.5%羧甲基纤维素钠注射液(与非水溶性药物粘合乳化,利于药物溶水)。D-半乳糖组小鼠每日皮下注射D-半乳糖(100 mg/kg),口服0.5%羧甲基纤维素钠悬液6周。D-半乳糖+芦丁组小鼠每日皮下注射D-半乳糖(100mg/kg),口服含芦丁(25mg/kg)的0.5%羧甲基纤维素钠悬液6周。D-半乳糖+维生素E组小鼠每日皮下注射D-半乳糖(100 mg/kg),口服含维生素 E(25mg/kg)的 0.5%羧甲基纤维素钠悬液6周。
1.2.2 Morris水迷宫测试 经过6周的治疗后,在水迷宫中评估所有小鼠的空间学习能力,该装置由长、宽、深分别为73、42、20cm的黑色有机玻璃矩形罐组成。容器包括1个起点,1个终端平台和4个无平台设施。在水迷宫中填充水深12cm,温度控制在(22±1)℃。在训练的第1天,让每只老鼠停留在终端平台上30s以识别该位置,并将其放置在面对泳池墙的水中,在第1个起始点包含无平台设施,记录每次试验找到终端平台的逃避潜伏期。如果在2min内找不到梯子,游泳时间被定为2min。小鼠连续6d接受试验。对于所有的试验,通过计算机化的视频成像分析系统(中国医学科学院材料医学研究所)测量并计算6d内所有小鼠的逃避潜伏期、游泳距离和游泳路径。
1.2.3 生化指标检测 在最后1次行为测试后24h进行生化指标检测。每组16只小鼠通过断头处死,小心地去除大脑并用冰冷的等渗氯化钠溶液冲洗。海马在冷氯化钠溶液中制备成100g/L匀浆,用于测定T-SOD、GSH-Px和NOS活性以及MDA、NO含量。所有检查均按说明进行。
1.3 海马区神经元损伤情况检测 采用甲酚紫染色法。对海马神经元进行染色,显微镜(德国Leica公司,DM4000显微镜)下观察,计算海马CA1区域中阳性细胞的数量(0.27mm2)。测量4对双侧脑组织切片,计算每对脑切片阳性细胞数平均值,并将该值用于进一步的统计分析。
1.4 免疫组化染色 对于MAP-2标记,将脑组织切片在四乙基若丹明异硫氰酸酯(TRITC)偶联的羊抗兔IgG中孵育,用于观测海马神经元树突完整性情况;对于Caspase-3和GFAP标记,切片用羊抗鼠polink-2加聚合物温育,分别用于观测海马神经元凋亡情况与星型胶质细胞损伤情况。用计算机图像分析系统拍摄海马CA1和顶叶皮层的照片(德国Leica公司,DM4000B显微镜)。计算海马中阳性细胞的数量(Caspase-3为0.07mm2,GFAP为0.27mm2)。测量4对双侧脑切片,计算每对脑切片阳性细胞平均值,并将该值用于进一步的统计分析。
1.5 统计学处理 采用Graphpad 5.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠逃避潜伏期、游泳距离和游泳路径比较 与对照组比较,在训练的第5、6天时D-半乳糖组逃避潜伏期与游泳距离均延长(均P<0.05);与D-半乳糖组比较,在训练的第5、6天时D-半乳糖+芦丁组与D-半乳糖+维生素E组逃避潜伏期与游泳距离均缩短(均P<0.05)见图1a和b。图1c显示了第2、6天试验中4组小鼠的游泳路径,与训练2d比较,4组小鼠训练6d游泳到达终端平台的路径明显缩短。
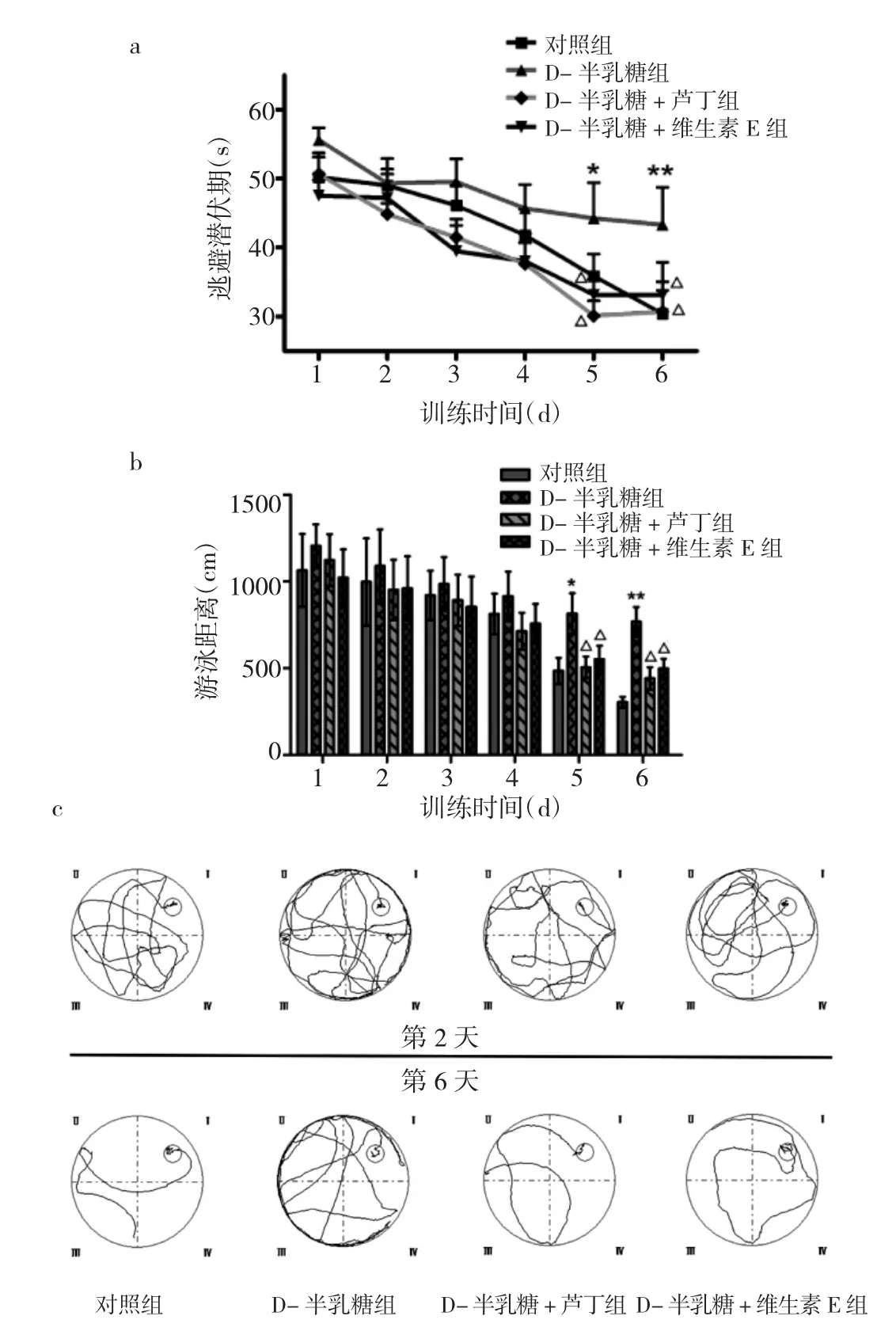
图1 Morris水迷宫实验检测实验各组小鼠认知功能(a:4组小鼠的逃避潜伏期比较;b:4组小鼠的游泳距离比较;与对照组比较,*P<0.05,**P<0.01;与 D- 半乳糖组比较,△P<0.05;c:在第 2天和第6天的试验中小鼠的代表性游泳路径)
2.2 4组小鼠海马中抗氧化酶活性和氧化产物水平比较 与对照组比较,D-半乳糖组小鼠海马中MDA水平增加(P<0.05),T-SOD和GSH-Px的活性均明显降低(均P<0.01);与D-半乳糖组比较,D-半乳糖+芦丁组小鼠海马中T-SOD、GSH-Px活性均被逆转恢复(均P<0.05),MDA 水平明显降低(P<0.01);D-半乳糖+维生素E组小鼠海马中T-SOD和MDA水平活性均被逆转恢复(均P<0.05),但对降低的GSH-Px活性没有产生任何明显影响,见表1。
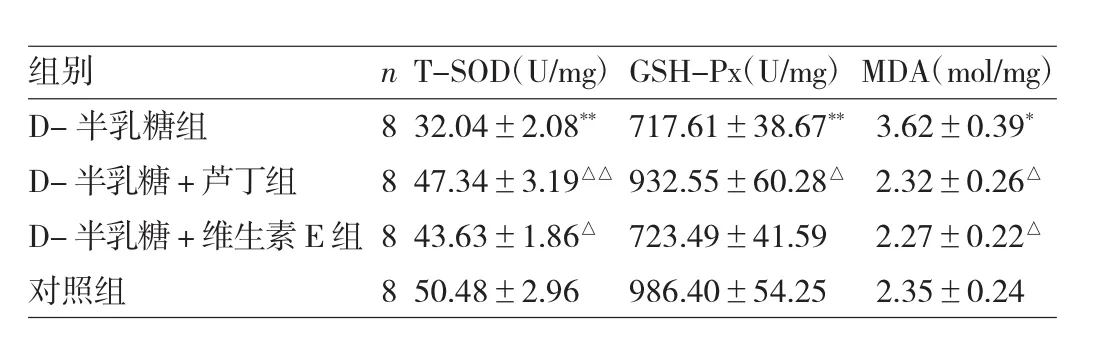
表1 芦丁对D-半乳糖诱导衰老小鼠海马中T-SOD,GSH-Px和MDA水平的影响
2.3 4组小鼠海马神经元损伤情况 与对照组比较,D-半乳糖组小鼠脑组织切片甲酚紫染色显示海马CA1区有明显损伤并伴神经元丢失,完整神经细胞数明显减少(P<0.01);与D-半乳糖组比较,D-半乳糖+芦丁组与D-半乳糖+维生素E组小鼠脑组织切片染色显示海马CA1区的损伤及神经元丢失情况均有所好转,完整神经细胞数均增加(均P<0.05),见图2(插页)和表2。

表2 鼠脑海马CA1区完整神经细胞数(个)
2.4 4组小鼠海马神经元凋亡情况 与对照组比较,D-半乳糖组小鼠海马中凋亡阳性细胞明显增加(P<0.01);与D-半乳糖组比较,D-半乳糖+芦丁组与D-半乳糖+维生素E组小鼠海马中凋亡阳性细胞均明显减少(均P<0.05),见图 3(插页)和表 3。

表3 鼠脑海马CA1区Caspase-3阳性细胞数(个)
2.5 4组小鼠海马神经元树突完整性比较 与对照组比较,D-半乳糖组小鼠的顶叶皮质和海马CA1神经元的树突变短且丢失;与D-半乳糖组比较,D-半乳糖+芦丁组与D-半乳糖+维生素E组中未检测到类似的破坏,见图4(插页)。

图4 鼠脑中顶叶皮质和海马CA1区树突分支和结构的观察(a~d:4组小鼠顶叶皮质神经树突结构;e~h:4组小鼠海马CA1区神经树突结构;MAP-2免疫组织化学染色,×100)
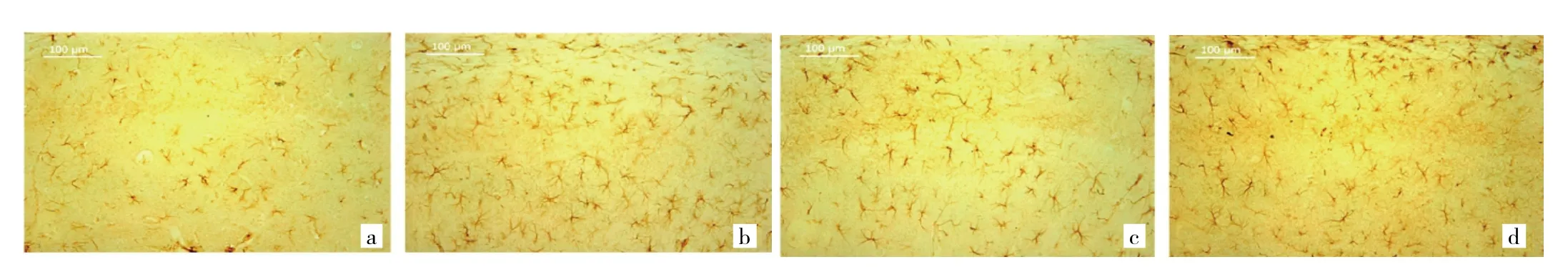
图5 鼠脑海马区星形胶质细胞损伤情况(a:对照组;b:D-半乳糖组;c:D-半乳糖+芦丁组;d:D-半乳糖+维生素E组;GFAP免疫组织化学染色,×100)
2.6 4组小鼠海马中的星形胶质细胞损伤情况 与对照组比较,D-半乳糖组小鼠海马中损伤肿胀的星形胶质细胞GFAP信号增强(P<0.01),细胞释放总NO水平和NOS活性均明显增加(均P<0.01);与D-半乳糖组比较,D-半乳糖+芦丁组海马星形胶质细胞中GFAP信号较低(P<0.05),NOS活性和NO水平均明显降低(均P<0.01),同时D-半乳糖+维生素E组小鼠海马星形胶质细胞中NOS活性和NO水平均表现出相似的降低趋势(均P<0.05),见图 5(插页)、表 4、5。

表4 GFAP阳性细胞数(个)
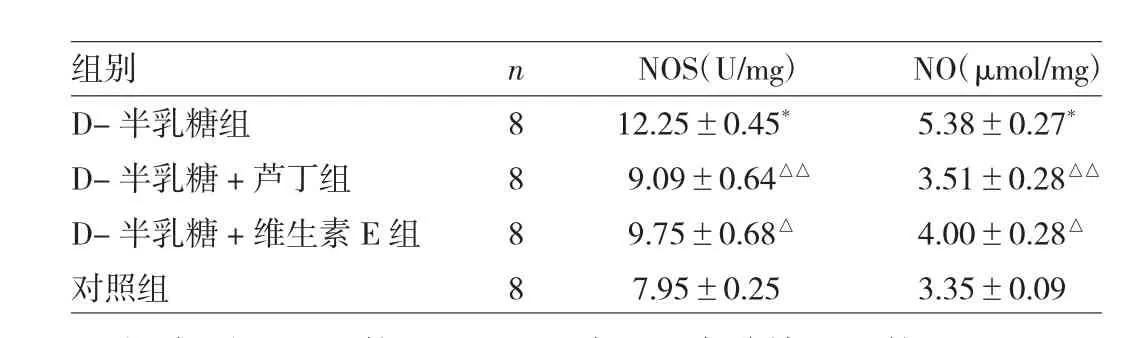
表5 芦丁对D-半乳糖诱导衰老小鼠海马星型胶质细胞中NOS和NO释放的影响
3 讨论
芦丁对神经的保护作用已被大量研究报道,其在认知功能上的良好效果也逐渐被人们所了解,由于芦丁和/或其代谢物有穿过血脑屏障的能力,它被证明可以改变认知以及神经退行性疾病的各种行为症状,对阿尔兹海默病具有一定的治疗潜力[10]。此外,也有研究证明芦丁对1型糖尿病引起的认知功能障碍也有缓解作用[11],然而,芦丁在衰老引起的认知功能减退中的作用很少有报道。本研究中,笔者首先验证了D-半乳糖(100mg/kg)处理小鼠6周后,其在Morris水迷宫中的性能显著下降,而长期口服芦丁合并D-半乳糖处理的小鼠逃避潜伏期和游到平台的距离显著降低和缩短,表明芦丁具有改善由D-半乳糖诱导的认知缺陷的潜力。
本研究也明确地证明芦丁可以抑制神经元丢失,抑制海马神经元细胞的凋亡,从而提高D-半乳糖处理小鼠的空间学习和记忆能力。甲酚紫染色显示芦丁对海马神经元的保护作用,防止D-半乳糖诱导的海马神经元丢失和细胞凋亡。轴突和树突的完整性对于ChAT运输是重要的[12]。在这项研究中,笔者检测了MAP-2的表达以观察含或不含芦丁的D-半乳糖处理的小鼠中的树突变化。笔者发现在D-半乳糖处理的小鼠的顶叶皮层和海马区域中MAP-2阳性树突具有显著的损伤。芦丁处理后,树突比D-半乳糖处理的小鼠更加完整,并且这种树突完整性可能在中枢胆碱能系统和认知功能中起重要作用。
根据衰老的自由基理论,正常代谢生物氧化副产物ROS能导致大分子的氧化损伤,并随着年龄增长引起细胞功能障碍并最终导致细胞死亡。在本研究中,我们观察到D-半乳糖引起小鼠的海马中T-SOD和GSH-Px内源抗氧化酶活性的显著失活,MDA(作为度量细胞或组织的氧化应激状态的脂质过氧化产物)含量增加。而芦丁能提高D-半乳糖诱导的衰老小鼠的抗氧化能力,这与其他报道一致[13]。这些发现表明芦丁在一定程度上通过改善抗氧化防御系统的活性来消除因D-半乳糖引起的ROS超载。
星形细胞足突,作为血脑屏障的组成部分,在维持脑微环境的稳态中发挥重要作用。因此,星形胶质细胞是血流中ROS的第1道防线,其结构和功能改变可影响“神经胶质小体”的完整性并导致严重后果。星形胶质细胞的损伤与氧化应激诱导的脑衰老有关,累积标志物为GFAP。本研究显示受D-半乳糖诱导的持续氧化应激的影响,小鼠中血管周围星形细胞足突肿胀,结构和功能被破坏,GFAP阳性细胞数显著增加,这些受损的星形胶质细胞通过上调NOS表达而产生NO,其水平也相应增加。从星形胶质细胞释放的大量NO是神经毒性的,它通过多种信号途径导致神经元损伤,在此基础上,星形胶质细胞衍生的NO可能在这种衰老模型的发病机制中起关键作用[14]。然而,本研究证明芦丁或维生素E的长期治疗逆转了D-半乳糖引起的NOS活性和NO水平的升高,表明芦丁对脑损伤的保护作用可能与氧化应激的减弱有关。
总之,这项研究的结果表明,D-半乳糖诱导的模拟衰老和认知功能障碍与氧化应激的增加和由此引发的凋亡级联导致的海马神经元的损伤相关。芦丁通过抑制神经细胞凋亡和保持树突完整性,改善抗氧化防御系统的活性,缓解星形胶质细胞损伤来发挥明显的神经保护作用,从而增强小鼠的认知能力。虽然确切的潜在机制仍不清楚,但本研究结果表明芦丁可能在脑老化期间具有积极作用。
