MRI不同的ROI测量法对卵巢癌表观弥散系数(ADC)值和观察者一致性的影响
2019-05-16沈敏花谢洁林王鸣鹏王雪珍张国福
沈敏花 谢洁林 王鸣鹏 王雪珍 张国福△
(1复旦大学附属妇产科医院放射科 上海 200011; 2复旦大学附属华东医院放射科 上海 200040)
卵巢癌是女性三大恶性肿瘤之一,发病隐匿,早期无症状,就诊时常为晚期,病死率居妇科肿瘤首位[1],缺乏敏感而特异的诊断方法是卵巢癌预后差的原因之一。常规磁共振成像(magnetic resonance imaging,MRI)具有良好的软组织对比及多方位成像的优势,在评价妇科疾病方面较超声和CT更准确和特异[2-3],但对卵巢肿瘤的定性与分级仍然存在困难[4]。采用弥散加权成像(diffusion weighted imaging,DWI)对卵巢肿瘤进行研究[5-8]显示,DWI是常规MRI检查的有益补充[3-6]。常规DWI通过表观弥散系数(apparent diffusion coefficient,ADC)图测量病灶ADC值,ADC值反映了感兴趣区(region of interest,ROI)内组织的物理性质,不同的ROI有不同的ADC值。以往都是用在选定的一个病灶层面画圆圈或椭圆的方法测量ADC值;随着研究的深入,我们发现不同的ROI放置方法能获得不同的ADC值,它对ADC值的准确性及重复性有一定的影响。如何找到一个最优的ROI放置方法,不论是对患者还是对医师来说都有重大的意义。目前ROI放置方法有3种,即完全不规则形ROI测量,部分不规则ROI测量和肿瘤内小ROI取样[9-16]。本研究采用这3种ROI放置方法,分别观察其对卵巢癌ADC值测量的影响和不同观察者分别使用不同测量方法所测结果间的一致性。
资料和方法
病例资料收集2013年1月至2014年12月在复旦大学附属妇产科医院就诊的卵巢癌患者的MRI及DWI资料。纳入标准:完全实性、实性为主或囊性为主的卵巢恶性肿瘤;排除标准:卵巢完全囊性的肿瘤患者,已进行过外科手术或新辅助化疗患者。共纳入卵巢癌肿瘤患者45例(双侧肿瘤患者均测量较大侧),年龄29~73岁,平均50岁,绝经前22例,绝经后23例。Ca125均>100 U/mL,其中有3例的Ca125>5 000 U/mL,所有患者经手术(开腹或腹腔镜)和病理证实。
检查方法采用1.5T MRI(Avanto,德国Siemens公司),体部相控阵线圈,嘱患者检查时仰卧于扫描床上,双上肢上举置于线圈外面,平静呼吸。自脐孔水平向下扫描至耻骨联合,所有患者均行横断位T1WI(TR/TE,627/10 ms、视野250 mm×250 mm、矩阵320 mm×240 mm),冠状位T2WI(TR/TE,4 290/83 ms、视野400 mm×400 mm、矩阵320 mm×320 mm),横断位脂肪抑制T2WI(TR/TE,8 000/83 ms、视野350 mm×350 mm、矩阵256 mm×256 mm),矢状位脂肪抑制T2WI(TR/TE,4490/83 ms、视野270 mm×270 mm、矩阵256 mm×256 mm),层厚均为4 mm、层间距1.2 mm和横断位脂肪抑制T1WI(TR/TE,4.9/2.4 ms、视野380 mm×296 mm、矩阵320 mm×192 mm、层厚4 mm、层间距0.8mm)。DWI采用单次激发平面回波成像(echo planar imaging,EPI)序列,参数如下:TR/TE(3 100/81 ms),翻转角0°,视野320 mm×270 mm,矩阵292 mm×320 mm,层厚5 mm,层间距1.5 mm,b值分别为0和800 s/mm2。增强扫描采用VIBE序列,包括矢状位和横断位采集,参数如下:TR/TE(4.9/2.4 ms),翻转角10°,视野380 mm×297 mm,矩阵320 mm×178 mm,层厚4 mm,层间距0.8 mm;对比剂为马根维显,采用手臂静脉注射,人工推注模式。
图像分析采用MR扫描仪自带的后处理软件分析DWI资料,2名放射科医师各自用3种不同的ROI获得方法测量肿瘤的ADC值,意见不一致时(选择相同的病灶测量层面)协商解决。完全不规则形ROI测量方法是对肿瘤的最大层面进行手动勾勒肿瘤边界,获得所在层面的ADC值。部分不规则ROI测量方法是在肿瘤的最大层面上手动绘制ROI,避免肿瘤囊变、坏死区域等,所获得的ADC值。肿瘤内小ROI取样测量方法,是在肿瘤实性区信号较低的区域放置的圆形或椭圆形ROI获得的ADC值,ROI面积一般大于3 cm2。以上3种方法均可获得最小及平均ADC值。
统计学分析采用SPSS 17.0和MedCalc 15.2.2软件进行统计分析。用组间相关系数(ICC:0~0.20为差,0.21~0.40为一般;0.41~0.60为中等;0.61~0.80为好;0.81~1.00为非常好)[17]和Bland-Altman方法分析3种ROI测量方法对不同观察者所测量数值的一致性程度[18]。采用Friedman检验和单因素方差分析3种ROI测量方法所获得的最小和平均ADC值之间的差异,并进行两两比较,P<0.05 为差异有统计学意义。经过Bonferroni校正[19]后3组对比结果设置为P<0.017(0.05/3)为差异有统计学意义。
结 果
不同观察者对于ADC值测量的影响2个观察者分别使用3种ROI测量ADC值的方法对卵巢癌患者的ROI测量最小和平均ADC值(表1)。
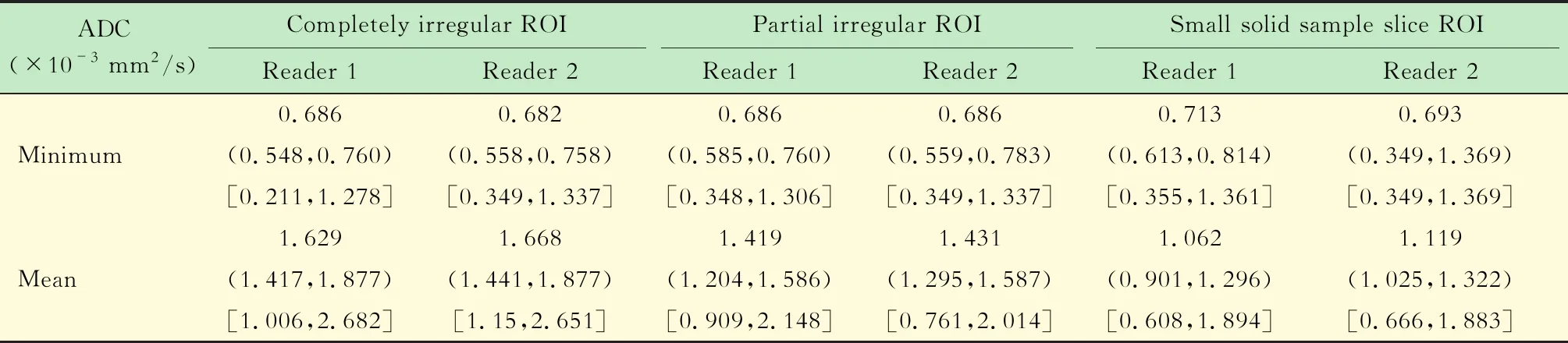
表1 3种ROI测量法获得的ADCs结果对比Tab 1 The results of ADCs using 3 kinds of ROI measurement methods respectively
Data are expressed as medians;numbers in parentheses are first quartiles(q1)and third quartiles(q3);numbers in brackets are ranges.
2个观察者使用3种方法对比最小ADC值,其均值差值及其差的95%CI结果:完全不规则ROI测量法为-0.001 5×10-3mm2/s [(-0.077 1~0.074 1)×10-3mm2/s,ICC=0.875 0],部分不规则ROI测量法为0.005 2×10-3mm2/s [(0.072 4~0.082 8)×10-3mm2/s,ICC=0.913 8],肿瘤内小ROI取样法为0.018 9×10-3mm2/s [(-0.062 2~0.100 0)×10-3mm2/s,ICC=0.918 4)]。利用Bland-Altman描述3种测量方法,其中完全不规则ROI测量方法较其余2种方法的一致性差(图1)。
2个观察者3种方法对比平均ADC值,其均值差值及其差的95%CI结果:完全不规则ROI测量法为-0.013 9×10-3mm2/s [(-0.154 1~0.126 3)×10-3mm2/s,ICC=0.9014],部分不规则ROI测量法为-0.023 6×10-3mm2/s [(-0.139 1~0.092 0)×10-3mm2/s,ICC=0.892 5],肿瘤内小ROI取样法为-0.045 6×10-3mm2/s [(-0.156 7~0.065 4)×10-3mm2/s,ICC=0.859 5]。同样利用Bland-Altman法描述3种测量方法,其中部分不规则ROI测量方法较其余2种方法的一致性好(图2)。
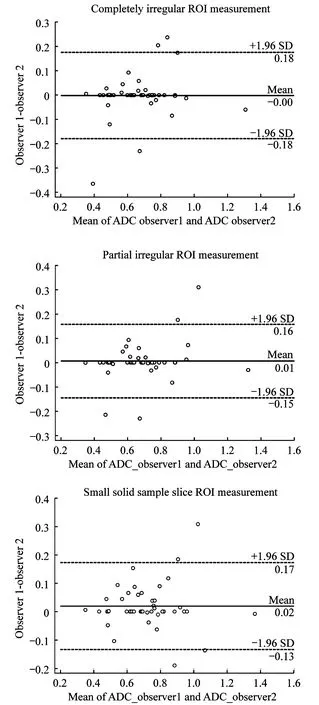
For the Bland-Altman plots:the difference of minimum ADC measurements(Y-axis)were plotted against the mean minimum ADCs(X-axis),with mean absolute difference(bias)(continuous line)and 95% CI of the mean difference(limits of agreement)(dashed lines).
图1 2个观察者3种ROI测量法对卵巢癌最小ADC的一致性
Fig 1 Interobserver reproducibility of the minimum ADC (×10-3mm2/s)measured by all 3 ROI methods in ovarian tumor
For the Bland-Altman plots:the difference of mean ADC measurements(y-axis)were plotted against the mean minimum ADCs(x-axis),with mean absolute difference(bias)(continuous line)and 95% confidence interval of the mean difference(limits of agreement)(dashed lines).
图2 2个观察者3种ROI测量法对卵巢癌平均ADC的一致性
Fig 2 Interobserver reproducibility of the mean ADC (×10-3mm2/s)measured by all 3 ROI methods in ovarian tumor
3种方法获得的ADC值对比分析对比45例卵巢癌患者的最小和平均ADC值,分别使用完全不规则、部分不规则和肿瘤内小ROI测量法进行统计分析,分别对应方法1、2、3(表2)。方差分析证明3种方法测得的最小和平均ADC值之间差异均有统计学意义(P均<0.05)。两两对比分析后显示方法1与方法2在最小ADC值测量时差异无统计学意义(P=0.12),而方法3与方法1、2比较差异均有统计学意义(P均<0.017),而在平均ADC值测量时,任意两种方法之间差异均有统计学意义(P均<0.001)。

表2 3种方法测得的卵巢癌最小和平均ADC值两两对比分析结果Tab 2 The minimum and mean ADCs of ovarian tumor were compared by 3 ROI methods
Method 1:Completely irregular ROI measurement;Method 2:Partial irregular ROI measurement;Method 3:Small solid sample slice ROI measurement.
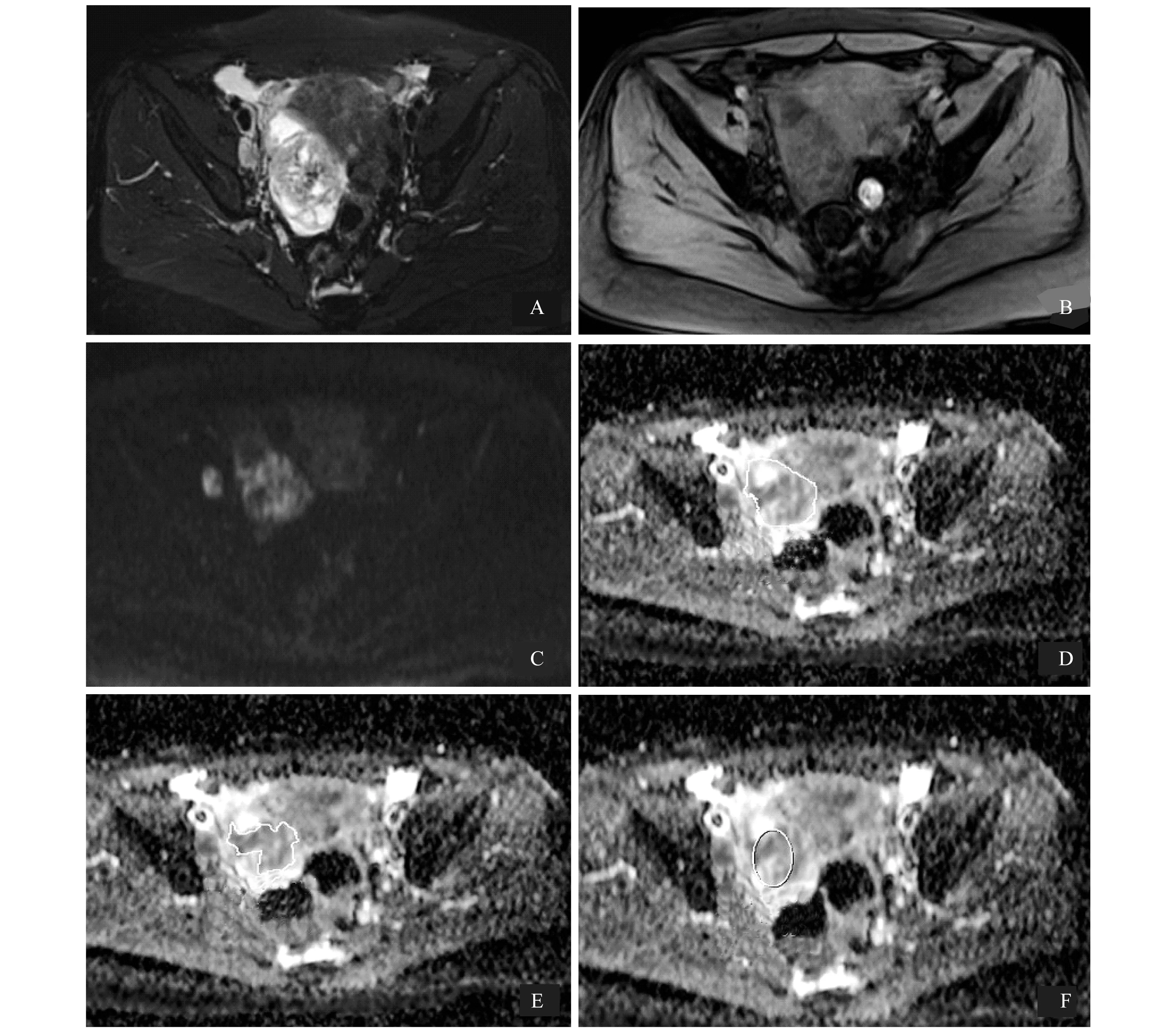
ADC measurements of the tumor were performed on an ADC map using three distinct ROI protocols:completely irregular ROI measurement(D),partial irregular ROI measurement(E),and small solid sample of tumor(F).The solid components of the tumor were identified on T2-weighted-fs(A),T1-weighted-fs(B)and DWI images(C),which were matched on ADC map.
图3 同一患者分别使用3种ROI方法获得的磁共振图像
Fig 3 Magnetic resonance images of the same patient using the 3 ROI methods
讨 论
卵巢肿瘤从形态上可分为囊性、囊实性和实性3类。囊性肿瘤最常见,主要包括囊腺瘤、畸胎瘤和部分转移瘤。囊实性和实性肿瘤包括上皮-间质性肿瘤(浆液性、黏液性、子宫内膜样、透明细胞肿瘤等)、性索-间质肿瘤(颗粒细胞瘤、纤维-卵泡膜细胞瘤、支持-间质细胞瘤等)和生殖细胞肿瘤等20多种。病理上可分为良性、交界性和恶性肿瘤,其中良性肿瘤最常见,约占57%,恶性肿瘤占33%,交界性肿瘤占10%。卵巢肿瘤的病理类型多样、且影像学表现复杂,使术前正确定性存在较大困难。
DWI通过检测组织中水分子的扩散反映由病理过程引起的组织细胞密度、细胞膜完整性、细胞外间隙迂曲度和液体黏度等病理改变所致的水分子运动状态的异常[20]。组织内水分子运动的通路和距离由疏水细胞膜和大分子、主动转运机制及微循环共同决定[21],ADC反映了上述结构及功能性因素对水扩散的实际效果。细胞密度、细胞外间隙大小、大分子物质的变化都会影响ADC值。细胞密度高的实体瘤中,细胞外间隙显著减少,水扩散受限更为明显,ADC值降低[22]。近年来,卵巢肿瘤的DWI研究日益增多,包括盆腔肿瘤的检测、鉴别诊断、分类和分级、评估肿瘤侵袭及淋巴结转移、监测肿瘤治疗后的反应及有无复发等[6,23]。
本研究结果证明卵巢癌患者的最小ADC值、平均ADC值和观察者的一致性都与ROI方法的选择有关。对于卵巢癌患者,观察者使用3种方法测得的平均ADC值的一致性都是可以接受的,其中不规则ROI测量方法的一致性最令人满意。最小和平均ADC值的测量很早就被用作评价卵巢癌的指标,然而极少有研究能证明卵巢癌3种ROI测量方法的可靠性。先前评估观察者使用3种ROI方法的一致性研究可见于局部的晚期直肠癌[24]和胰腺腺癌[25],结论指出ROI的大小和位置对平均ADC值有一定影响,特别是全容积法勾画ROI所测得的ADC值能得出最令人满意的结果。一项子宫内膜癌的研究调查了不同形状的ROI对肿瘤ADC值及观察者一致性的影响[26],结论指出由于癌灶存在于宫腔内,其形状近似圆形或椭圆形,不同形状的ROI测量对平均ADC值没有明显影响。最近的一项关于卵巢癌不同形状的ROI对ADC值及诊断良恶性能力的研究指出,不同形状的ROI对于两者均有重要意义[27]。考虑到卵巢癌的复杂性,成分混杂不单一,特别是完全囊性的患者,测量结果不能准确反映病变的生物学特性,本研究采用3种方法进行对比研究。虽然在实际的应用中完全不规则ROI法和部分不规则ROI法测量ADC值的时间较肿瘤内小ROI取样法时间稍长,但统计分析表明时间差异无统计学意义。而全容积法应该更适用于全实性或者实性含量占大部分的肿瘤患者。
对其中任意的两种方法所测得的最小ADC值作分析,结果均有统计学意义,这与Mukuda等[27]的研究结论相一致。更有意义的是部分不规则ROI法测得的最小ADC值的平均值最小,它是沿着肿瘤实性成份最大层面DWI图画出病灶边界,尽可能去除肿瘤的钙化坏死、囊肿、出血等部分,包含成份比较全面。相对于另外两种方法来说,肿瘤内小ROI取样法结果显示平均ADC值显著降低,因为它的取样只包含大部分有活力的实性部分。另外,小ROI取样时已经极大可能地排除了血管、导管、坏死等成份的影响,而实际上这些因素均会导致ADC值的差异。然而,不规则ROI法及部分不规则ROI法能获得相对高的ADC值,因为它们很可能包括实性成份、导管和纤维化等。在临床应用中,肿瘤内小ROI取样法被广泛应用于卵巢癌ADC值的测量。在本研究中,2个独立观察者使用3种测量方法的层面在测量前已达成一致,因为卵巢癌的病灶一般都不规则,范围较大,成份比较复杂,不同的选层标准对测量结果影响很大。本文中尽管小ROI取样的方法显著降低了平均ADC值,但在比较观察者一致性时也是有统计学意义的。因此,我们认为小ROI取样法不是最优的测量方法,而在一个病灶直径最大的层面上去除出血钙化、囊肿、坏死等的部分不规则ROI法更优越。事实上除了病理因素会影响ADC值的测量外,还有其他很多因素:最普遍的有磁场强度、呼吸补偿采集技术、b值的选择,还有后处理方法等从内在影响最终的ADC值[28]。本研究中,所有患者的检查及DWI图像采集在一家医院的同一台1.5T磁共振机器上完成,从而避免了客观上存在的差异。
本研究的不足之处在于:首先,样本数较少,很多情况下由于卵巢癌的病灶范围较大,广泛累及周围器官或超出盆腔,与相邻器官分界不清,病灶里面坏死、出血、囊肿等成份复杂,无法准确地画出病灶的边界。其次,我们获得的DWI图使用了一个相对低的b值(800 s/mm2),它减少了运动伪影的影响及升高了信号噪声比值。相对低的b值能获得相对高质量的图像,但相对高的b值能更敏感地反映组织真实的扩散。为了减少患者的检查时间本研究只使用了两个b值(0和800 s/mm2),许多患者因为病情的原因不能耐受长时间的扫描。理论上来讲采用多个b值能更精确地测量ADC值,近年来IVIM序列越来越广泛地应用于临床研究已经说明了其优越性。再次,我们所使用的3种ROI测量方法所测得的ADC值没有通过不同的磁场强度或者不同的b值来进行比较分析,不同磁场强度或b值的选择可能会带来不同的分析结果。
综上所述,ROI测量方法的不同对最小和平均ADC值、观察者的一致性影响很大,本文的3种方法中部分不规则ROI法对3个指标的评估结果均较好,而完全不规则ROI法相对较差。
