一种比格犬失血性休克模型的建立*
2019-05-16陈健钊陈洁君李日许郭秋平
陈健钊 陈洁君 李日许 郭秋平
(广州医药研究总院有限公司,广州 510240)
失血引起的失血性休克是导致手术和创伤患者死亡的主要原因之一[1]。失血性休克是一种由于失血引起的组织血流灌注过低,导致机体微循环功能不良,组织缺血缺氧,并最终引起细胞损伤的病理过程。目前常用的失血性休克模型有三种:定量出血[2]、定压出血[3-4]和非控制性出血模型[5]。为了更为客观地对抗失血性休克药物进行有效性评价,需要建立一种更加标准化、易于重复和区分药效的失血性休克模型。在失血性休克研究中,犬是目前应用最广的一种动物,其较大的体型使得手术操作和取样更加方便[6]。因此,本实验选用背景数据丰富的比格犬作为实验动物,以血气指标作为衡量休克严重程度的标准,结合固定血压出血,建立重度失血性休克大动物模型,为评价血液制品及血液代用品的效能提供了可能。
1 材料与方法
1.1 实验动物
普通级雄性比格犬15只,10~12月龄,体质量10~12 kg,购自广州医药研究总院有限公司实验动物研究开发中心,许可证号SCXK(粤)2013-0007,实验动物合格证号为No.44006900000267。动物购入后适应性观察期不少于7 d,单笼饲养,定量喂食,自由饮水。选取检疫合格动物进行造模。造模前禁食不禁水12 h。
1.2 实验材料
HSIV大动物吸入式麻醉机(上海曼普生物科技有限公司);MP150十六道生理记录仪(美国BIOPAC Systems公司);i-STAT 1 Analyzer手持式血液分析仪(美国ABBOTT公司);Sysmex 2000iv全自动血液分析仪(日本Sysmex公司);恒温动物手术台(兴化市同昌不锈钢制品厂);微量注射泵(深圳圣诺医疗设备有限公司);数字体温计(大连欧姆龙有限公司);含抗凝剂塑料血袋(四川南格尔生物科技有限公司);异氟烷(宝龄富锦生技股份有限公司);肝素钠注射液(江苏万邦生化医药股份有限公司);0.9%氯化钠注射液(四川科伦药业股份有限公司);丙泊酚注射液(西安力邦制药有限公司)等。
1.3 实验方法
根据动物体质量采用丙泊酚7 mg/kg静脉注射进行诱导麻醉,气管插管后,使用1.0%~3.0%异氟烷维持麻醉。实验动物采用仰卧位保定于恒温手术台,于四肢放置电极记录休克前后心电图的变化。钝性分离颈部肌肉,暴露颈动脉及静脉并留置肝素钠填充的导管,颈动脉导管用于采集动脉血样及手术过程中的血压测定,颈静脉导管用于放血。上述操作完成后,用100单位/kg/h的肝素钠溶液静脉推注进行抗凝处理,待血压稳定时,采集各项指标作为休克前基线数据。
从颈动脉导管快速放血至动脉收缩压50 mmHg左右,放出的血液回收到含抗凝剂的塑料血袋中,通过继续放血或回输血液来维持血压。放血开始30 min后,开始采集动脉血样进行血气分析(后期根据动物情况确定检测时间),当动脉血乳酸和动脉血碱剩余达到标准时,采集静脉血样检测静脉血氧饱和度。模型成功标准为动脉血乳酸9~11 mmol/L,动脉血碱剩余<-12 mmol/L,静脉血氧饱和度<60%。模型建立后,采集各项指标作为休克后数据。
检测指标包括:收缩压(SBP)、舒张压(DBP)、平均压(MAP)、心率、体温、毛细血管再充盈时间(CRT)、脉搏血氧饱和度(SpO2)、动脉血乳酸(Lac)、动脉血碱剩余(BE)、静脉血氧饱和度(SvO2)、动脉血pH、动脉血二氧化碳分压(PCO2)、动脉血氧分压(PO2)、血红蛋白含量(HGB)、红细胞压积(HCT)。
1.4 统计方法

2 结果
2.1 造模基础数据
本实验使用动物15只,其中造模成功动物12只,造模过程中死亡动物3只,模型成功率为80%。模型成功动物体质量为(12.30±1.11)kg,放血量(667±101)mL,按公斤体质量折算为(54.5±8.4)mL/kg,相当于动物自身血量(按动物体质量的8%计算)的(68.1±10.5)%,休克造模时间为(116±70)min。
2.2 休克前后动物一般生理指标的变化
休克前,实验犬心电图正常(图1)。休克后实验犬心电图检查出现心电图电压减弱、P波高抬、ST段下移(图2),提示模型动物心肌受累。如表1所示,与休克前相比,休克后实验犬的SBP、DBP、MAP均显著下降(P<0.001),CRT显著延长(P<0.001),同时体温(P<0.05)和SpO2(P<0.01)也出现明显的降低。此外,休克前后动物的心率略微升高,但并未发生显著的改变。

图1 休克前实验犬心电图Fig.1 Example of ECG before shock
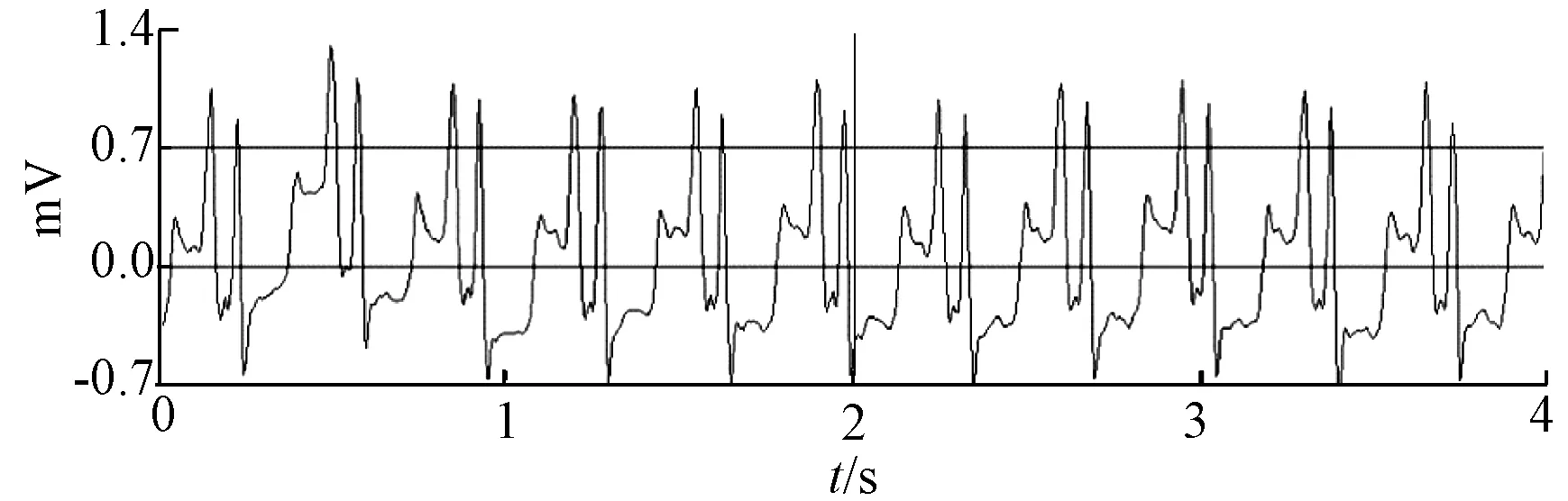
图2 休克后实验犬心电图Fig.2 Example of ECG after shock

表1 失血性休克模型动物休克前后一般生理指标的变化Table 1 The change of general physiological indexes before and after
注:与休克前相比,*P<0.05,**P<0.01,***P<0.001
Note:*P<0.05,**P<0.01,***P<0.001, versus before shock
2.3 休克前后动物血气指标的变化
休克后,实验动物的动脉血Lac显著高于休克前(P<0.001,见表2),动脉血BE、pH、静脉血SvO2与休克前相比显著降低(P<0.001)。而休克前后动脉血PCO2和PO2并未产生明显变化。
2.4 休克前后动物血常规指标的变化
失血性休克模型动物在休克前与休克后对比,血常规指标HGB和HCT均发生了显著升高,其中HGBP<0.01,HCTP<0.001。
表2 失血性休克模型动物休克前后血气指标的变化Table 2 The change of blood-gas parameters before and after
注:与休克前相比,***P<0.001
Note:versus before shock,***P<0.001

表3 失血性休克模型动物休克前后血常规指标的变化Table 3 The change of blood routine indexes before and
注:与休克前相比,**P<0.01,***P<0.001
Note:versus before shock,**P<0.01,***P<0.001
3 讨论
为了实现抗休克药物药效的准确评估,本实验室参考了多种文献报道的传统休克模型的建立方法(如固定血压失血、BE指标等),结合失血性休克的一些临床特点(Lac升高、SvO2降低),建立了一种新型的重度比格犬失血性休克模型。该模型采用多个指标来统一休克的严重程度,更好地模拟临床失血性休克患者酸碱失衡、组织缺氧、低血压的特点,使模型具有高度的标准化。同时该模型也克服了以往传统休克模型由于判断标准单一所带来的模型严重程度差异大的弊端。
在本实验中,经过前期快速失血,将SBP迅速降低至50 mmHg左右,此时降低失血速度,保持SBP稳定,尽可能地减小血压波动。若血压继续过快降低,则回输一定量自体血液以维持血压,待血压稳定后继续放血。随着失血量的增加,实验犬出现严重的酸中毒,Lac继续升高、BE负值增大、血液pH降低。而由于呼吸机维持供氧,动脉血中PCO2和PO2并未发生较大的改变。
模型成功建立时,SvO2降低至29%,提示机体严重缺氧,氧供需严重不平衡。其他的一般生理指标变化如体温降低、CRT升高、SpO2降低,均与临床上失血性休克的表现相一致。国内外研究活动性出血常用的指标为HGB和HCT[7-8],由于本实验造模过程采用的方法为活动性出血,因此也以HGB和HCT作为失血性休克模型严重程度的参考指标。由实验数据可知,休克后HGB和HCT反而发生了显著升高,这可能与文献报道的犬失血后脾脏内血红细胞释放到血循环有关[9]。
本模型成功率80%、失血百分比(68.1±10.5)%,是成模率较高的重度失血性休克模型。由于采用多个指标作为造模成功的标准,使本模型更加客观、准确地模拟了临床中患者进入失血性休克的状态,为我们下一步评价血液制品及血液代用品提供了一个可靠的平台。
