帕金森病食蟹猴系统性模型构建与在体临床过程的动态评价研究*
2019-05-16马任驰罗斌斌
马任驰 罗斌斌 岳 峰,3
(1.广西医科大学,基础医学院,转化医学研究中心,长寿与老年相关疾病教育部重点实验室,南宁 530021)(2.广西南宁灵康赛诺科生物科技有限公司,南宁 530000)(3.首都医科大学宣武医院神经生物学研究室,北京市帕金森病重点实验室,北京 100053)
帕金森病(Parkinson’s disease,PD)是中枢神经系统退行性疾病之一,其主要病理特征是中脑黑质多巴胺能神经元大量变性、缺失和胞质内包涵体-路易小体(Lewy body,LB)生成[1],且纹状体多巴胺能神经元的损失与PD运动症状紧密相关[2]。PD临床表现为肌震颤、肌僵直、姿势不稳、运动迟缓等运动症状[3]。PET利用分子活体成像技术在PD的早期诊断和病情监测发挥了重要作用[4]。由于该病的病理生理机制至今仍未完全明确[5],PD的诊断、治疗仍是现代临床研究中面临的一个棘手的问题。
1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine, MPTP) 对大脑黑质致密部多巴胺能神经元有选择性的破坏作用,是目前国内外公认的诱导动物PD模型的首选造模制剂[6-7]。而系统性MPTP全身给药是最常见、有效的方式[8],其产生可靠的黑质纹状体多巴胺能通路病变,并诱导与人类PD临床特征与药效反应极为相似的改变。有研究表明[9],左旋多巴(L-dopa)是一种用于恢复纹状体生理条件多巴胺(DA)浓度的替代药物,其在适宜浓度范围内可有效缓解PD的症状。
本研究采用连续静脉注射MPTP方式诱导构建食蟹猴PD系统性模型,应用临床评分、PET扫描显像、随意运动量的监测观察PD症状的变化,同时给予L-Dopa干预后是否显著改善PD症状与运动功能等方法评估模型,在体动态模拟了PD的临床过程与特征,为未来PD研究与临床治疗提供了实验依据。
1 材料与方法
1.1 研究对象
健康食蟹猴7只(12.45±2.45)岁;雄性5只,雌性2只,体质量(7.10±1.11)kg,由广西南宁灵康赛诺科生物科技有限公司实验室提供[以下简称灵康公司,SYXK(桂)2014-0004],该实验室经过国际实验动物评估和认可委员会(AAALAC)认证。本研究所有实验均在灵康公司实验室完成。实验期间动物饲养环境和福利得到充分保证:所有动物均在标准单笼饲养,动物房温度16~26 ℃,相对湿度为40%~ 70%,动物笼内照度为100~ 200 lx,12 h明/12 h暗循环交替(7:00开灯/19:00关灯),每日早晚两次(8:00/16:00)喂食标准实验动物猴配合饲料(GB14924.8),并供给不限量安全饮用水,中午提供适量新鲜蔬菜或水果。该研究方案已由动物伦理委员会(IACUC)审核并获得批准。
1.2 材料
MPTP(美国Sigma 公司)、西门子 Biograph Sensation 16HR PET扫描仪,显像剂18F-AV-133(广西医科大学一附院PET中心提供)、多巴丝肼片(上海罗氏公司)、EthoVision XT视频跟踪系统(荷兰Noldus公司)、便携式录像机(日本Sony公司)
1.3 方法
1.3.1MPTP诱导食蟹猴系统性PD模型的建立:7只食蟹猴注射阿托品(0.05 mg/kg)20 min后行氯胺酮(0.2 mL/kg)肌注麻醉,将MPTP-HCl(0.1 mg/mL)每天(上午9:00)以0.2 mg / kg缓慢注入下肢静脉,连续注射14 d,平均总体用量(18.70±2.83)mg。
1.3.2L-Dopa干预:MPTP注射后3个月行L-Dopa(100 mg/次)灌胃干预[多巴丝肼片:规格250 mg(左旋多巴200 mg+苄丝肼50 mg)/片;浓度为1 mg/mL],2次/d(9:00/16:00),持续14 d。
1.4 模型评估
1.4.1PD临床评分:将动物移至标准灵长类行为笼中适应环境至少20 min,在基线与MPTP开始造模后1、2、3 月及L-Dopa干预14 d后进行行为学录像1 h,观察动物在行为笼中的行为变化。结合非人灵长类动物帕金森病模型临床评分量表Kurlan(1991)[10],对动物笼内表现出的临床症状进行双盲评分。评分内容含10项:即静止性震颤(0~3分)、动作性或意向性震颤(0~3分)、面部表情(0~3分)、步态(0~3分)、运动徐缓(全身)(0~4分)、姿势(0~2分)、平衡与协调(0~3分)、下肢总体运动技能(0~3分)、上肢总体运动技能(0~3分)、防御反应(0~2分)。总分最小0分为正常行为,最高29分为最严重。
1.4.2健康状况评估:将体质量作为评价健康状况的生理指标[8],在整个造模期间于每周四下午对动物无麻醉状态下测量一次体质量。
1.4.3随意运动量分析:动物运动轨迹跟踪系统EthoVision XT[11-12]可自动跟踪、监测和量化录像中动物的随意运动距离,以及精细描绘动物在笼内运动的路径轨迹。所有动物1 h行为学录像均采用相同的测试参数,每次测试均执行一次。在测试运动行为之前需要描绘出动物检测区域,然后规定动物在此区域内作为跟踪中心点,同时通过控制指定程序“开始”和“停止”时间来自动采集随意运动量数据。
1.4.4PET显像与图像分析:随机选取其中5只动物,以氯胺酮(7~10)mg/kg肌注麻醉,分别在基线与MPTP开始造模后3 个月行大脑PET 扫描,采用Liu等[13]报道的方法及条件显像。利用放射性配体AV-133与2型单胺囊泡转运体(VMAT2)结合位点的高选择性,通过18F标记后,观察食蟹猴18F-AV-133纹状体的放射性显像情况。扫描操作及图像后处理由PET中心专职技术人员完成。通过计算纹状体特异性摄取率(Sur)评估食蟹猴造模后纹状体多巴胺能神经元的受损程度,定义Sur=[(平均纹状体摄取量 - 平均小脑摄取量)/ 平均小脑摄取量]。
1.5 统计学方法

2 结果
2.1 MPTP诱导PD食蟹猴系统性模型
2.1.1临床评分:所有动物在MPTP开始造模后进行3个月行为学观察,根据PD评分量表对动物表现出的临床症状进行评分。所有动物基线临床评分均为0分。在注射结束时所有动物均出现PD症状,临床评分均达到10分及以上。在1个月时临床评分达到峰值,均出现典型的PD症状,即躯体严重屈曲、两侧肢体震颤、运动迟缓、步态摇晃以及面具脸、竖尾等,严重影响动物的行为活动,同时出现摄食困难和活动不便,甚至出现便秘、夜尿多的自主代谢异常等症状。之后连续观察2个月仍然存在PD运动症状。在2个月(18.43±3.87)、3个月(18.14±3.53)临床症状趋于稳定(见图1),与注射结束时(14.43±1.90)相比,临床评分均显著增高(P<0.05);与1个月时(21.43±5.35)相比,临床评分差异均无统计学意义(P>0.05)。

图1 基线、MPTP注射14 d结束时、1、2、3个月以及L-Dopa干预后临床评分的比较注: *P<0.05Fig.1 The comparison of baseline, after MPTP injectionat the end of 14 days, 1, 2, 3 months, and after L-Dopaintervention about clinical scoresNote: *P<0.05
2.1.2健康状况:通过MPTP开始注射前后以及模型期动物的体质量观察和监测,在造模过程中体质量基本趋于稳定,体质量变化不明显。全程模型期的体质量变化情况见图2。

图2 体质量的变化Fig.2 Changes in weight
2.1.3随意运动量:随着MPTP造模后时间延长,随意运动距离较基线明显减少,即3个月运动距离(809.77±401.15)cm较基线(8627.46±5751.04)cm显著下降(P<0.01)(见图3A)。3个月时1 h内每隔30 s的随意运动距离较基线明显减少(见图3B),动物笼内运动轨迹见图5。
2.1.4PET显像:基线与3个月18F-AV-133 PET显像情况见图4 A。PET显像结果显示,3个月双侧纹状体平均Sur(0.16±0.03)较基线(1.66±0.58)显著下降(P<0.01)(见图4B)。
2.2 L-Dopa干预后运动行为的变化
2.2.1临床评分:所有动物经过L-Dopa干预后PD症状显著改善。L-Dopa干预后(12.86±3.63)与开始造模后1个月、3个月相比,临床评分均显著降低(P<0.05)(见图1)。
2.2.2随意运动量:L-Dopa干预后动物活动增多,运动距离(2645.77±1753.90)cm较开始造模后3个月显著增加(P<0.05)(见图3A)。L-Dopa干预后1 h 内每隔30 s的运动距离较开始造模后3个月明显增加(见图3B),动物笼内运动轨迹见图5。
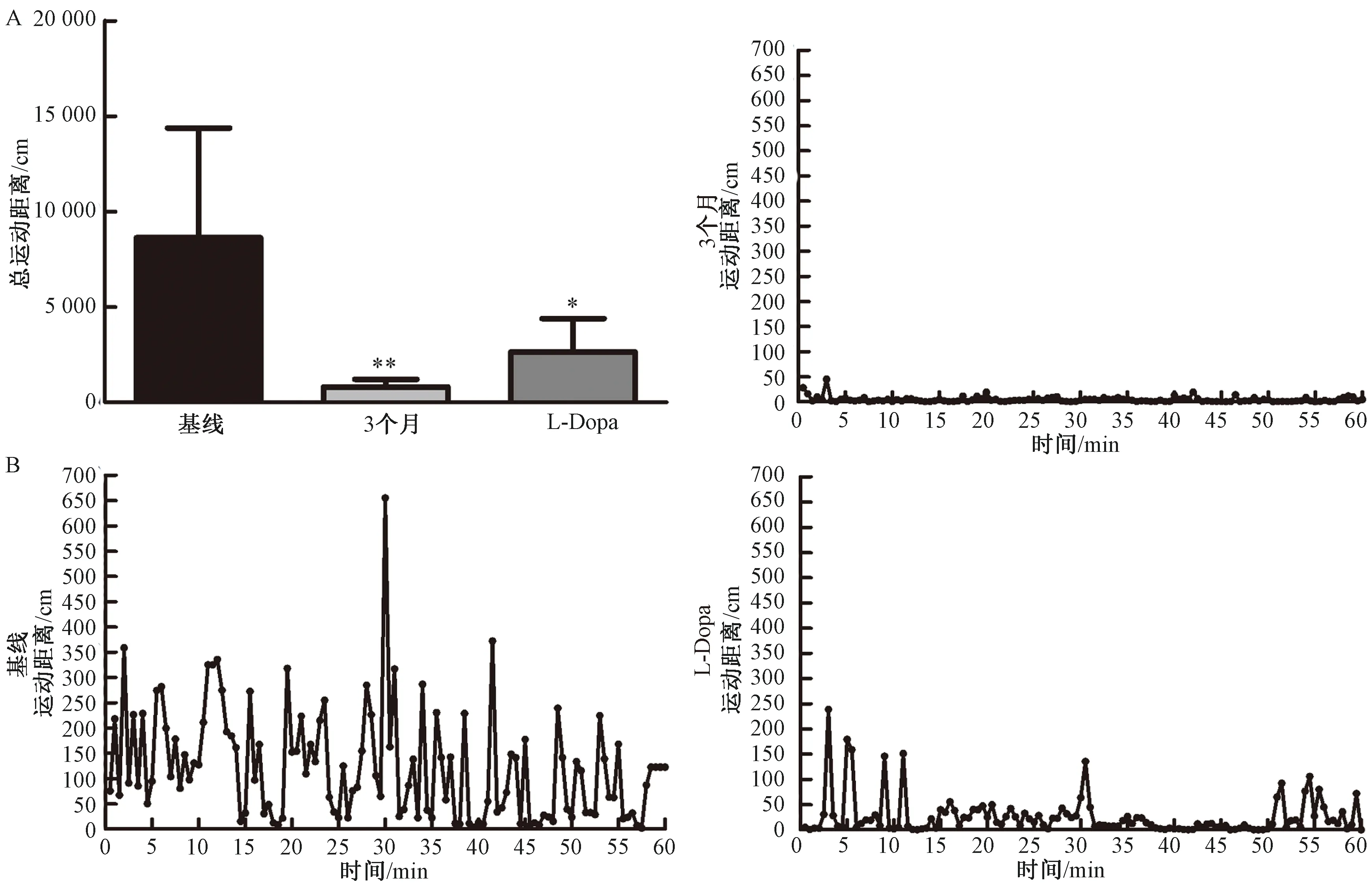
图3 运动距离的变化注:A:与基线比较,**P<0.01;与MPTP开始造模后3个月比较,*P<0.05;B:基线、MPTP开始造模后3个月以及L-Dopa干预后1 h内每隔30 s的随意运动距离情况Fig.3 Changes in the moved distanceNote: A: compared with baseline, **P<0.01; compared with 3 months after MPTP injection, *P<0.05; B: The random moved distance every 30 s within 1 h on baseline, 3 months after the first MPTP injection and after L-Dopa intervention
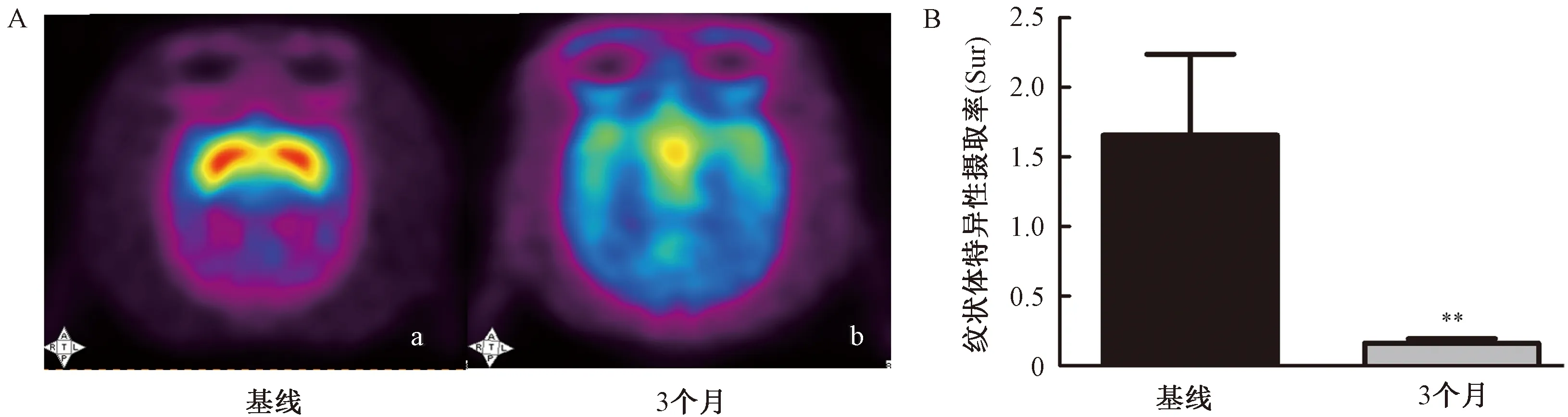
图4 基线与3个月纹状体18F-AV-133摄取的PET显像注:A:a: 双侧纹状体呈现清晰且均匀对称的放射性显像分布;b: 放射性分布对称性减弱;B:与基线比较,**P<0.01Fig.4 PET imaging of striatum 18F-AV-133 uptake ratio on baseline and 3 monthsNote: A: a: bilateral striatum presents a clear and uniform symmetrical radiographic distribution; b: radioactive distribution symmetry is weakened; B: compared with baseline, **P<0.01

图5 基线、开始造模后3个月以及L-Dopa干预后运动轨迹可视图注:红线表示动物运动轨迹路径。Fig.5 Track visualization images on baseline, 3 months after the start of modeling and after L-Dopa interventionNote: The red line indicates the path of the animal’s motion track
3 讨论
在PD基础和临床研究中,建立稳定的动物模型对研究其病因、发病机制及疗效评价至关重要。灵长类动物在进化和结构功能方面与人类非常接近,因此该模型在研究人类脑神经相关疾病中具有独特的模型优势[14-16]。应用MPTP诱导灵长类PD动物模型已被广泛报道[17-18],Emborg等[19]经颈内动脉注射MPTP成功造模,但该方法手术技术要求较高。本研究采用静脉注射MPTP方法构建系统性PD猴模型,操作简便、经济高效,且更接近PD的临床表现。由于PD药物、干细胞、基因治疗评价等临床前转化研究需要在活体状态对模型动物进行动态综合评价,这对灵长类PD模型在临床症状、多巴胺能神经功能的半定量评估、治疗后反应等保持全程的稳定性提出更高的要求。本研究从食蟹猴建模到模型稳定以及给予L-Dopa干预,模拟了整个PD临床过程的动态变化特征。
本研究中食蟹猴静脉注射MPTP 14 d后出现了典型的PD症状,Bezard 等[20]通过表征黑质纹状体变性的动力学,进而确定了PD症状产生是其变性达阈值的结果。而MPTP进入血液循环后,其毒性代谢物MPP+对胃肠系统产生急性毒副作用,故本研究所有动物在开始给药后即进行营养支持与健康监测是降低因体质量快速下降而造成死亡风险的关键。在停止MPTP注射时所有动物临床评分达到10分及以上,以保证每只动物均出现典型PD症状进而最大限度减少个体差异。典型的PD症状连续维持3个月且未死亡,同时伴有不同程度的非运动症状,其可能与蓝斑、相关脑干以及中缝背核等部位病变有关[21]。此外,PET分子影像学数据表明,在开始造模前与造模后3个月注射显像剂18F-AV-133后扫描成像,基线双侧纹状体呈现清晰且均匀对称的放射性显像分布,而造模后3个月放射性分布对称性明显减弱,同时平均 Sur较造模前显著降低(约90%),证明了纹状体多巴胺能神经功能的损失,诊断价值极高。但此方法检查费用昂贵,技术要求高,且显像剂合成操作复杂等限制了其广泛应用。Chen等[22]认为纹状体中突触前多巴胺标志物的进行性丧失与PD表现有关,其中VMAT2减少是黑质纹状体多巴胺神经元变性之前的关键致病因子,其可能是氧化应激引起的突触核蛋白聚集的结果,而本研究造模过程中是否有LB的出现及相关神经元的变性坏死,则需通过神经病理进一步研究。给予L-Dopa干预14 d后,动物PD症状显著改善,运动能力逐渐恢复,活动能力增加,该反应主要针对脑基底节DA含量的不足,与DA神经末梢纤维的缺失有关[23]。同时L-Dopa药效反应也模拟了临床PD的疗效特征。
本课题采用EthoVision运动轨迹跟踪系统的运动活动量评价方法,自动分析动物1 h笼内随意运动距离与运动轨迹。在造模后3个月随意运动距离明显减少,经L-Dopa干预后反而增加,与已报道的结果趋势一致[24]。目前,该方法已有报道用于斑马鱼、鼠类、灵长类动物等运动行为的研究[11, 25-26]。Walton等[27]利用此方法分析了恒河猴在不同年龄段的运动距离与轨迹等,但鲜有报道食蟹猴PD模型的运动行为活动评估。相比其他检测方法[28],此方法更能精确地呈现动物的空间运动轨迹,实现了动物笼内运动行为活动的客观量化、可视化与形象化。
综上所述,连续静脉注射MPTP构建的PD系统性模型临床症状持续存在,多巴胺神经功能损害,且对L-Dopa干预有效,无自发性恢复,在体动态模拟了PD的临床过程,为PD临床转化研究提供了模型依据。
