人参煎剂对实验红鲫经137Cs辐射后肝肾组织HSP70表达量的影响*
2019-05-16李登科彭赞平陈科洁吴端生王余德
李登科 彭赞平 陈科洁 吴端生 王余德
(1. 南华大学衡阳医学院,衡阳 421001)(2. 岳阳市妇幼保健院,岳阳 414000)(3. 南华大学实验动物学部,衡阳 421001) (4.湖南师范大学生命科学学院省部共建淡水鱼类发育生物学国家重点实验室,长沙 410006)
随着人类社会的发展,医学、农业和工业中的电离辐射日趋增加,人类受到来自各方面辐射的威胁,故加强辐射生物效应研究很有意义。辐射可直接诱导机体自由基ROS的产生,自由基与DNA相互作用可诱导遗传损伤[1],导致基因突变、致癌和细胞凋亡[2],影响蛋白质的表达,还可通过增加自由基的形成来启动细胞内一系列氧化应激反应[3]。而肝脏、肾脏作为机体高度代谢活跃的器官,易受到氧化应激损伤,导致其结构和功能受到损害。本实验室培育了标准化的实验红鲫[4],在探讨实验红鲫应用过程中,尝试过实验红鲫应用于辐射生物效应的研究[5]。本文旨在报道137Cs辐照对实验红鲫肝、肾组织HSP70表达的影响,并探讨人参煎剂对实验红鲫的辐射防护效应。
1 材料与方法
1.1 实验鱼及驯化
实验红鲫C1HD系,80尾,雌雄各半,体长为(11.5±0.9)cm,体质量(64.2±1.6)g,均由南华大学实验动物学部提供。实验红鲫驯养于水族箱中,采用曝氯2 d的自来水,驯养7 d后用于实验,水温维持(18±2)℃,pH值(6.48±0.3),溶氧量(6.28±0.5)mg/L。实验期间,按常规投喂维持饲料,并用增氧泵持续充氧。
1.2 主要试剂及仪器
药用人参切片购于长白林宝公司;BCA蛋白含量测定试剂盒及ß-actin一抗购于碧云天公司;HSP70一抗购于Abcam公司;HSP70二抗及SDS-PAGE凝胶配制试剂盒购于康为生物试剂公司。
HXFS-IA生物辐照仪:中国核工业集团;高速冷冻离心机:THERMO公司;凝胶成像系统:Tanon公司;半干/湿转膜仪:北京六一仪器厂。
1.3 方法
1.3.1人参煎剂制备:称取500 g人参切片,将人参加双蒸水浸泡30 min后放于熬制罐中,加入蒸馏水,文火熬制三次,每次熬制1 h,收集三次人参煎剂浓缩至500 mL,制成1 g/mL人参煎剂后用过滤除菌法灭菌,4 ℃保存待用。人参煎剂给药方式为:加浓缩液至养殖水中稀释药液浓度至0.1 g/L后,投放实验鱼浸浴其中。
1.3.2实验分组及处理:实验分组及处理,如表1,分别解剖实验红鲫3尾,提取肝脏、肾脏用于HSP70表达量的测定。

表1 实验分组及实验处理Table 1 Group of Experiments and experimental treatment
辐照处理组均用HXFS-IA生物辐照仪以不同剂量的137Cs一次性辐照。即:将实验红鲫个体放置在HXFS-IA生物辐照仪辐射室内自动旋转的金属载物筒内,鱼体距离辐射源头约150 mm,通过调节辐照时间,辐照仪则自动设定辐射剂量率。
1.3.3HSP70蛋白表达量的测定:肝脏、肾脏组织经匀浆机研磨后,裂解离心提取总蛋白,采用BCA试剂盒检测总蛋白含量。用10%分离胶进行SDS-PAGE电泳(浓缩胶80 V,30 min;分离胶110 V,80 min),湿转法进行蛋白转膜(300 mA,2h),用5%脱脂奶粉常温下封闭2 h;加入一抗HSP70(1∶1 000稀释)以及β-actin (1∶5 000稀释),4 ℃孵育过夜,二抗(1∶3 000稀释)室温下孵育1 h,经洗涤、显影拍照后用软件ImageJ分析目的条带及内参β-actin条带的灰度值。
1.4 统计方法
采用GraphPad Prism 5软件对数据进行单因素ANOVA分析,以P<0.05认为差异有显著性,并用GraphPad Prism5软件制图。
2 结果
2.1 实验红鲫肝脏HSP70蛋白表达量变化
实验红鲫经137Cs辐照及人参煎剂给药处理后,分别于第14、28天取样检测实验红鲫肝脏中HSP70的表达量,结果如图1和图2所示。由图可知,1组和2组的Hsp70的蛋白表达量,无论第14天还是第28天,差异较小,提示单一的人参煎剂处理对肝脏HSP70表达无明显影响。经分析1组、3组和6组的Hsp70表达量变化,发现137Cs辐射可引起HSP70表达量的升高,且随辐射剂量和辐射时间的增加而增加,差异有统计学意义(P<0.05)。分别比较分析3组、4组、5组和6组、7组、8组,发现4组、5组的HSP70表达量比3组有较大幅度的下降,7组、8组的HSP70表达量比6组有较大幅度的下降,差异均显著(P<0.05),表明将人参煎剂用于预防或治疗均可抑制辐射所致实验红鲫肝脏HSP70表达的上升;分别比较4组、5组和7组、8组,发现人参煎剂用做预防或治疗处理时,两者之间的HSP70表达量均无明显差异。

图1 第14天实验红鲫肝脏HSP70表达量注:与4.1Gy辐照组比较,*P<0.05;与8.2Gy辐射组比较,#P<0.05Fig.1 The expression of HSP70 in the laboratoryred crucian carp liver at day 14Note: Compared with 4.1Gy group, *P<0.05; Compared with 8.2Gy group, #P<0.05
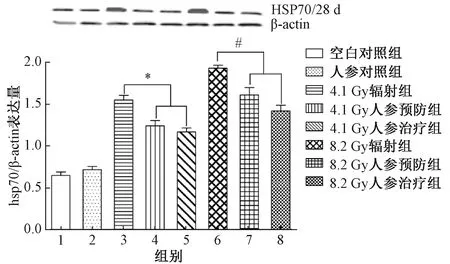
图2 第28天实验红鲫肝脏HSP70表达量注:与4.1Gy辐照组比较,*P<0.05;与8.2Gy辐射组比较,#P<0.05Fig.2 The expression of HSP70 in the laboratoryred crucian carp liver at day 28Note: Compared with 4.1Gy group, *P<0.05; Compared with 8.2Gy group, #P<0.05
2.2 实验红鲫肾脏HSP70蛋白表达量变化
不同实验组的实验红鲫肾脏组织HSP70表达量,如图3和图4所示。由图3和图4经统计分析可知,在137Cs 辐照后第14天,实验红鲫肾脏HSP70的表达量,辐照组的均显著高于对照组、预防组和治疗组的,差异有统计学意义(P<0.05);在经137Cs辐照后第28天,4.1Gy辐照组的实验红鲫肾脏HSP70表达量显著高于对照组的(P<0.05),但与预防组和治疗组的相比,差异均不明显(P>0.05);8.2Gy辐照组的实验红鲫肾脏HSP70表达量也显著高于对照组的和治疗组的(P<0.05),但与预防组的相比,无明显差异(P>0.05)。分别比较3组、4组和7组、8组,同样发现人参煎剂做预防或治疗处理,两者之间的HSP70表达量均无明显差异。
综合以上结果表明,137Cs辐照均能使实验红鲫肝脏和肾脏HSP70蛋白表达量升高,人参煎剂对正常实验红鲫肝脏和肾脏HSP70表达的影响不明显,但人参煎剂能够预防或抑制因137Cs辐照而引起的实验红鲫肝脏和肾脏HSP70蛋白表达量的升高。
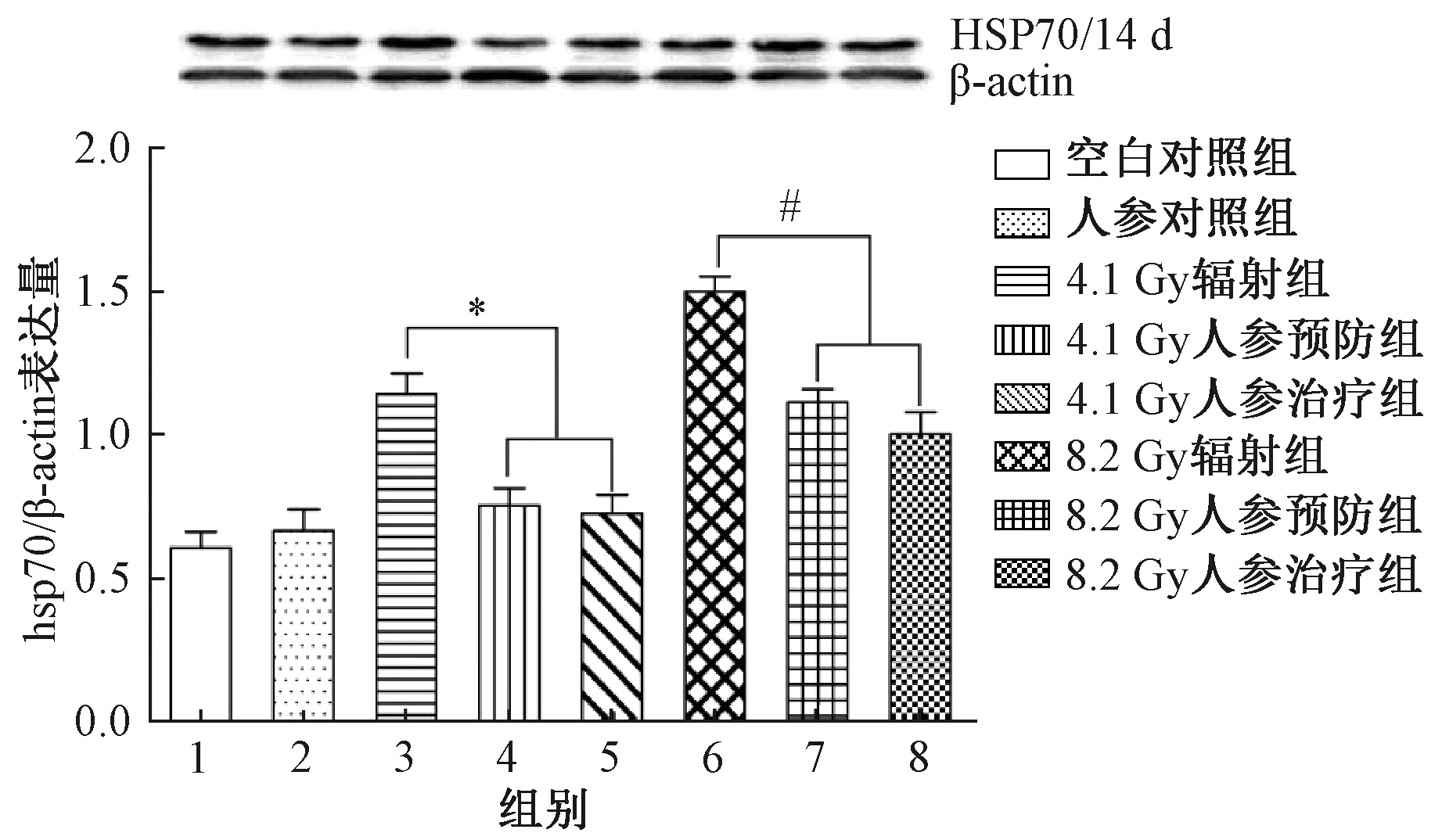
图3 第14天实验红鲫肾脏HSP70表达量注:与4.1Gy辐照组比较,*P<0.05;与8.2Gy辐射组比较,#P<0.05Fig.3 The expression of HSP70 in the laboratoryred crucian carp kidney at day 14Note: Compared with 4.1Gy group, *P<0.05; Compared with 8.2Gy group, #P<0.05
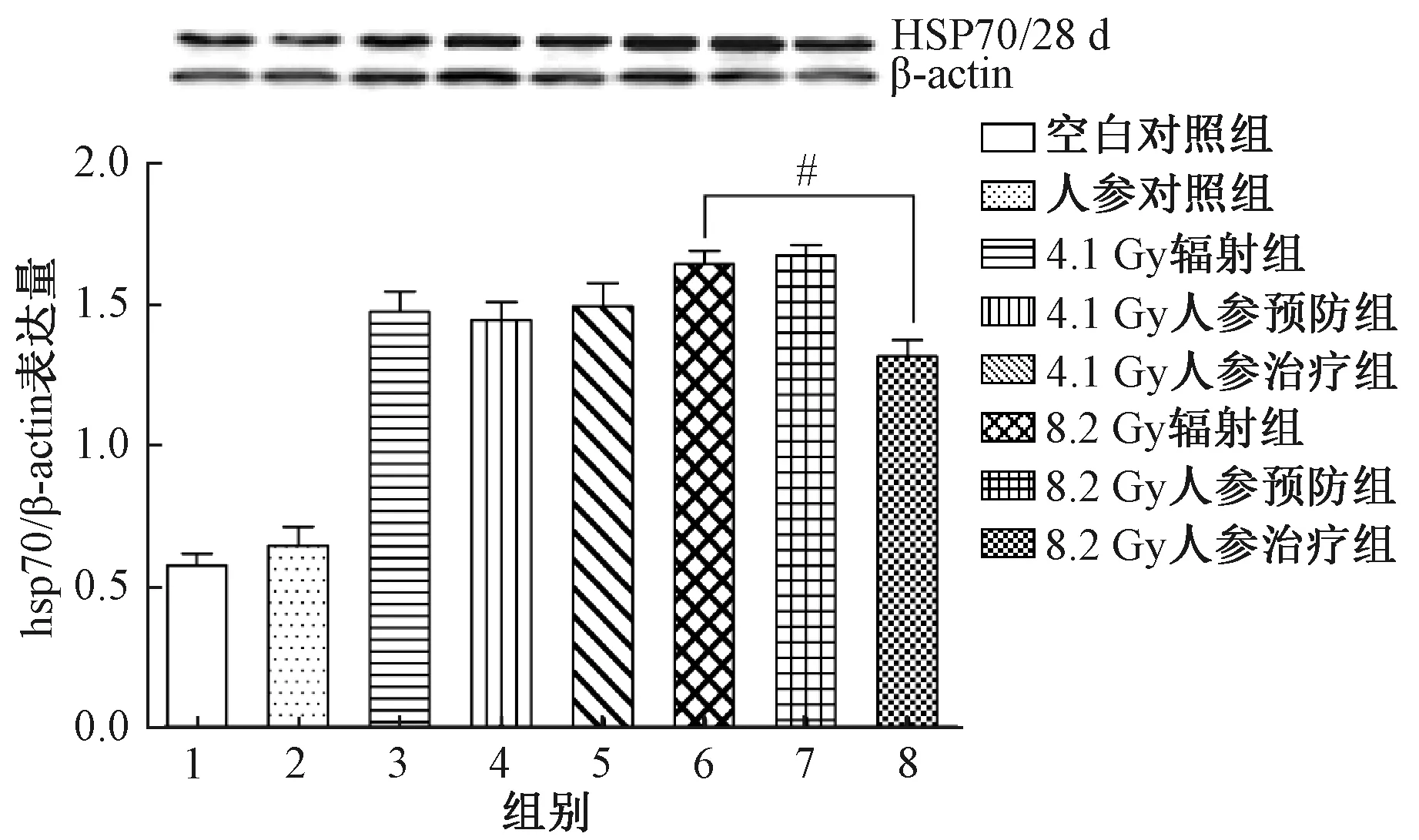
图4 第28天实验红鲫肾脏HSP70表达量注:与8.2Gy辐射组比较,#P<0.05Fig.4 The expression of HSP70 in the laboratoryred crucian carp kidney at day 28Note: Compared with 8.2Gy group, #P<0.05
3 讨论
3.1 HSP70及功能
热休克蛋白(heat shock protein,HSP)属于热应激反应性蛋白,是一种保护性蛋白。它在细胞中执行最基本的生理功能,以维持细胞的生存和功能,在应激的不利条件下,提高细胞的抵抗力,起到应激保护作用[6]。HSP具有分子伴侣的作用,保护蛋白质免受损害或重新折叠有缺陷的多肽,以试图恢复其天然构象[7]。由于HSP家族不同成员的合成会响应各类不同应激源而表达,包括极端生理、环境和病理的损害,故有人提出热休克蛋白可作为环境监测的一般生物标志物[8]。在水产养殖中,鱼类经常遭受高温,水质差,细菌和病毒侵袭,造成机体与环境之间的平衡失调,引起鱼类发生应激反应[9]。HSP70作为HSP家族中的成员之一,能在应激情况下迅速合成,并对应激产生保护耐受作用,在响应热休克,免疫保护,寄生虫感染等应激条件中发挥重要作用[10-11]。
3.2 137Cs辐射与HSP70表达
研究资料表明,生物暴露于辐射环境中可引起体内产生大量的自由基ROS(O2-、H2O2及HO2·、·OH等),而使细胞或组织产生氧化应激反应,进而引发HSP70的大量合成而使细胞减弱氧化应激伤害[12]。本实验结果也发现,实验红鲫经137Cs辐照后肝脏及肾脏中HSP70表达水平均有显著上升,且存在一定的量效关系。HSP70可通过多种途径减少辐射对组织和器官的损伤,可直接抑制ROS产生依赖的NADPH氧化酶的活性,并能控制蛋白复合物的正确折叠、转运、组装和拆卸,维持细胞的正常生理功能[13-14]。有研究表明,通过用紫草红处理人角质形成细胞HaCaT细胞,使HSP70过表达,发现HSP70不仅能干扰半胱天冬酶活化以阻断细胞凋亡,还可通过抑制NF-kB信号传导减少促炎细胞因子(如IL-1b)的产生,起到抗炎作用[15]。此外,HSP70的辐射防护潜力还与其免疫调节能力有关[16]。这些都说明HSP70在调节细胞辐射损伤的修复过程中起关键作用。
3.3 人参抗辐射氧化损伤
人参对辐射所致机体损伤的保护作用已有文献报道[17]。本实验结果也表明,实验红鲫在经4.1 Gy和8.2 Gy辐照后,HSP70的表达量增加,说明HSP70具有抗氧化应激的作用,这一实验结果与本课题组前期实验结果相吻合[5]。本实验结果也表明,经人参煎剂处理(预防或治疗)的实验红鲫肝、肾HSP70的表达量均显著下降,提示人参煎剂具有抗辐射氧化损伤的作用。已有的研究表明, 人参煎剂抗辐射氧化损伤的机理可能与人参皂甙的药效有关。人参皂甙是人参发挥药效的主要活性物质,可通过清除机体产生的多余自由基发挥其抗氧化能力,具有抗炎,辐射防护,抗应激,免疫调节,抗疲劳和抗肿瘤等特性[18-19]。此外,人参可通过调节细胞凋亡信号通路来发挥对辐射致肝损伤的保护作用[20]。本实验中,在8.2Gy137Cs辐照实验红鲫后第28天时辐照组肾脏HSP70表达量与预防组、治疗组的差异不明显,可能是人参药效减弱所致;而肝脏HSP70表达量均高于预防组和治疗组的HSP70表达量,可能是由于人参皂甙在实验红鲫体内的肝肠循环使肝脏仍有一定的药物浓度。
3.4 实验红鲫应用于辐射生物效应研究
实验红鲫C1HD系是南华大学吴端生教授研究团队近年来培育的中国本土的实验鱼类近交系,具有应用于毒理学研究和环境安全性评价的许多优点[21],在辐射生物效应方面曾做过实验,结果表明,实验红鲫经137Cs辐照1.92Gy剂量即可出现血液生理生化指标的改变,相当于人类的0.5Gy辐照剂量,表现为肝脏、肾脏、脑及心脏等不同程度的损伤,且存在着一定的“剂量-时间-效应”关系[5]。2016年12月,湖南省质量技术监督局发布了《实验红鲫C1HD系遗传质量控制》地方标准[4]。通过本次实验,作者认为实验红鲫作为辐射生物效应研究的模式动物是可行的。
