菌群感应AHLs分子对小鼠肠道菌群多样性影响的分析*
2019-05-16付凯飞王欲晓吴成林钦可为周丽君
付凯飞 李 军 王欲晓 吴成林 钦可为 周丽君
[1. (原)海军总医院中心实验科,北京 100048][2. (原)海军总医院科研科,北京 100048]
对于人和动物而言,机体内微生物菌群的稳态在机体的生存和健康方面发挥着异常关键的作用,某种常驻微生物的比例失衡会导致整个微生物稳态的破坏,继而诱发疾病的产生[1]。而菌群感应(quorum sensing, QS)现象是普遍存在于细菌群体内的一种通过自身合成的信号分子感知周围环境,并进而调控细菌密度和生理功能的自调控现象[2]。其中AHLs是革兰阴性菌QS系统中最重要的一类信号分子,可以调控细菌多种生理特性的表达,也是近年来的研究热点。然而,AHLs是否会干扰机体一定区域内微生物菌群的多样性构成以及整个微生态稳定,尚未见相关研究报道。本研究主要采用外源性菌群感应信号分子3-oxo-C10-HSL为作用因素,通过16 s rRNA高通量测序平台分析小鼠肠道内的微生物种类和多样性变化情况,以期对AHLs在机体微生物菌群调节方面的作用有更深入的了解,为疾病状态下致病菌的预防和临床治疗提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1实验动物:6周龄SPF级BALB/c健康雌鼠12只,体质量(16.5±2)g/只,购于军事医学科学院实验动物中心,实验动物质量合格证:SCXK-(军) 2012-0004;实验动物使用许可证:SYXK-(军) 2012-0012。
1.1.2试剂与耗材:N-(3-oxodecanoyl) homoserine lactone (3-oxo-C10-HSL, AR级)购于北京瀚普医药有限公司;玉米油(AR级)购于上海阿拉丁公司;无水乙醇购于国药试剂有限公司;通用细菌采样管购于友康基业生物科技公司;细菌基因组DNA提取试剂盒购于天根生物有限公司;KAPA Taq PCR Kits购于KAPA Biosystems 公司;MinElute胶回收试剂盒购于QIAGEN 公司;NEB Next® UltraTMDNA Library Prep Kit for Illumina建库试剂盒购于New England Biolabs 公司。
1.2 方法
1.2.1动物分组与样品采集:BALB/c小鼠在25~26 ℃下饲养,统一喂食,自由饮水,饲养至6周龄,体质量为(18.5±2)g/只,随机分为对照组和3-oxo-C10-HSL 处理组,每组6只。将用玉米油稀释的3-oxo-C10-HSL工作液(50 mmol/L)采用腹腔注射法处理小鼠,对照组单纯注射玉米油。首次注射后24 h以拭子涂抹法分别在十二指肠及空回肠部位进行采样(C1为对照组十二指肠部位样品;C2为对照组空回肠部位样品;A1为AHLs处理组十二指肠部位样品;A2为AHLs处理组空回肠部位样品),取样后迅速置于-80 ℃冻存备用。
1.2.2DNA提取与文库构建:细菌基因组DNA提取试剂盒(北京TIANGEN公司)提取宏基因组DNA,PCR扩增16S rDNA V3-V4区,通用引物为340F: CCTACGGGNBGCASCAG,805R:GACTACNV GGGTATCTAATCC。扩增产物纯化后混样构建文库,对文库进行Qubit定量和检测,筛选合格文库。
1.2.316S rDNA测序与序列优化处理:合格文库采用Illumina Hiseq 2500高通量测序平台对16 s rRNA V3-V4区域测序进行双端测序,测序长度为250 bp。利用FastQC软件对原始序列质量进行评估后,Trimmomatic软件做质控,过滤低Q值reads后重新进行评估,利用FLASh(Fast Length Adjustment of Short reads)软件根据PE reads间overlap关系将通过质控的成对 reads 拼接成一条序列,得到tags序列。
1.2.4OTU生成及丰度分析:利用QIIME(Quantitative Insights Into MicrobialEcology)软件包[3]进行OTU及多样性分析。用usearch61软件进行嵌合体序列的去除[4-5]和uclust法[5]对序列进行97%相似水平聚类,得到所有OTU;RDP Classifier法[6](confidence cutoff=0.8)对OTU进行分类学(Taxonomy)注释。同时计算α多样性指数,包括Chao1指数[7]、Shannon-Wiener指数[8]及Simpson指数,并绘制指数曲线。
1.2.5物种分类比较及β多样性分析:根据OTU分类学注释结果对每组微生物菌群进行物种分类。
1.2.6OTU及物种组间差异分析:根据组内平均OTU丰度,利用非参数统计方法wilcox检验分别对不同分组样品物种进行显著性差异分析,找出组间显著差异的OTU及物种,差异显著性水平定义为P=0.05。
2 结果
2.1 样本数据量的统计及高质量测序数据的筛选与统计
Illumina高通量测序共得到122 828~364 726个原始reads,碱基总量为30.71~90.18 Mbp,软件Trimmomatic质控后优质reads在112 388~339 376之间,碱基总量在27.87~84.23Mbp之间,质量评分30分以上的占90.21%以上,表明质控后数据量足够,数据质量高。将质控后reads根据PE reads之间的overlap关系利用flash软件将成对序列拼接为完整数据对,得到有效序列大于50 912条,平均长度大于459.98 bp,数据量足够,序列质量高,符合下游实验要求。
2.2 小鼠肠道微生物菌群多样性分析
2.2.1样品OTU聚类结果:根据97%的相似性水平对肠道样品进行OTU聚类,按分组内样品平均OTU聚类结果进行统计。如图1a所示,4组样品的测序量依次增多时,chao1指数增长逐渐放缓,测序量再增多对chao1指数的增长无太大贡献,表明各组样品测序合理,测序量已经足够,基本覆盖了组内所有的物种。chao1丰度指数提示,3-oxo-C10-HSL(A1和A2组)对小鼠十二指肠部位和空回肠部位内微生物菌群多样性均有抑制,其中对十二指肠部位菌群的多样性抑制明显,空回肠部位内菌群多样性抑制略差。
2.2.2样品中微生物多样性结果:根据OTU聚类统计,利用shannon指数公式构建分组内样品平均多样性水平shannon-wiener指数曲线。如图1b所示,4组样品的shannon指数曲线并不随测序深度的增加而增大,而是趋于平坦,表明各组样品测序深度足够,测序量合理,基本覆盖了组内所有的微生物群落。Shannon多样性指数提示,3-oxo-C10-HSL(A1和A2组)可提高小鼠十二指肠部位和空回肠部位内的微生物多样性,其中对十二指肠部位微生物的多样性提高明显,空回肠部位内微生物多样性提高程度略差。
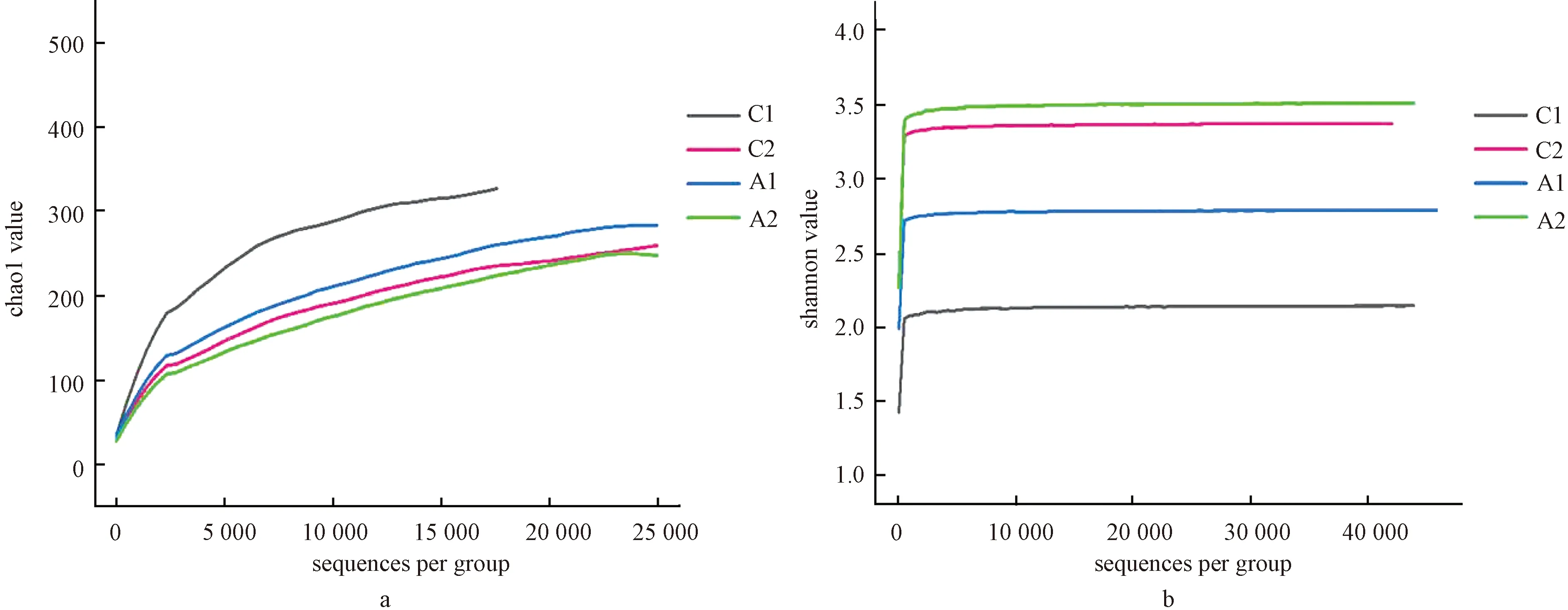
图1 小鼠肠道不同样品组微生物菌群多样性分析注:a: chao1指数分析;b: shannon-wiener指数分析Fig.1 Microbial flora diversity analysis of different mice intestine samples groupsNote:a: chao1 analysis;b: shannon-wiener analysis
2.3 小鼠肠道微生物菌群结构分析
门水平菌群结构分析:小鼠肠内共检测出22个门的细菌,主要以厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为主。同一取材部位不同处理组相比较,外源3-oxo-C10-HSL对菌群门水平的影响无显著差异;但同一组别内不同取材部位的样品门水平菌群分布差别较大,在十二指肠部位,对照组及3-oxo-C10-HSL处理组厚壁菌门百分比分别为69%和75.47%,远高于变形菌门(21.01%和24.27),而在空回肠部位,两组内厚壁菌门和变形菌门分布水平较相近(45.22%~50.92%)。见表1。

表1 小鼠肠道主要细菌占比情况表[序列标签(tags)百分比,n(%)]Table 1 The proportion of dominant bacteria inmice intestine [tags percentage, n(%)]
属水平菌群结构分析:小鼠肠内共检测出109个细菌属,主要有葡萄球菌属(Staphylococcus)、埃希氏菌-志贺菌属(Escherichia-Shigella)、肠球菌属(Enterococcus)、乳球菌属(Lactococcus)、假单胞菌属(Pseudomonas)、变形杆菌属(Proteus)、节杆菌属(Arthrobacter)、(Lysinibacillus)、短波单胞杆菌属(Brevundimonas)及拟杆菌属(Bacteroides)等。外源3-oxo-C10-HSL作用后,肠内不同部位菌群构成均有明显变化,如图2所示,对照组十二指肠部位微生物菌群主要以葡萄球菌属为主,其次为假单胞菌属,3-oxo-C10-HSL作用后,这两个细菌属水平分别由67.7%、18.43%降至36.19%和0.01%,大肠杆菌-志贺菌属和肠球菌属水平显著上升;对照组空回肠部位微生物菌群主要以大肠杆菌-志贺菌属为主,其次为乳球菌属,3-oxo-C10-HSL作用组葡萄球菌属和肠球菌属水平明显上升,乳球菌属水平大幅度下降。
2.4 小鼠肠道微生物菌群物种丰度分析
将C1、C2、A1、A2样品组内属物种丰度相加,按照从大到小进行排序,选取top50(unclassified除外)的属物种进行热图分析(图3a),其中颜色从蓝到红,表示对应的菌落丰度由小到大,结果显示丰度最高的菌属为大肠杆菌-志贺菌属,而菌落丰度最高的样品组为A2组。利用非参数统计wilcox检验分别对各组样本聚类OTU进行显著性差异分析,3-oxo-C10-HSL处理后(A1和A2组)十二指肠部位和空回肠部位均有显著差异变化的OTU共有13个,分类结果显示分别属于葡萄球菌属、肠球菌属和大肠杆菌-志贺菌属。对于十二指肠部位取材样本,除OTU120(葡萄球菌属)丰度显著下降外,其余12个差异显著OTU(肠球菌属和大肠杆菌-志贺菌属)丰度均增加(见图3b);对于空回肠部位样品,OTU120、OTU213、OTU337、OTU387、OTU594、OTU727、OTU745和OTU774丰度显著上升,OTU266、OTU268、OTU315、OTU428和OTU450丰度显著下降,即显著提高葡萄球菌属、肠球菌属的丰度,但抑制大肠杆菌-志贺菌属的丰度(见图3c)。

图2 3-oxo-C10-HSL 作用24 h小鼠肠内不同部位属水平菌群的变化Fig.2 Changes of the intestinal bacteria genus at different positions after3-oxo-C10-HSL treatment for 24 h in mice intestine

图3 不同样品组小鼠肠道微生物菌群物种丰度分析注: a: 各组样本在属水平的菌落丰度热图; b: 外源3-oxo-C10-HSL对小鼠十二指肠部位微生物菌群聚类OTU的调控;c: 外源3-oxo-C10-HSL对小鼠空回肠部位微生物菌群聚类OTU的调控)Fig.3 The intestinal microbial flora abundance analysis of different sample groupsNote: a: The heatmap of different group samples on the genus level; b: The regulation of exogenous 3-oxo-C10-HSL on mice duodenum microbial community OTU; c: The regulation of exogenous 3-oxo-C10-HSL on mice jejuno-ileum microbial community OTU
3 讨论
在细菌对宿主的感染机制研究中,除了细菌本身产生的毒力因子、生物膜等参与感染过程,在细菌生理过程中发挥重要调控作用的AHLs信号分子也不容忽视。研究证实,长链AHLs可参与调控多种致病菌的多种生理功能,还可引发宿主机体的免疫失调,如,3-oxo-C10-HSL可提高铜绿假单胞菌的抗生素耐药性[9],3-oxo-C12-HSL可引起宿主炎症反应和其他免疫系统应激[10-12],C12-HSL可增加空回肠部位沙门氏菌生物膜的形成[13],增强其耐药性。而在AHLs作用下,机体内微生物含量最丰富的部位——肠道微生物稳态是否也会受到影响,目前尚不明确。
大量研究已证实,人和多种动物的肠道内都蕴含着极其复杂多样的微生物群落[14-15],在机体健康状态下,这些微生物群落内部各种群间生长扩繁维持在稳定的状态,形成微生物稳态[16]。而当机体处于异常状态下,如感染、内分泌失衡等疾病状态或饮食结构改变等情况下,肠道内的微生物稳态也会被打破,并可能进一步导致机体发生相应的机能变化[17-18]。近年来,随着高通量测序技术和各种新的种系聚类方法对微生物群落结构的研究进展,极大促进了人们对肠道微生物的深入了解。本研究即是通过Illumina Hiseq 2500测序平台,运用16S rDNA高通量测序技术[19-20]分析3-oxo-C10-HSL作用后小鼠肠道的微生物组多样性变化情况,弥补了传统检测方法中体外培养分离微生物种类有限的弱点,通过分析精准的大信息量数据以明确菌群感应信号分子对小鼠肠道微生物多样性的影响,可以为感染性疾病的相关研究提供数据依据。
本研究通过对样品16S rDNA扩增的V3-V4区域测序,在小鼠肠道内共检测到16个细菌门类,47个细菌属类。在3-oxo-C10-HSL信号分子作用下,肠道相同部位菌群门水平的分布无明显变化,但可影响相同取材部位菌群属水平的分布构成,主要表现为降低葡萄球菌属(十二指肠部位)、假单胞菌属及乳球菌属分布水平,而增加大肠杆菌-志贺菌属、肠球菌属、葡萄球菌属(空回肠部位)和肠球菌属水平,且3-oxo-C10-HSL对不同部位的葡萄球菌属作用亦不同。此种现象说明,外源AHLs不仅可调控多种革兰阴性菌的比例,亦可调控部分革兰阳性菌的比例,其调控可能涉及如下因素:一是外源3-oxo-C10-HSL改变了周围环境中的不同种类AHLs分子的比例,并进而影响了AHLs在菌体内的综合调控效应,造成了细菌种群构成的上升或下降,这一点与Swift 等在Aeromonashydrophila中的研究相似[21];二是AHLs分子虽然主要由革兰阴性菌产生,但近年研究也发现个别革兰阳性菌也会产生AHLs分子[22],说明不同细菌种群间的菌群感应系统存在复杂的信号交流机制,可以相互影响,Winzer等学者的研究也为这一理论做了支持[23]。
本文研究提示,小鼠肠道细菌基因组含量丰富,且不同部位微生物分布构成存在差异,并与菌群感应信号分子存在密切联系。研究获得的相关研究数据对于探寻机体肠道微生物菌群分布失衡调控机制,以及肠道感染性疾病的防治提供了新的思路。
