纳米银溶胶介导的表面增强 拉曼用于细菌的鉴定研究
2019-05-16游华建鲁增辉张德利陈仕江
游华建, 鲁增辉, 石 萍, 张德利, 陈仕江
(重庆中药研究院,重庆 400065)
随着食源性病原体的污染逐年增长和细菌耐药性问题的日益严峻,细菌的快速高效检测已成为全球关注的问题。目前病原菌的检测主要依靠常规的培养方法,需经富集培养、选择性分离、形态特征观察、生理生化反应、血清学鉴定等过程,周期长(24~72 h),费时费力,不能满足临床对感染性疾病早期诊断和及时、有效治疗的需求。利用振动光谱获得细菌特殊的生化“指纹”早有研究。早在20世纪60年代,研究者曾建议用红外光谱进行细菌的检测[1],Naumann等通过红外指纹图谱对菌种和菌株级别的细菌进行了鉴别[2-4],但是红外光谱对水非常敏感,水的红外信号会严重干扰样本的检测,因而不能充分发挥其在生物样品中的检测优势。而拉曼光谱是一种非破坏性、无需样品预处理的分子结构分析手段。相比于红外吸收谱而言,拉曼光谱不仅能够互补提供微生物的结构信息,而且水的拉曼光谱信号极其微弱,这使得水溶液样品的原位拉曼检测成为可能,且拉曼光谱具有很窄的“指纹”图谱,各种物质之间的拉曼光谱互不干扰,使得其在宽范围的激光波长下能够提供更加具体和更易解读的生化信息。拉曼光谱因具有以上优点,结合数理统计方法被广泛用于细菌等生化样本的检测与鉴别[5-10]。不仅如此,拉曼散射光谱作为研究物质结构、分子的振动能级以及晶体中晶格的光学声子振动能级的一个强有力的工具已有70多年的历史。现今,拉曼光谱已被广泛应用于材料科学、生物医学、药物学、无损分析领域、农业与食品分析领域、宝石鉴定与考古领域、安全检查和刑侦领域等方面。本研究基于表面增强拉曼光谱在细菌检测方面的优势,用微波法制备得到银溶胶用于多种细菌的检测,运用PCA-LDA(主成分分析-线性判别分析)判别模型,对两种大肠埃希菌和两种金黄色葡萄球菌实现准确鉴别,为临床上细菌的快速分类鉴定提供思路和依据。
1 材料与方法
1.1 材料
1.1.1 菌种来源 大肠埃希菌JM109和DH5α、金黄色葡萄球菌ATCC25923为实验室冻存,MRSA为重庆市璧山中医院检验科馈赠。
1.1.2 培养基 LB肉汤培养基购自北京陆桥技术有限责任公司。
1.1.3 试剂及仪器 显微拉曼光谱仪(785 nm IDRaman micro,美国Ocean Optics),紫外-可见分光光度计(UV-2450,日本岛津),格兰仕(Galanz)P70D20TL-D4微波炉,激光粒度分析仪(Mastersizer 2000,英国马尔文),超净工作台(SWCJO,苏州净化),细菌培养箱(MJ-160,上海贺德),麦氏比浊管(API 70900,梅里埃)AgNO3(99.7%,上海阿拉丁);柠檬酸三钠、氨水(25%)、NaCl为分析纯,均购自重庆川东化工(集团)有限公司。
1.2 方法
1.2.1 银溶胶制备 据文献报道,银溶胶的SERS增强效果明显优于金溶胶[11-13],因此本研究采用银溶胶增强细菌的SERS信号。制备方法:用去离子水配制0.001 mol/L硝酸银溶液100 mL与1%的柠檬酸三钠溶液2.6 mL置于锥形瓶中,加塞棉花塞以防止水分蒸发,充分混合后微波炉加热,由于微波炉的品牌和型号不同,对加热时间进行优化。中低火分别加热10、20、30 min,自然冷却,用0.22 μm微孔滤膜过滤后将其密封避光置于4 ℃保存以备用。
1.2.2 细菌培养 取3.75 g LB肉汤培养基粉末于150 mL蒸馏水中,加热煮沸完全溶解,121 ℃高压灭菌20 min备用。在36支灭菌后的玻璃试管内各加入5 mL 灭菌后的LB肉汤培养基,并将所有试管分成4组(9支一组),分别加入大肠埃希菌JM109、DH5α、金黄色葡萄球菌ATCC25923和MRSA甘油混合菌液各20 μL,37 ℃培养过夜,用生理盐水(0.9% NaCl)经比浊管测定,分别制成麦氏浊度为0.3、0.4、0.5、0.6、0.7的细菌菌液。
1.2.3 细菌浓度测定 为确保所检测的4种细菌样本浓度尽量相等,采用细菌比浊法和紫外-可见分光光度法对每种细菌样本进行计数,考察两种方法的相关性,建立浊度与吸光度之间的标准曲线,进而通过测定菌液吸光度求算菌液样本的浊度,以此表征细菌浓度。取不同麦氏浊度的菌液,以生理盐水作为空白对照,按照《中国药典》二部附录Ⅳ A所记载的方法测定其吸光度,以麦氏浊度-吸光度建立4种菌液的标准曲线。
1.2.4 细菌SERS检测 ①溶胶加热时间优化:制备得到的不同加热时间的银溶胶分别与MRSA菌液(麦氏浊度0.5)以体积比1∶1充分混合置于硅片上检测。检测条件:积分时间5 s,激光器功率11.5 mW,波长785 nm。每个样本测5次,用Excel和Origin 9.0软件作平均光谱图。②银溶胶与菌液体积比优化:将优化过加热时间的银溶胶与MRSA菌液(麦氏浊度0.5)以体积比2∶1、1∶1、1∶2充分混合置于硅片上检测。检测条件:积分时间5 s,激光器功率11.5 mW,波长785 nm。每个样本测5次,用Excel和Origin 9.0软件作平均光谱图。③银溶胶与菌液作用时间优化:由于银溶胶具有较强的杀菌作用,而死细菌检测不到Raman信号,通过优化后的银溶胶与MRSA的作用时间,筛选出最佳检测时间。将优化过的银溶胶和菌液按最佳体积比充分混合,置于硅片上检测。检测条件:积分时间5 s,激光器功率11.5 mW,波长785 nm。每个样本测5次,用Excel和Origin 9.0软件作平均光谱图。④银溶胶与细菌相互作用的SERS检测:将优化后的银溶胶与大肠埃希菌JM109、DH5α,MSSA(金黄色葡萄球菌ATCC25923)、MRSA四种菌液(麦氏浊度均为0.5)以最佳体积比充分混合后,经最佳作用时间后,置于硅片上检测。检测条件:积分时间5 s,激光器功率11.5 mW,波长785 nm。每个样本测5次,用Excel和Origin 9.0软件作平均光谱图。
1.2.5 光谱预处理 本研究中所有的拉曼图谱均用LabSpec 5.0及Origin 9.0进行处理和绘制,利用LabSpec 5.0软件自带的基线校正功能校正基线,利用Origin 9.0进行平滑处理,采用Savitzky-Golay法对局部数据进行多项式回归,多项式次数为2次,窗函数所包含的数据点个数为20。
1.2.6 细菌拉曼光谱统计分析 ①模型判别:为了更有效地区别不同种的大肠埃希菌(JM109、DH5α)和不同种的金黄色葡萄球菌(MSSA、MRSA)之间Raman光谱,采用MATLAB 2014a软件通过主成分分析法结合线性判别分析统计方法,对不同种大肠埃希菌和金黄色葡萄球菌的光谱数据进行处理和分析。分别培养4种菌液样本,每种菌液培养9管,取其中6管菌液样本,每个样本分别检测5次,得到30例光谱数据,参考郑祥权等[14]报道的多元统计算法模型进行主成分分析,判断该模型用于细菌鉴别的正确率。②模型验证及盲样测试:取剩余的每种菌液各3管,每个样本检测2次,分别得到了每种细菌的6例光谱数据,对参考的数学模型进行盲样测试,验证该模型对大肠埃希菌(JM109、DH5α)和不同种的金黄色葡萄球菌(MSSA、MRSA)的鉴别正确率。
2 结果与分析
2.1 细菌浓度
以不同的麦氏浊度-吸光度拟合得到的4种菌液的标准曲线见图1。结果表明4种菌液吸光度与浊度在0.3~0.7范围内线性关系良好,通过测定吸光度值,运用线性方程计算,得到细菌的浊度值。经延长培养时间或加培养基稀释的方法将每种菌液浊度控制在0.5,以保证检测的细菌浓度相等。

图1 4种细菌麦氏浊度-吸光度拟合曲线Fig.1 Four kinds of bacteria MAH turbidity-absorbance fitting curve
2.2 银溶胶优化
2.2.1 银溶胶微波加热时间优化 加热不同时间的银溶胶经激光粒度仪表征其粒径和电位,结果如图2~4所示。将加热不同时间的银溶胶与MRSA菌液(麦氏浊度0.5)等体积混合,作用相同时间后,分别进行SERS检测,结果表明微波加热20 min制得的银溶胶的SERS增强效果明显优于加热10 min和30 min条件下的银溶胶(图5)。因此得到银溶胶的最佳制备条件:0.001 mol/L硝酸银溶液100 mL与1%的柠檬酸三钠溶液2.6 mL充分混合后微波炉中低火加热20 min。
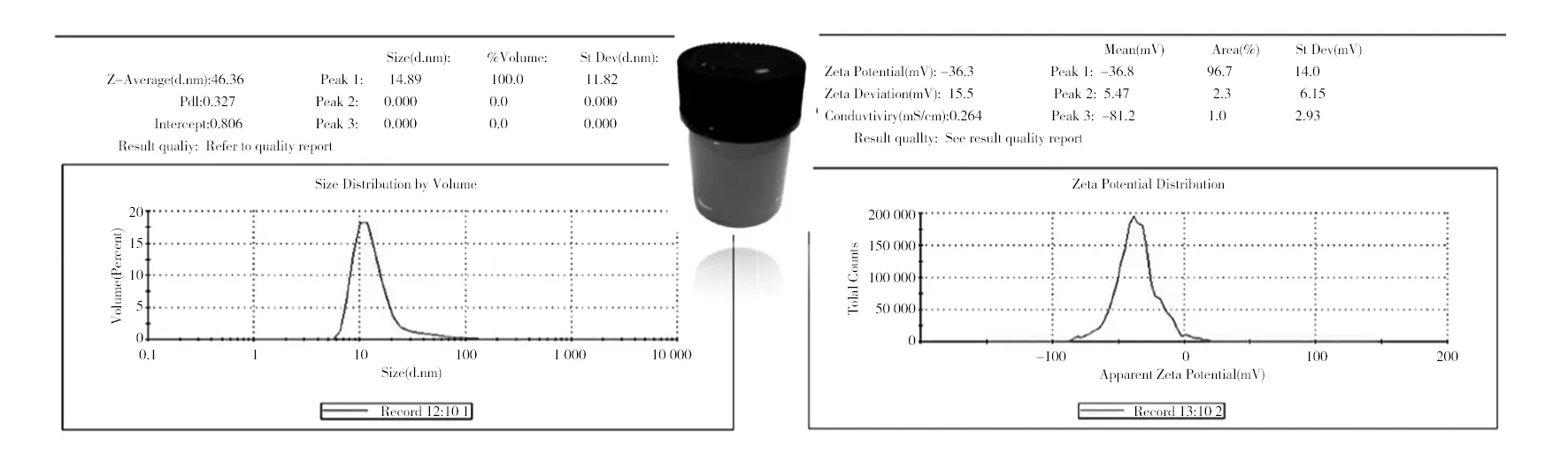
图2 中低火加热10 min制得的银溶胶的粒径和电位图Fig.2 Particle size and potential diagram of silver sol prepared by low and medium heat 10 min

图3 中低火加热20 min制得的银溶胶的粒径和电位图Fig.3 Particle size and potential diagram of silver sol prepared by low and medium heat 20 min

图4 中低火加热30 min制得的银溶胶的粒径和电位图Fig.4 Particle size and potential diagram of silver sol prepared by low and medium heat 30 min
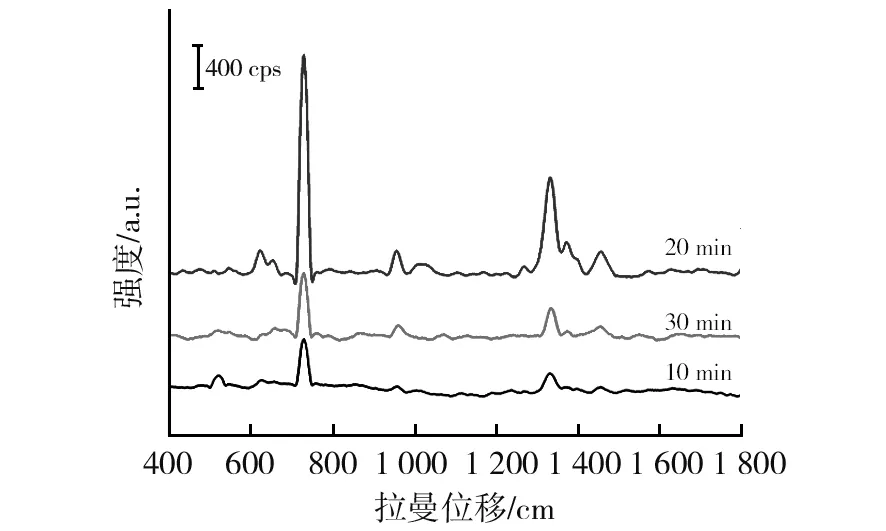
图5 不同加热时间制得银溶胶用于 MRSA检测的SERS图谱Fig.5 SERS spectrogram of silver sol for MRSA detection by different heating time
2.2.2 银溶胶与菌液体积比优化 银溶胶与MRSA菌液(麦氏浊度0.5)以不同体积比充分混合后进行SERS检测,结果如图6所示,当银溶胶与菌液的体积比为1∶2时增强效果最佳。

图6 银溶胶与MRSA不同体积比时的SERS图谱Fig.6 SERS spectrogram of different volume ratio of silver sol to MRSA
2.2.3 银溶胶与菌液作用时间优化 银溶胶与菌液的体积比 1∶2分别作用2、30、60、120 min后进行SERS检测,结果如图7所示,随着作用时间的延长,增强效果逐渐增强,作用60 min时SERS增强效果明显最佳,而到120 min时,增强效果明显减弱,这与文献报道[15]的死细菌难以被SERS检测到的结论一致。因此确定银溶胶与MRSA最佳作用时间为1 h。
2.3 大肠埃希菌与金黄色葡萄球菌的SERS检测
银溶胶与4种菌液分别在最佳测试条件下进行SERS检测,结果如图8、9所示。结果表明同属于大肠埃希菌的JM109与DH5α的SERS图谱峰位几乎一样,仅是峰强稍有不同,同属金黄色葡萄球菌的ATCC25923和MRSA也存在类似的情况。
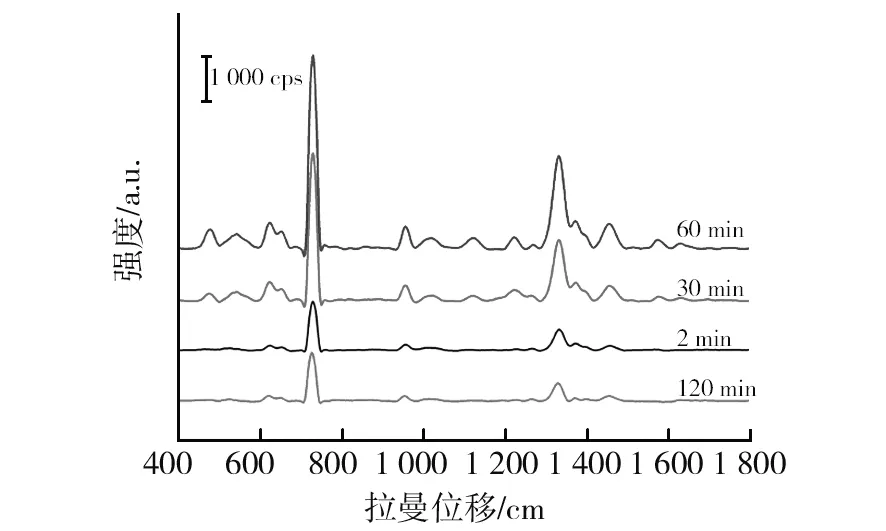
图7 银溶胶与MRSA不同作用时间的SERS图谱

图8 银溶胶检测2种不同类型的 金黄色葡萄球菌的SERS图谱
2.4 MRSA、MSSA、JM109、DH5α特征峰的归属
经查阅文献对4种细菌的拉曼谱峰进行简单归属,金黄色葡萄球菌SERS光谱中位于728/cm附近的拉曼峰源自于腺嘌呤的振动,位于954/cm附近的拉曼峰则归属于缩氨酸基团C=C的伸缩动。1 333/cm附近的拉曼峰源自于蛋白质的CH变形振动,1 454/cm附近的拉曼峰则是蛋白质的CH2变形振动引起的。大肠埃希菌SERS光谱中位于652/cm附近的拉曼峰源自于酪氨酸、鸟嘌呤的振动。位于1 459/cm附近的拉曼峰则是蛋白质的CH2变形振动引起的。
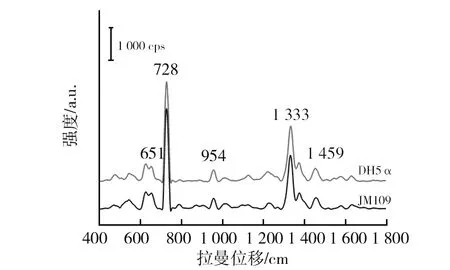
图9 银溶胶检测2种不同类型的大肠埃希菌的SERS图谱Fig.9 SERS spectrogram of two different types ofEscherichia colidetected by silver sol

表1 大肠埃希菌与金黄色葡萄球菌拉曼特征峰归属Table 1 Raman characteristic peaks ofEscherichia coliandStaphylococcus aureus
2.5 细菌拉曼光谱统计分析
2.5.1 基于判别模型的细菌检测 将30例大肠埃希菌JM109、30例DH5α SERS光谱数据经过预处理后通过主成分分析得到了主成分1(PC1)和主成分2(PC2)的得分二维散点分布图(图10),图中PC1和PC2的贡献率分别为27.65%和8.20%,然后通过线性判别法对PC1和PC2进行分析,画出图中判别线,经计算得出此模型分类正确率达到93.33%。结果表明,此模型可以很好地对不同种类的大肠埃希菌进行分类。而30例耐药菌MRSA和30例普通金黄色葡萄球菌ATCC25923的光谱数据经预处理后,通过主成分分析得到的主成分1(PC1)和主成分2(PC2)的得分二维散点分布图如图11,其主成分贡献率分别为37.17%和8.45%。通过相同的分析方法得到该模型用于2种金黄色葡萄球菌的鉴别时其正确率仅为76.67%。
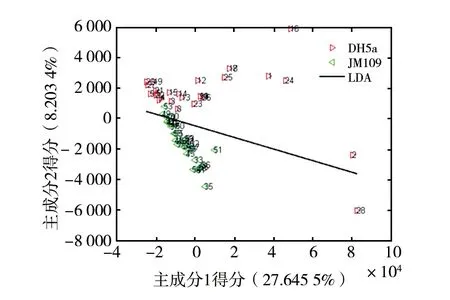
图10 2种大肠埃希菌(JM109和DH5α)的PC1和PC2的得分分布及LDAFig.10 The score distribution and LDA of PC1 and PC2 of two kinds ofE.coli

图11 2种金黄色葡萄球菌(ATCC25923和MRSA)的PC1和PC2的得分分布及LDAFig.11 The score distribution and LDA of PC1 and PC2 of twoS.aureus
2.5.2 模型验证 为了验证参考的拉曼光谱判别模型的正确性,对该模型进行了盲样测试和分析。选取未参与建模的4种菌液样本各6例的拉曼光谱进行预测,分别计算出12个样本主成分PC1和主成分PC2的得分,然后在图10、图11的基础上分别画出对应的主成分PC1和主成分PC2的得分散点图(图12、图13),并预测未知样本的类别。结果表明12例大肠埃希菌样本中,存在1例误判,正确率为91.67%(图12)。而12例金黄色葡萄球菌样本中误判个数为3例,正确率为75%(图13)。由此可见基于判别模型可以较好地鉴别出不同种类的大肠埃希菌,然而对耐药金黄色葡萄球菌和普通金黄色葡萄球菌的区分效果有待进一步研究。由于MRSA与普通金黄色葡萄球菌的区别主要在于MRSA染色体内存mecA基因,能够编码与β-内酰胺类抗生素亲和力很弱的青霉素结合蛋白PBP2a,而拉曼光谱反应的分子振动的信息,2种金黄色葡萄球菌在结构上的差异微弱,由银溶胶增强的SERS信号谱图差异太小,以至使用参考的判别模型得出的鉴别正确率较低。

图12 12例大肠埃希菌样本的盲样测试图Fig.12 A unknown sample map of 12 cases ofE.coli
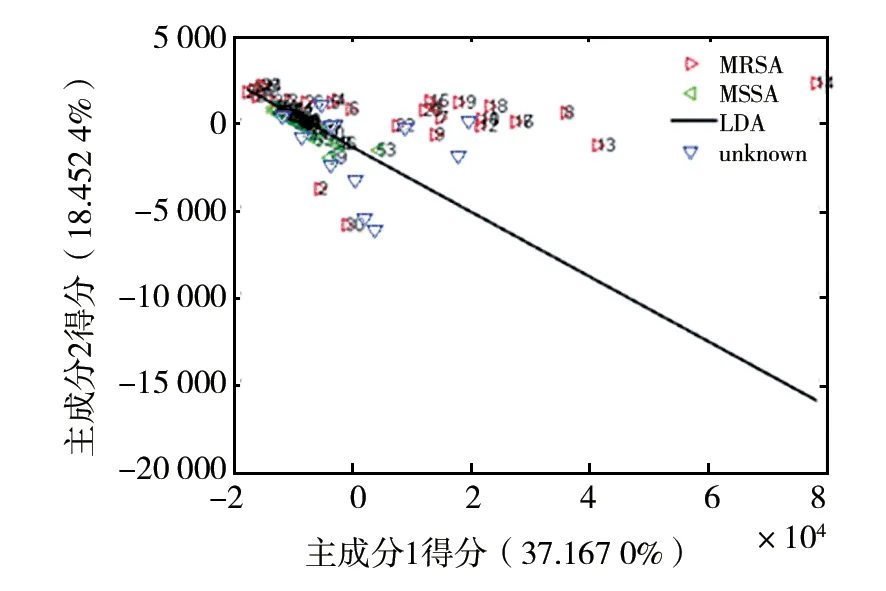
图13 12例金黄色葡萄球菌样本的盲样测试图Fig.13 A unknown sample map of 12S.aureussamples
3 讨 论
本研究采用传统的柠檬酸三钠还原硝酸银,在微波加热的条件下制备得到了银溶胶,用于增强4种细菌的拉曼信号。该制备方法简单、制得的银溶胶有较强的SERS增强效果,借此分别测得了大肠埃希菌JM109、DH5α和2种金黄色葡萄球菌ATCC25923、MRSA的拉曼光谱信号,将光谱分析法与数理统计方法有机结合,参考PCA-LDA模型,对JM109、DH5α和ATCC25923、MRSA进行两两鉴别,模型正确率分别为93.33%和 76.67%,盲测测试正确率分别为91.67%、75%。结果表明,利用拉曼光谱分析法结合数理统计的方法可以较好地鉴别与区分结构差异较大的细菌样本,而对结构组成上比较相似的细菌,如普通菌和耐药菌的鉴别效果较差。这可能由于使用银溶胶采集得到的SERS谱峰差异较小,也可以对判别模型做进一步的优化以提高鉴别正确率。此结果对临床上细菌的快速准确鉴别与分类具有重要的指导意义。
