转IE2基因荷瘤小鼠中ATF5功能影响的研究
2019-05-16钱冬萌
于 淼, 刘 婷, 胡 明, 王 斌, 钱冬萌*
(1.青岛大学 生命科学学院,山东 青岛 266071;2.青岛大学基础医学院 病原生物学系,山东 青岛 266071)
人巨细胞病毒(human cytomegalovirus,HCMV)[1]属于疱疹病毒家族,在人群中引起广泛且持续的感染,脑是HCMV感染的优先位点,可导致人的精神障碍或癫痫等功能障碍[2]。HCMV通过影响细胞存活、细胞周期和侵袭潜能来调控肿瘤恶性表型。转IE2基因小鼠[3]的建立是通过DNA原核显微注射方法,转入的目的基因仅仅是整合在二倍体动物的其中一条染色体上,所以是半合子,它的后代只有一部分个体带有整合的基因,有的没有目的基因。所以,转基因小鼠需要一个相当长的筛选和纯化过程,以期获得纯合子的转基因小鼠。HCMV感染后第一个病毒基因是即刻早期基因,基因中表达最丰富的产物被称为即刻早期1和2蛋白[4](IE72和IE86)。IE86蛋白是一种强烈的反式激活因子,与基础转录机制的因子相互作用。参与病毒和细胞启动子反式激活的IE86蛋白在病毒调节蛋白中是独特的,因为它可以同时负向和正向调节病毒和细胞启动子[5]。越来越多的证据证明,转录激活因子5(activating transcription factor5,ATF5)[6]是一个与凋亡密切相关的因子。研究表明,在鼠胶质瘤模型中干扰抑制ATF5的功能会引起胶质瘤细胞的特异性凋亡,而对胶质瘤细胞周围的正常细胞不具有这种凋亡作用。在许多肿瘤组织中也发现有ATF5的高表达,例如在乳腺癌细胞中干扰抑制ATF5的表达也能引起细胞的凋亡[7]。ATF5是一个与凋亡密切相关的转录因子,在凋亡、分化及发育等生理过程中发挥着重要作用。
1 材料与方法
1.1 材料
1.1.1 小鼠与细胞 国际标准化ICR(Institute of Cancer Research)C57BL/6小鼠30只,雌性,体重18~20 g,6~8周龄;GL261小鼠胶质瘤细胞系购自上海细胞库。
1.1.2 试剂与仪器 胎牛血清(FBS,Hyclone),DMEM(Hyclone),基因组DNA提取试剂盒及组织RNA提取试剂盒(康为世纪生物科技有限公司),RNA反转录试剂盒,青霉素及链霉素(Solarbio),Anti-ATF5 antibody(abcom),HRP山羊抗鼠IgG;PCR仪,BIO RAD Real-time PCR仪(My-iQ Optics Module),蛋白凝胶电泳系统(韦伯),离心机,恒温培养箱等。
1.1.3 PCR引物 本研究中使用的PCR引物见表1。
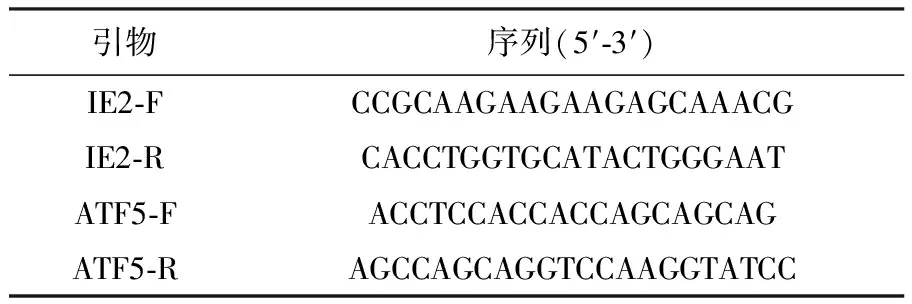
表1 PCR引物
1.2 方法
1.2.1 细胞培养 将GL261鼠胶质瘤细胞在含有青霉素和链霉素的10%胎牛血清的DMEM培养液中培养,置于37 ℃、5% CO2培养箱,每3 d传代1次,取对数生长期的细胞进行下一步实验。
1.2.2 鼠尾鉴定 剪取长度为0.4~0.6 cm的小鼠鼠尾,分装于1.5 mL高压灭菌的离心管内,加入100 μL蛋白酶k于70 ℃水浴裂解过夜,用DNA提取试剂盒提取鼠尾DNA,以此DNA作为模板,在IE2引物、酶等条件下用PCR方法进行DNA扩增,产物进行琼脂糖电泳检测目的条带,观察最后显影结果,最终确定小鼠的阴性或阳性,以备后续实验。
1.2.3 小鼠荷瘤 当细胞长成至培养瓶90%融合时传代,用含有EDTA的胰酶消化细胞,消化成细胞数为1×107/mL悬浮细胞2 mL;用1 mL的注射器分别给予3个实验组的小鼠右侧腋下注射0.2 mL,对照组小鼠相同位置注射相同剂量的悬浮细胞。记录每日观察并称量小鼠皮下肿瘤的生长情况。
1.2.4 肿瘤组织DNA的提取 荷瘤后短时间内荷瘤小鼠的体重呈现直线生长的状态,但是这个过程并不是持续的,待小鼠体重稳定不再增长,并呈现减重现象时,对小鼠进行脱颈处死并解剖,并对肿瘤进行剥离,用电子天平分别称取20~30 mg置于1.5 mL高压灭菌的离心管内,用灭菌的研磨杵研磨充分,用RNA提取试剂盒进行肿瘤组织的RNA提取,并以提取的RNA为模板,用反转录试剂盒反转录成cDNA置于-20 ℃备用。
1.2.5 荧光定量PCR(qPCR) Real-time PCR采用β-actin作为内参基因,内参基因与目的基因各设3个平行反应管。反应体系为20 μL,其中10 μL SYBR green mixture,上下游引物各1 μL,cDNA 2 μL,加水至20 μL,95 ℃ 10 s,55 ℃ 30 s,循环40次。60 ℃、30 s时读出荧光值。
1.2.6 肿瘤组织蛋白的提取 将肿瘤组织用电子天平分别称取20~30 mg于1.5 mL高压灭菌的离心管内,用灭菌的研磨杵研磨充分,加入裂解液(RIPA∶PMSF=500∶1)501 μL,最后在冰上裂解30 min,4 ℃ 13 000 r/min离心10 min,收集上清即为总蛋白。
1.2.7 蛋白免疫印迹(Western blot) 提取的蛋白按照1∶4的比例加入5×SDS loading buffer,煮沸5 min,经SDS-PAGE凝胶电泳,电泳结束后,用300 mA恒电流将蛋白从胶上转移到PVDF膜上,用TBST配制的5%脱脂奶粉封闭2 h,一抗(1∶2 000稀释)4 ℃孵育过夜,二抗(1∶2 000稀释)孵育2 h,TBST清洗3次,每次10 min,加入ECL显色液(A液∶B液=1∶1)黑暗保存5 min后显影检测目的蛋白的表达。
2 结果与分析
2.1 GL261小鼠胶质瘤的细胞状态
复苏GL261小鼠胶质瘤细胞,显微镜下观察细胞会具有明显的星形触角伸出,贴壁生长24 h,生长状态如图1所示。继续生长72 h至铺满培养瓶整个底部,待细胞数达到要求(一般荷瘤细胞数在106~108个/mL),生长状态如图1d所示,胰酶消化细胞并用计数板计数,重悬细胞备用,用于后期对小鼠进行荷瘤。
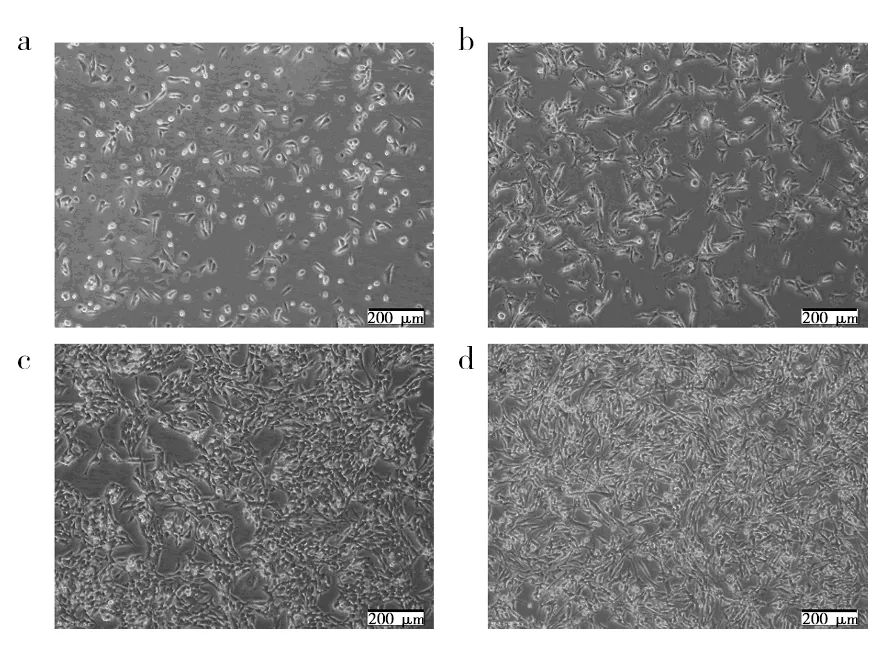
图1 GL261小鼠胶质瘤细胞生长状态Fig.1 GL261 mouse glioma cell growth statusa~d:12、24、48、72 h后细胞的生长状态a-d: Growth status of cells after 12, 24, 48, 72 h
2.2 PCR定性鉴定IE2与ATF5
对实验的30只标准化小鼠进行鼠尾鉴定,将鉴定后的阴性小鼠和阳性小鼠分组以便进行后续实验,图2显示了5对阴性小鼠和阳性小鼠中ATF5的表达,通过电泳条带可观察出显著差异。
2.3 小鼠荷瘤后肿瘤状态
荷瘤后短时间内荷瘤小鼠体重呈直线生长的状态,对阴、阳性小鼠肿瘤组织体内外形态进行对比,结果如图3所示。图3A为GL261胶质瘤在小鼠体内生长时小鼠的体表形态。选取5只阴性对照组和5只阳性实验组(共10只)荷瘤鼠,待小鼠体重稳定不再增长,并呈现减重现象时,对小鼠进行脱颈处死并解剖,对肿瘤进行剥离,图3B为肿瘤剥离后的形态比较,可以观察出明显的状态区别。阳性荷瘤小鼠较阴性荷瘤小鼠,肿瘤大小不论在小鼠体内还是在体外剥离后,与对照组相比,均呈现显著性差异,具有统计学意义(P<0.000 1),阳性荷瘤小鼠的肿瘤大小整体水平较阴性荷瘤小鼠的肿瘤大。
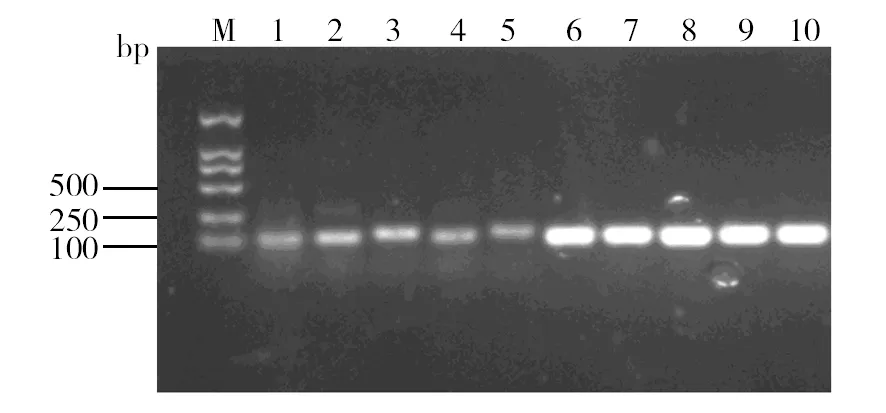
图2 ATF5转录因子的PCR鉴定Fig.2 PCR identification of ATF5 transcription factorM:DNA分子量标准品,分子量大小为2 000 bp;1~10:不同PCR反应管编号;1~5:阴性小鼠中ATF5的表达;6~10:阳性小鼠中ATF5的表达M: DNA marker, the molecular weight is 2 000 bp; 1-10: different PCR reaction tube numbers; 1-5: expression of ATF5 in negative mice;6-10: Expression of ATF5 in positive mice
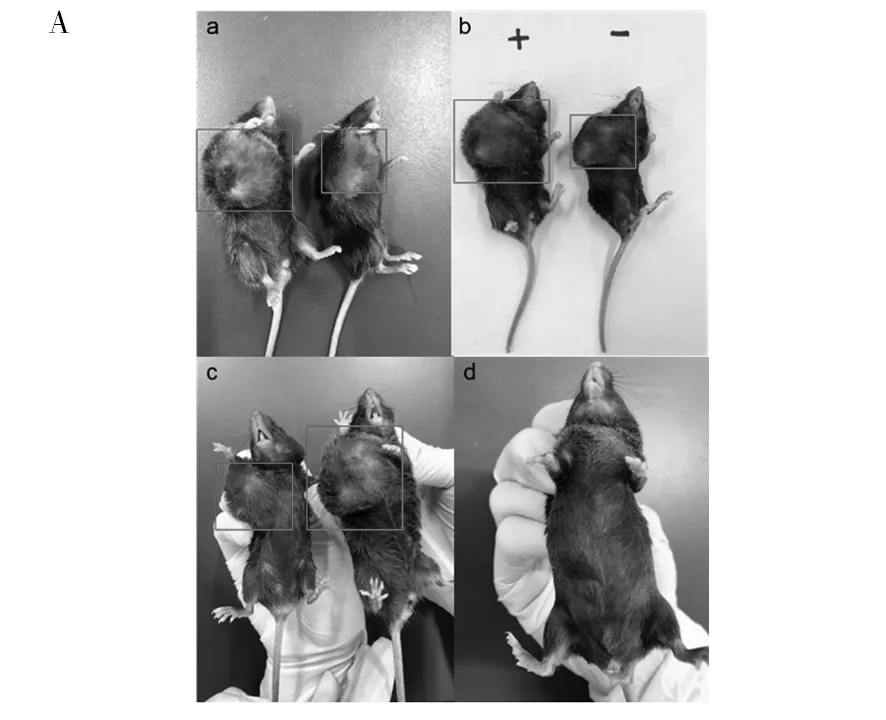

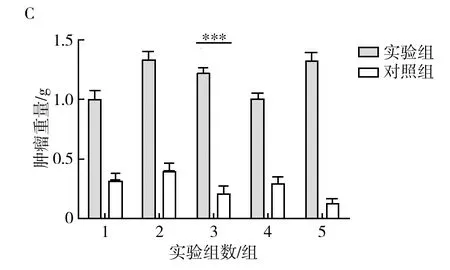
图3 肿瘤在小鼠体内及体外的形态Fig.3 Tumorin vivoandin vitromorphology in miceA:a~c为阴性、阳性小鼠荷瘤对照比较,d为野生小鼠对照比较;B:阴性、阳性小鼠肿瘤组织体外形态比较;C:荷瘤阴阳性小鼠体重变化;+:阳性小鼠,-:阴性小鼠; ***P<0.000 1A: a-c plots are comparisons of negative-positive mouse-bearing controls, d is comparisons of wild-mouse controls; B: comparisons of tumor-in vitro morphology of negative-positive mice;C: Changes in body weight of tumor-bearing positive mice;+: positive mice,-:negative mice;***P<0.000 1
2.4 qPCR法定量检测ATF5表达水平
选取鼠尾鉴定后的阳性鼠进行后续实验,用荧光实时定量PCR方法定量检测5组阳性小鼠(共10只)中ATF5的表达量,见图4。结果显示IE2表达与ATF5存在明显的定量关系,呈显著性差异,具有统计学意义(P<0.05),为了验证它们之间的关系,进行了后续的Western blot实验。

图4 qPCR法检测IE2与ATF5的表达量Fig.4 qPCR assay for expression of IE2 and ATF51~5:阳性荷瘤小鼠的实验组编号,*P<0.051-5: Experimental group number of positive tumor-bearing mice, *P<0.05
2.5 蛋白免疫印迹(Western blot)法定量检测ATF5表达水平
对选取的5只阴性对照组和5只阳性实验组(共10只)荷瘤鼠,肿瘤组织蛋白提取继而进行蛋白免疫印迹法检测ATF5表达量, Western blot方法从蛋白水平检测了ATF5与IE86蛋白之间的定量关系,实验组为阳性荷瘤小鼠ATF5表达的平均值,对照组为阴性荷瘤小鼠ATF5表达的平均值,如图5所示,与对照组相比,呈显著性差异,具有统计学意义(P<0.05)。结果显示,阳性荷瘤鼠中ATF5呈现高表达状态,说明在转IE2基因小鼠中,ATF5转录因子起到重要的调节作用。
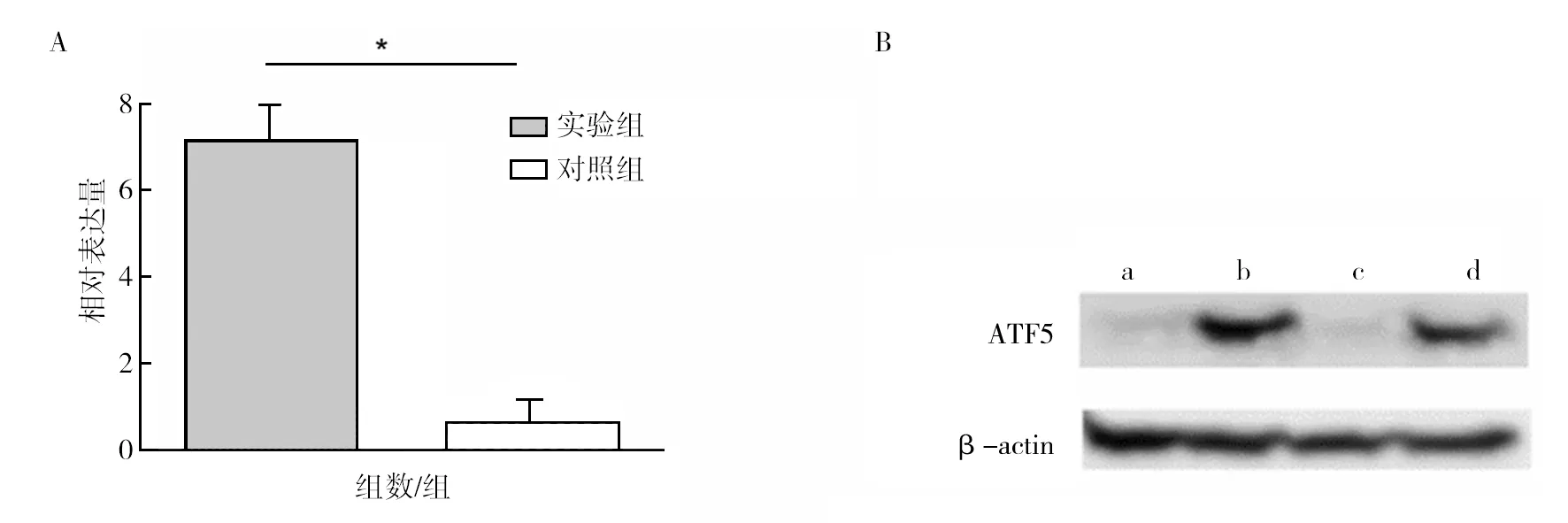
图5 Western blot检测ATF5的表达量Fig.5 Western blot detection of ATF5 expressionA:Western blot方法从蛋白水平检测了ATF5与IE2之间的定量关系;B:a、c为阴性鼠中ATF5的表达量,b、d为阳性鼠中ATF5的表达量;*P<0.05A: The quantitative relationship between ATF5 and IE2 was detected from the protein level by Western blot; B: a, c is the expression level of ATF5 in negativity mice, b, d is the expression level of ATF5 in positive mice; *P<0.05
3 讨 论
人巨细胞病毒属于β疱疹病毒亚科,是人类疱疹病毒中最大的一组病毒[8-9],感染率可高达100%。HCMV基因组是全长超过240 kb的双链DNA,整个基因组含有250个开放阅读框(ORF)。在病毒感染过程中, HCMV基因的表达表现一定的时序性,可分为早早期(IE)、早期(E)和晚期(L)基因[10-12]。病毒穿入细胞后, IE基因被宿主细胞因子激活并最早表达,编码两种重要的调控蛋白 IE1(IE72)和 IE2(IE86)。其中 IE2(IE86)蛋白是一种重要的反式激活因子并在HCMV感染中发挥了重要作用[13]。近年有资料证实,IE2(IE86)调节许多与控制细胞周期相关的因子。
本研究应用到的转IE2基因[14]小鼠,是通过DNA原核显微注射方法,转入的目的基因仅仅只是整合在二倍体动物的其中一条染色体上,所以是半合子,它的后代只有一部分个体带有整合的基因,有的没有目的基因,所以,转基因小鼠需要一个相当长的筛选和纯化过程,以期获得纯合子的转基因小鼠。 ATF5最初是从人T淋巴细胞中分离出来[15],并在肿瘤发展中起重要作用。ATF5是具有碱性亮氨酸拉链(bZIP)结构域的ATF/CREB家族的成员。ATF5转录因子参与DNA结合和蛋白质-蛋白质相互作用,并具有抗凋亡的作用[16]。研究发现ATF5的抗凋亡功能是具有选择性的,在对DNA损伤试剂诱导的凋亡过程中就没有抗凋亡的功能。ATF5是一个与凋亡密切相关的转录因子,在凋亡、分化及发育等生理过程中发挥着重要作用[17]。
本研究以转基因小鼠为切入点,将胶质瘤细胞在小鼠皮下建立移植瘤模型,着重在分子水平研究IE86和ATF5[18-20]之间表达和分布的关系,结果显示,ATF5在转IE2基因小鼠中呈现高表达状态,并与之存在显著的定量关系。本研究结果为治疗病毒感染以及拓展肿瘤治疗与预防提供了参考。
