基于化学史和思维转换的质量守恒定律教学设计
2019-05-14贾萍萍吴明书
贾萍萍 吴明书
摘要:将化学史融入课堂是一个有效拓宽学生视野并提高学生的科学素养的方法。以质量守恒定律的教学为例,以质量守恒定律发现过程设计了教学过程,通过启发提问一探究讨论一实验验证等活动,让学生站在科学家的角度思考问题,揭示科学家探究过程的思维和方法,经历从定性思维到定量思维的转变,提高学生的科学素养。
关键词:质量守恒定律;教学设计;化学史;定量研究
文章编号:1008-0546(2019)04-0068-03
中图分类号:G633.8
文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.04.019
将化学史融人课堂是一个有效拓宽学生视野并提高学生的科学素养的方法。化学史反映了化学原理发展的过程,能够帮助学生充分理解化学知识。但很多教师在教学过程中只注重实验探究,或只是将化学史以片段的形式插入。在进行相关的化学史教学时,教师大多只介绍定律的发现者、发现时间、发现的简单过程和拉瓦锡的贡献[1]。学生对这段历史没有清晰的认识,依据教材孤立地认为是拉瓦锡一個人建立了质量守恒定律,且这个定律没有什么价值等片面的印象。质量守恒定律的发现过程体现着科学家从定性思维到定量思维的转变,而在实际教学中,很多教师只是将质量守恒定律作为一个理论知识传授给学生,忽略了它对学生定量的化学观的形成的积极影响。
一、教学设计
本节课采用历史线-探究线相结合的教学方式进行教学,以质量守恒定律的发现史为主线创设教学情景,对每段化学史实提出问题,让学生换位思考,交流讨论,开展质量守恒定律的学习和探究,学会用定量的方法初识化学变化的本质。
二、教学思路
波义耳的金属铜煅烧实验——对金属增重产生疑问——激发学生探究热情——施塔尔的燃素学说
解释金属增重原因一一与学生已有知识产生冲突——对波义耳的金属铜煅烧实验再次质疑——设计金属煅烧的反应体系——罗蒙诺索夫的金属铜煅烧实验——设计并验证实验——拉瓦锡的氧化汞实验——播放氧化钴分解实验动画——微观解释质量守恒定律——质量守恒定律的应用。
三、教学目标
1.知识与技能
(1)认识质量守恒定律。
(2)能用微观的观点解释质量守恒定律。(3)能用质量守恒定律解决一些相关问题。
2.过程与方法
(1)初步了解科学家建立质量定律的过程和方法。(2)初步学习结合化学史学习化学的思维。
3.情感态度和价值观
(1)重温科学家建立质量守恒的过程,体会探究过程的曲折和成功的喜悦。
(2)通过实验探究,发展定性到定量的科学观。
四、教学过程
[引入]化学反应必然引起物质的改变,那么反应物和反应后的产物之间有什么关系呢?化学家在很久之前便关注并研究了这个问题。接下来就让我们回到科学家所处的时代,去探寻质量守恒定律的发展足迹。时空之旅第一站:燃素学说的缘起
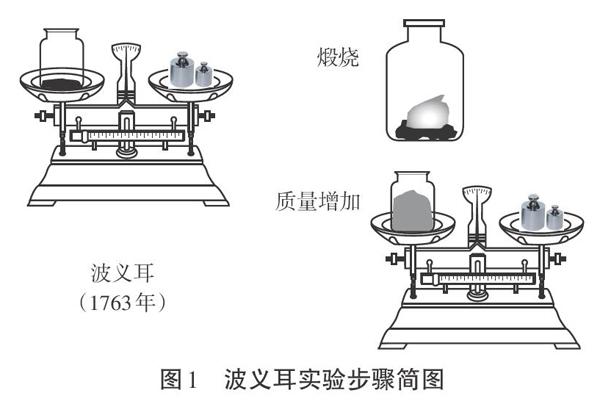
[波义耳]我叫波义耳,我非常喜欢做实验,有一次我做了这样一个实验:我将称重后的铜片放入密闭瓶中,将其煅烧。发现铜片逐渐由紫红色变为暗灰色,最后变成了黑色。烧完后,打开密闭瓶,称量金属,发现变重了。我感到非常奇怪,又用铅、锡等其它金属做实验,发现燃烧后都变重了。金属燃烧后质量增加是什么原因引起的呢?
[投影](见图1)
[提出问题]假如你是波义耳,试想一下,在那个氧气还没有被发现的年代,怎么解释这个现象呢?
[学生讨论]是有东西和金属结合了,导致金属增加了。
[设计意图]创设情境,使自己成为“小波义耳”,学会换位思考,只有将自己置身于情境中,学生的思维才能被充分地激活,科学素养才能得到提高。
[波义耳]我认为应该有一种“热素”,可以从一个物体注入另一个物体,燃烧时与金属结合,导致金属灰质量增加。
时空之旅第二站:燃素学说的发展,
[施塔尔]我认为燃烧时燃素飞散,反应物总质量减少,说明燃素具有正质量,但是反应物在反应过程中不会凭空消失,金属燃烧后质量增加,是燃素具有负质量造成的。
[提出问题]同学们,你们认为这个解释合理吗?为什么?
[学生讨论,]不合理,质量怎么可能有负值呢,一切物体都是有质量的。
[设计意图]创设矛盾情境,通过对施塔尔解释的提问,与学生的已有知识(物体是有质量的)产生冲突,使学生对燃素学说产生质疑,让学生意识到定性认识是片面的,引导学生通过科学的方法来探索原理。
[提出问题]好,同学们,既然认为施塔尔的解释不合理,那我们再次回到波义耳的实验中,仔细分析一下实验过程,有没有不足的地方呢?
[学生讨论]他只称量了金属灰的重量,没有称量其它的质量,而且玻璃瓶一直打开,反应体系一直和空气接触,可能会对实验有影响。
[提出问题]那我们该怎么改进这个实验呢?
[学生讨论]在反应过程中需要保持反应装置密闭,可以将金属和容器一起称重。
[设计意图]通过对波义耳实验装置的分析,引导学生按照科学家的思路进行思考,探索波义耳实验的不足,找出波义耳解释的不合理之处,并在此基础上提出改进方案,有助于帮助学生从定性思维逐渐上升到定量思维。
时空之旅第三站:质量守恒定律的雏形
[罗蒙诺索夫]我非常反对燃素学说对金属增重现象的解释,我认真研究了波义耳实验的做法,产生了一些疑问:波义耳在做实验前,为什么不称量一下密闭瓶的质量呢?加热后打开密闭瓶,有没有什么东西从容器里“跑出”并改变它的重量?我决定重新做这个实验。
我用天平称量一些锡粉,质量为m1;然后将其放入密闭容器中充分燃烧,反应结束后,不打开容器,直接称量容器,所得质量为m2;称完后,打开容器,取出生成的白色物质,称量,记为m3;再将白色物质放回原来的容器中,再次称量容器的质量,记为m4。
我分析数据后发现,得到一个等式m3=m4-m2+m1。我又拿铁,铜多次重复这个实验,等式仍然成立。这意味着没有热素进入容器,否则容器的质量应该增加。我根据这个现象,提出了“参与反应的物质的总质量,等于反应后产物的总质量”的观点。
[提出问题请同学们分析一下m3;=m4-m2+m1的含义,为什么罗蒙诺索夫能发现这个规律呢?
[学生讨论]m4-m2为参加反应的气体的质量,m1为金属锡粉的质量,m4-m2+m1,为参加反应物总质量,m3为反应后产物的总质量。
[设计意图]引导学生分析等式的含义,验证罗蒙诺索夫的观点,使学生的思维与科学家的思维巧妙同步,学会用定量的思维解释化学理论。
[提出问题]这个是巧合吗?那没有气体参与的反应是不是也遵循罗蒙诺索夫的观点呢?
[学生实验]铁与硫酸铜的实验。
[设计意图]通过了解罗蒙诺索夫的实验原理,学生在教师的指导下,设计并完成铁和硫酸铜溶液的实验,让学生用定量的方法验证罗蒙诺索夫观点的正确性。
根据我们刚才做的实验,也说明了罗蒙诺索夫的观点是正确的。但在罗蒙诺索夫的时代,由于缺乏严格的实验证据,这项重大的发现没有得到人们应有的重视。
时空之旅第四站:质量守恒定律的建立
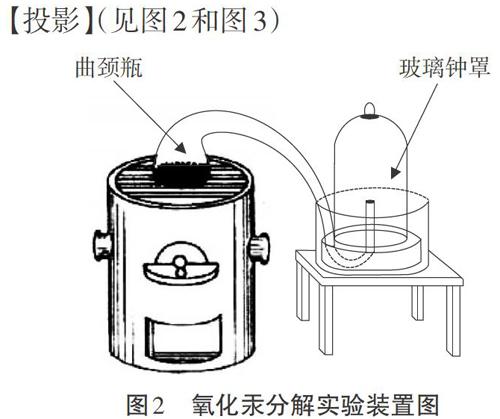
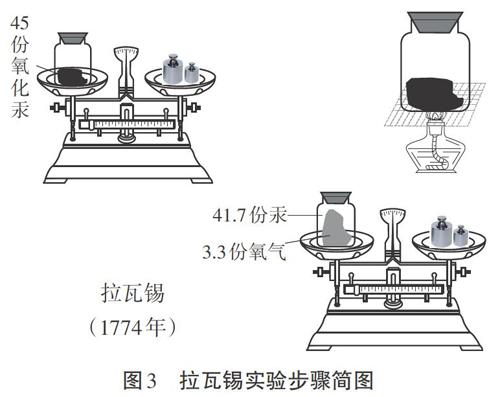
[拉瓦锡]我看了波义耳和罗蒙诺索夫的实验,两个结论不一样,到底真相是什么呢?于是我研究了氧化汞的分解和合成反应过程。我将45.0份质量的氧化汞在密闭容器中进行加热后,恰好得到了41.5份质量的汞和3.5份质量的氧气[3]。我又做了其他物质的燃烧比如碳燃烧,磷燃烧等,归纳出了一个规律,在化学反应中,反应前后的总物质保持不变,而且物质的质量也保持不变。
[投影](见图2和图3)
[提出问题]拉瓦锡的实验与之前两位的实验相比,有什么优点?
[学生讨论]实验更加精确了,他还分析了生成物。
[讲述]拉瓦锡不只是定性地观察实验对象,而且用定量的实验为研究提供实验证据,他用精密的实验仪器测量反应前后各个物质的变化。此后,定量研究成为科学家解决问题的基本方法。正是依据科学的实验方法,拉瓦锡推翻了错误的燃素学说,让质量守恒定律为众人所知,而他本人也被称为近代化学之父。
(设计意图]通过将拉瓦锡实验与前面的实验进行比较,分析出拉瓦锡实验的先进性,让同学们初步形成从定性思维到定量思维转变的思想,同时让学生了解质量守恒定律是化學发展史上的里程碑。
[提出问题]为什么参与化学反应的物质的总质量等于反应后产物的总质量呢?我们看一下氧化汞分解实验的情况吧。
[课件演示]氧化汞分解实验的微观动画。
[提出问题]在这个微观实验中,化学反应前后,元素种类发生变化了吗?原子个数、原子种类、原子质量发生变化了吗?分子、物质种类发生变化了吗?
[学生讨论]不变:元素种类,原子个数,原子种.类,原子质量。变:分子种类,物质种类。
[设计意图]学生在宏观上对质量守恒定律有了较好的认知,通过氧化汞分解的动画,从微观上描述并分析质量守恒定律,使学生对质量守恒定律有更深层次的理解。
[学以致用]古人有“点石成金”的说法,请问这个说法对吗?
[学生讨论]不对,石头的主要成分是碳酸钙,只有钙、碳、氧元素,不含金元素,根据质量守恒定律,碳酸钙反应不会有金元素产生,所以这句话是错的。
[课堂小结]通过这节课的学习,你对化学反应有什么新的认识吗?
[作业]如果你能回到过去和某位科学家进行交谈,你会说些什么呢?
[设计意图]回顾质量守恒定律建立的历史,了解.化学家对化学发展作出重大贡献的曲折过程,培养学生勇于探索的精神。
五、结语
本节课按照新课标,将化学史融入课堂,以质量守恒定律的发现史作为主线,通过重现历史一启发提问一探究谈论等活动的开展设计教学过程,突出教学重点,发扬学生的主动性,启迪学生的思维,让学生充分理解质量守恒定律,并挖掘化学史背后蕴含的科学价值,使学生从定性思维转到定量思维,在处理化学实验问题中形成“密闭体系”的意识,作出更科学的思考。
参考文献
[1]姜鹏,郑长龙,袁旭富.关于“质量守恒定律”化学史教学的几个问题的讨论[J].化学教育,2008(9):77-78
[2]郭晓丽,王澜,魏锐.“质量守恒定律”的建立过程分析及其对教学的启示[J].化学教育,2017,38(11):78-80
[3]肖芬.质量守恒定律及其应用[J].初中生必读,2003(10):30-31
