超快激光制备生物医用材料表面功能微结构的现状及研究进展
2019-05-13张佳茹管迎春
张佳茹,管迎春,2,3,4*
(1.北京航空航天大学 机械工程与自动化学院,北京 100191;2.北京航空航天大学 大型金属构件增材制造国家工程实验室,北京 100191;3.北京航空航天大学 国际交叉研究院,北京 100191;4.北京航空航天大学 合肥创新研究院,合肥 230013)
1 引 言
生物材料(biomaterials)是指用于与生命系统接触且发生相互作用的,能对器官、组织和细胞进行替换修复、诊断治疗或诱导再生的一类人工合成或天然的特殊功能性材料,又称生物医用材料[1]。近年来已被广泛应用于临床诊断、修复、治疗、或替代人体组织器官等[2]。随着医疗水平的发展,对医学材料及新的医疗设备提出了更高的要求,可植入人体的生物材料在现代医学中的作用越来越重要。然而临床结果显示,几乎所有的植入医疗器械都会在人体中产生不同程度的不良反应,包括纤维变性、炎症、感染、血栓等[3-5]。为了提高医疗植入材料的安全性,生物相容性成为植入生物材料的基本要求。
生物相容性是指医疗植入材料在生物体内的动态变化过程中,能耐受宿主各系统的作用而保持相对稳定状态、不被排斥或破坏的生物学特性,包括血液相容性和组织相容性[6]。人体组织对植入物进行的生物学反应,通常发生在材料与生物体接触的界面,包括细胞表面-细胞外基质、细胞表面-植入材料表面等[7]。细胞是维持生命的基本单元,也是组织修复的基本物质[8]。因此,生物相容性的好坏不仅依赖于材料本身,还和与人体细胞直接接触的材料表面的性能密切相关,包括材料表面的结构、成分、表面形貌、亲疏水性及表面的能量状态等[9]。通过生物、化学和物理等方法改善材料表面的性质,可以在不改变材料本身物理性能的前提下,大幅度提升医疗植入物与生物体的生物相容性。从材料学角度,生物材料表面的微结构决定了材料性能,所以可以通过在材料表面制备微结构影响细胞行为,从而改善植入物的生物相容性[10]。
1912年,Harrison等人[11]最早报道了通过材料表面微结构影响细胞行为。此后,大量研究开始着重于利用表面形貌来引导细胞的生长和发育。微制造技术为细胞行为的研究提供了重要手段,微制造表面的细胞行为在生物医学研究方面发展快速[12]。近年来,超快激光已成功在医用生物材料与器械的表面诱导微纳结构影响细胞行为[13-15],用于提高其生物相容性。已有研究在细胞对不同微纳结构的反应方面取得了显著的进步。本文简单介绍了细胞与生物材料相互作用原理,综述了近年来超快激光加工微纳结构在生物材料领域的研究及其最新进展。
2 生物材料表面与细胞的相互作用
细胞生物学行为包括粘附、迁移、增殖、分化等。细胞的这些行为很大程度上依赖于周围的微环境,包括细胞外基质(ECM)、相邻细胞、可溶性生长因子和细胞因子等,它们均可被视为细胞赖以生存的“材料”[16-18]。通过在生物材料表面制造微纳结构,来模仿细胞生长的自然环境,使细胞在与有机活体相似的环境中生长[19]。
当生物材料和细胞接触时,材料表面首先吸附的是细胞外基质蛋白,如图1所示[20],它们能够积聚到植入材料的表面形成结合牢固的吸附物,用于引导细胞粘附[21]。由图1可知,生物材料通过表面吸附的蛋白,表面沉积的细胞外基质,表面的生物粘附片段,与细胞表面的整联蛋白发生作用,介导细胞在生物材料表面的粘附。细胞在材料表面粘附后,进行爬行的行为,称为细胞迁移[22]。细胞迁移大致包括4步如图2所示。高等动物的伤口愈合、血液凝固、免疫应答、组织发育等多种生命活动都与细胞迁移运动密切相关。细胞在材料表面进行良好粘附后,会通过一系列有序的过程完成繁殖,其中干细胞在繁殖过程中,会受周围环境影响分化为不同类型的细胞。此时,细胞的形状不仅与外观相关,而且与细胞的生存环境和功能活动密切相关。
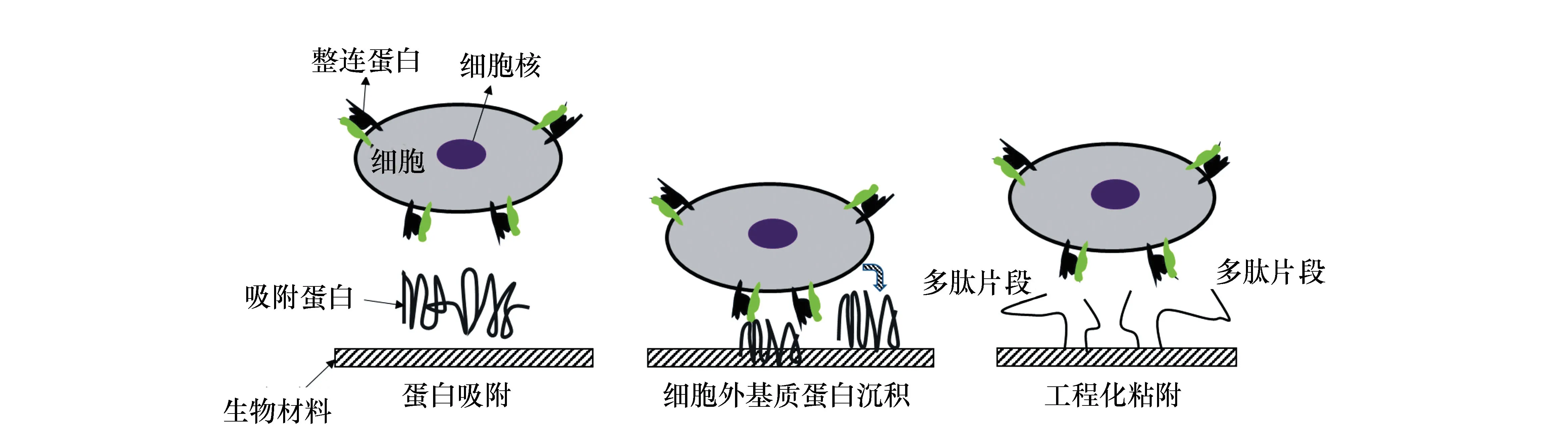
图1 细胞与合成材料粘附的控制机制[23]Fig.1 Mechanisms controlling cell adhesion to synthetic materials[23]

图2 细胞迁移过程示意图Fig.2 Schematic illustration of cell migration
3 激光加工微纳结构对细胞行为的影响
在生物材料表面制造微纳结构,模拟ECM真实形貌来控制细胞生物学行为,是提高材料生物相容性的有效手段。但传统的微纳米加工手段在结构灵活性、加工效率、成品率等方面,都存在较大缺陷,极大地限制了生物材料表面微结构制备技术的发展,表1给出了几种不同典型微纳加工方法制备生物材料的优缺点。近年来,通过超快激光制造出微纳米级别尺寸的材料以改善材料的生物相容性,这种方法已被广泛地应用于生物医学领域。目前利用超快激光已成功在不同生物材料表面加工出如图3所示的多种微纳结构[24-28]。

表1 微细加工生物材料方法对比

图3 超快激光加工的微纳结构Fig.3 Periodic micro/nano structures fabricated by ultrafast laser
3.1 微纳结构对细胞粘附的影响
当生物材料与人体组织直接接触时,首先进行细胞粘附。研究表明,微纳结构表面可以提供一种比平面表面更好的细胞附着点[44-47]。Ranella等人[48]利用波长为800 nm、脉宽为15 fs、频率1 000 kHz的飞秒激光辐照硅片表面,通过改变激光的能量密度,获得了具有不同表面粗糙度的微锥结构,如图4所示。结果表明,在粗糙度比为2.6的情况下,纤维细胞对表面具有最佳的粘附性。不同类型的细胞,其生长特性不同,对最佳粘附粗糙度要求也不同。Alexandre等人[13]利用同样方法在Ti-6Al-4V上加工微结构,并研究了其对人骨髓间充质干细胞的影响。结果显示,抛光面更有利于细胞粘附。以上研究表明,不同细胞在不同材料表面达到最佳粘附时的表面粗糙度不同。

图4 未经处理的硅片以及经过不同能量密度的飞秒激光处理的硅片表面微观形貌图(a)和在与(a)对应表面上,纤维细胞生长72 h之后的荧光显微图像(b)Fig.4 Microstructure topography of untreated Si wafers and wafers treated by femtosecond lasers with different energy densities(a) and fluorescence microscoy images(b) of fiber cells after 72 hours of growth on the corresponding surface (a)
血管支架植入是治疗动脉硬化等血管疾病的有效手段。然而,血管支架植入后,由于血小板过度增殖会出现血栓、再狭窄等并发症[49]。利用超快激光对支架表面进行修饰,控制细胞在支架表面的粘附,可有效避免血管支架植入后并发症的产生。Clare等人[50]采用脉宽为500 fs、频率为100 kHz、波长分别为1 030 nm及515 nm的飞秒激光,在不锈钢表面诱导出周期为360 nm、深度为78 nm、粗糙度为29 nm及周期为730 nm、深度为142 nm粗糙度为48 nm的两种激光诱导周期性表面结构(Laser Induced Periodic Surface Structures,LIPSS),并研究了两种周期结构对成纤维细胞(MS-5)和单核细胞(RAW 264.7)的影响,如图5所示。结果显示,粗糙度为几纳米的平面表面有利于RAW 264.7粘附,而MS-5更倾向粘附在粗糙度约为50 nm的LIPSS结构上。同时发现周期和深度的增加会降低细胞的粘附性。结果还表明,微结构表面不利于血细胞粘附,从而较少产生凝血的机会,提高了血管支架的血液相容性。

图6 (a)SW10细胞培养在:(i)未处理硅表面,(ii)~(v)不同激光能量密度加工表面的细胞荧光图;(b)培养3天后,SW10细胞在不同表面的数量Fig.6 (a)Fluorescence microscopy images of SW10 cells cultured on untreated Si(i), patterned Si substrates fabricated at different laser desities(ii-v). (b)Number of SW10 cells growing on the laser-patterned Si substrates for 3 days of culture(DOC)
材料表面的表面能、微结构类型等也是影响细胞在材料表面粘附的重要因素。Wang等人[51]使用波长为266 nm激光在聚苯乙烯上诱导出周期为250 nm,深度为60 nm的LIPSS结构。经过激光处理后材料的表面能是未处理表面的1.5倍。同时,微结构扩大了材料表面积,增加了蛋白质的吸附,显著增强了细胞的粘附性能。Yiannakou等人[52]使用波长为800 nm、脉宽为150 fs、频率为1 kHz的飞秒激光在硅上诱导出周期为146 nm的纳米波纹结构和周期为140 nm,高度为2~11 nm的分层结构,如图6所示。通过在不同微结构表面培养雪旺式细胞(SW10),发现纳米结构对细胞粘附起到了抑制效果,但分层的微纳结构可显著提升细胞的粘附性能。利用超快激光改变生物材料表面微纳结构进而改善材料表面性能,是一种有效控制细胞粘附性能的方法。
3.2 微纳结构对细胞迁移、定向的影响
大量组织都具有微米或纳米尺度的拓扑结构,如心肌组织和血管呈现为有序排列的纤维状结构,因此细胞的定向生长在医疗植入物功能组织中具有重要意义。细胞在植入物材料表面良好粘附后,可通过精确控制细胞在材料表面的迁移行为,实现类似于生物体组织器官细胞的分布和取向。目前超快激光微纳制造技术已被用于模仿或构建类似于生物体内的细胞外环境,实现对细胞形态和分布的精准调控[53]。

图7 培养48 h后,hMSC细胞在硅表面的细胞迁移,黑色区域为激光加工区域Fig.7 After 48 hours of culture, hMSC cells migration on the Si surface(dark areas are laser processing areas)
通过生物材料表面微观结构控制成骨细胞排列对于实现骨骼各向异性至关重要。Wallat等人[54]利用波长为1 060 nm、脉宽为140 fs、频率为80 MHz的飞秒激光在硅表面加工出周期为100 nm的LIPSS结构。hMSCs培养初期,细胞均匀分布在LIPSS区域和平面区域,48 h后,LIPSS区域的细胞向平面区域迁移,如图7所示。研究表明激光微纳加工可以有效引导骨细胞迁移,有助于实现骨的各向异性。心脏的本质特征是功能的各向异性,这一特征对维持心脏的机械活性、电活性及帮助血液从心脏有效泵出极为重要[55]。热解碳作为人工心脏的优选材料,需要满足功能的各向异性。目前Stępak等人[56]利用波长为1 030 nm、脉宽为450 fs、频率为100 kHz及波长为1 064 nm、脉宽为15 ps、频率为100 kHz的两种超快激光器,在热解碳材料上加工出90~860 nm的LIPSS结构,但能否通过其表面微纳结构控制细胞定向排列,实现心脏功能的各向异性,有待进一步研究。
生物材料表面的拓扑结构特征是诱导细胞产生特定行为的关键因素,为了进一步观察材料表面微纳结构对细胞迁移定向的影响,Rusen等人[57]通过飞秒激光器(波长为775 nm、脉宽为200 fs、频率为2 kHz的)在壳聚糖薄膜上制备了气泡结构,并研究了不同气泡结构尺寸对少突胶质细胞的粘附和定向生长行为的影响,结果如图8所示。可见气泡高度小于200 nm,对细胞行为几乎没有影响,当气泡高度大于3 μm时,细胞早期的生长行为将受到影响。当气泡间距大于40 μm时,细胞行为几乎没有受到影响,当气泡间距在细胞长度范围内(10~30 μm)时,细胞出现沿着气泡方向生长的趋势。但是这种影响只出现在细胞生长初期,细胞培养24 h后,由于细胞的融合,生长趋势不明显。
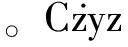
图8 OLN细胞在(a)未处理表面;(b)不同高度气泡结构表面;(c)高度200 nm的汽泡结构表面和(d)高度3 μm汽泡结构表面的细胞迁移。黑色箭头显示了细胞在最初的12 h内具有良好的方向性Fig.8 Optical microscopy images of OLN cells cultured on (a)unstructured control chitosan surface, on (b)bubbles like structures array, and with bubble height of 200 nm(c) and 3μm(d). Black arrows indicate the cell directionality encouraged in its early stages(first 12 h) on CS structures
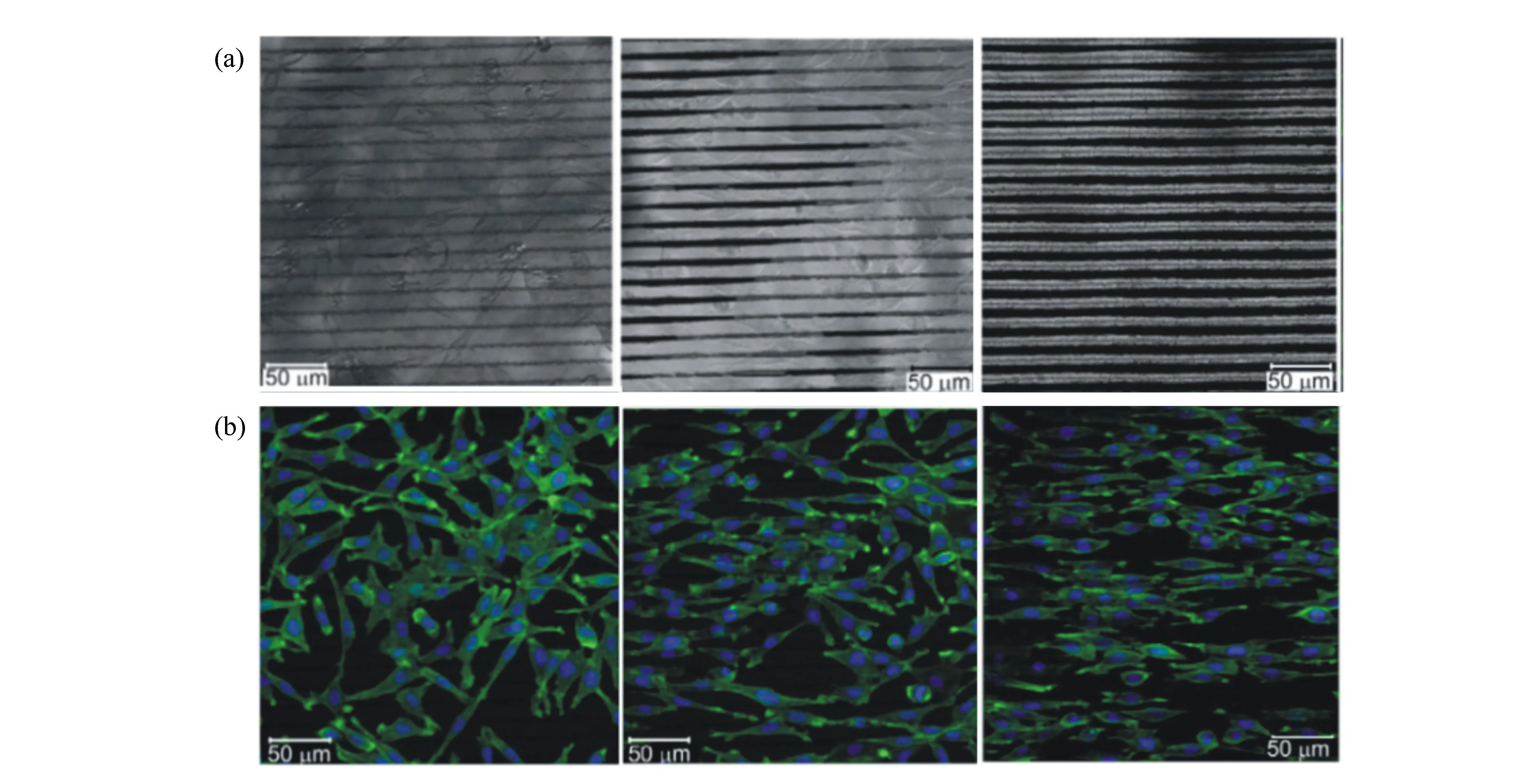
图9 (a)激光(532 nm)在200 nm聚苯乙烯薄膜上制备的周期为25 μm,深度分别为<4 μm、4~6 μm和>7 μm的沟槽结构;(b)平滑肌细胞培养在对应结构上的荧光图Fig.9 (a)Groove structures with period of 25 μm and depth less than 4 μm, during in 4-6 μm, more than 7 μm, prepared by 532 nm laser on 200 nm polystyrene film; (b)fluorescence images of smooth muscle cells cultured on the groove structures
3.3 微纳结构对细胞增殖分化的影响
生物材料的表面形貌影响细胞的增殖。Mutlu 等人[60]使用波长为1 035 nm、脉宽为200 fs、频率为28 MHz的飞秒激光器在Ti-6Al-4V表面加工出宽度10 μm深度为5 μm的沟槽结构,培养人骨肉瘤细胞7天后,飞秒激光织构化的表面细胞增殖率可与经喷砂、酸腐蚀、光固化成型等商业处理的表面相媲美。同时发现,直径为40 μm,深度为15 μm的凹坑状表面,细胞粘附和增殖显著减少,这种现象可能是由于细胞的生物力学导致的。凹坑的体积和细胞尺寸相当,细胞在凹坑中生长,承受凹坑壁对细胞的压力,从而抑制了细胞的增殖。Sabrina等人[61]使用波长为800 nm、脉宽为35 fs、频率为1 kHz的飞秒激光器在硅表面加工出高度为5.9 μm,间距4.8 μm的微锥结构,如图10所示。将其培养成纤维细胞和神经母细胞瘤细胞48 h后。结果显示,微锥结构对两种细胞的增殖都有抑制作用,分析认为,这种微结构没有为细胞生长提供足够的接触面,进而抑制了细胞的增殖。以上结果表明,通过超快激光制造不同的微结构可以有效控制细胞增殖。
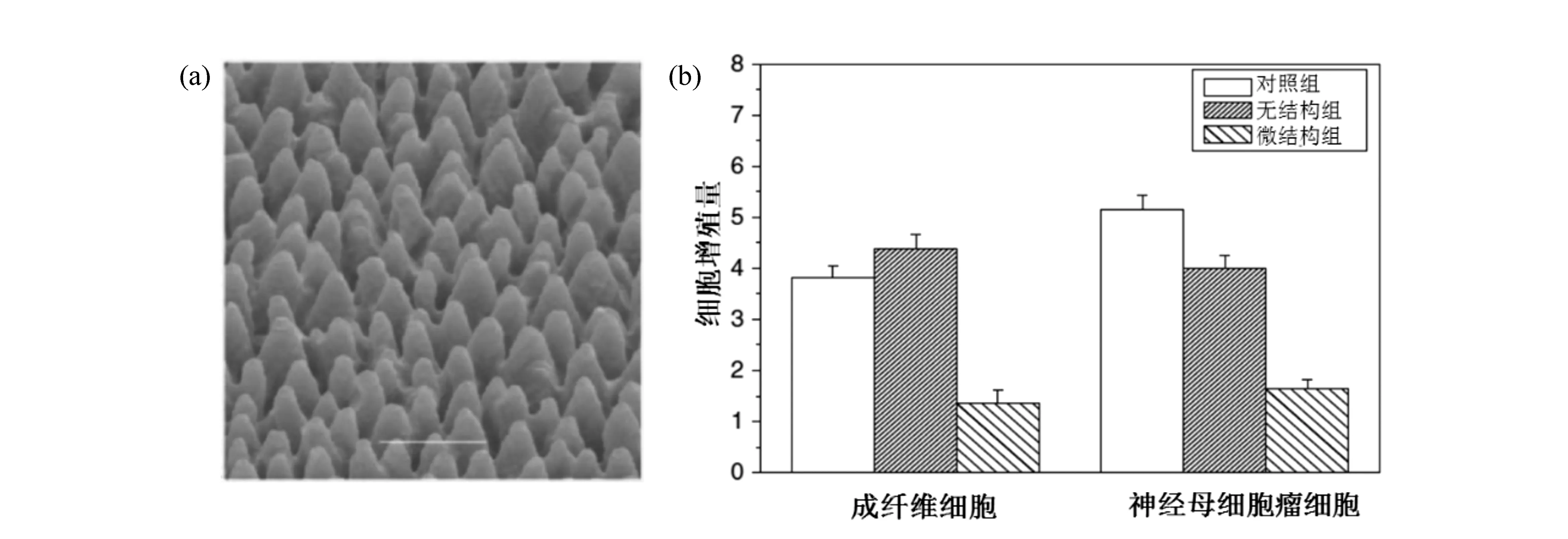
图10 硅表面的微锥结构(a)和细胞培养48 h后的增殖量(b)Fig.10 SEM images of spike structures fabricated on silicon(a) and the amount of profileration after 48 hours of cell culture(b)
细胞分化是指同一来源的细胞逐渐产生出功能特征、形态结构各不相同的细胞类群的过程。BMP-2和BMP-7经常作为骨诱导因子被用于促进干细胞分化成为成骨细胞。但潜在的不良反应及高昂的费用等因素催生了使用新方法促进成骨分化的需求。微纳米结构作为一种信号形式引导细胞骨架重排,具有调控干细胞分化的潜能[62-63]。
Dumas等人[64]采用波长为800 nm、脉宽为120 fs、频率为5 kHz的飞秒激光,在Ti-6Al-4V表面加工出直径为30 μm,深度为800 nm的微坑结构和宽度600 nm,深度为200 nm的LIPSS结构。细胞培养结果显示,两种结构都能够显著提高间充质干细胞(MSCs)向成骨细胞转变的能力,同时抑制向脂肪转化。Alexandre等人[13]利用波长为1 030 nm、脉宽为500 fs的飞秒激光在Ti-6Al-4V上加工出LIPSS结构和微锥结构,如图11所示。细胞在LIPSS及纳米柱阵列表面呈同心状堆叠在一起;在微柱及抛光表面,细胞则无序的堆叠。结果表明,材料表面的微纳结构形貌有助于基质矿化及类骨结节形成,对细胞形状会产生显著影响。因此若能合理控制细胞外环境,尤其是植入体表面特性,对于提高和加速骨整合质量和形成速度至关重要。

图11 细胞培养4周后,(a)细胞在未处理表面、LIPSS、NP和MC-LIPSS细胞荧光图;(b)细胞培养在XO和OI中的荧光图;不同基体的荧光强度:XO(c)和OI(d)Fig.11 (a)Fluorescence images of cell culture after 4 weeks, from left to right are for polished surface, laser-induced periodic surface structures, NP and microcolumn surfaces. (b)Fluorescence images of cells are cultured in XO and OI. Fluorescence intensities of XO(c) and OI(d). XO:Xylenol orange; OI:Osteo image
临床研究也证实材料表面的微纳结构有利于间充质干细胞分化为骨细胞,使植入物表面形成更多的骨生长[65-66],有效改善种植体的骨整合。然而对于血管支架植入,血管内皮细胞或者平滑肌细胞在支架表面分化过快容易造成血管支架再狭窄[67],因此抑制细胞分化同样也是当今生物学研究的重点之一。Martin等人[68]采用脉宽为130 fs、频率为1 kHz的飞秒激光器在不锈钢表面分别制备出了间距分别为75、125和175 μm的点阵结构,如图12所示。肌成纤维细胞分化实验表明,与激光处理过的表面相比,细胞在未处理表面密度最高。结果表面,飞秒激光制造微结构可用于抑制细胞分化。在组织工程应用中,根据需求的细胞分化行为选择合适的微结构至关重要。

图12 (a)培养1天和3天后,肌成纤维细胞在不同基体上的密度;(b)肌成纤维细胞中等密度结构上生长出伪足;(c)肌成纤维细胞在未处理表面有大量伪足;(d)图(c)伪足结束部位的放大图Fig.12 (a)Myofibroblast[45]cell densities on the different substrates when cell cultured after one day and three days. (b)Myofibroblasts without filopodia growing on MD. (c)Myofibroblasts with extensive filopodia on non-treated steel. (d)Extract from (c): Detailed view on flattened regions at the filopodia endings(arrowheads). Non-treated, Low Density, Medium Density(MD) and High Density samples
4 结束语
综上所述,材料表面的微纳结构能够影响细胞的定向、迁移及增殖分化等。同时,生物材料表面的微纳结构可以通过改变细胞表面的应力分布,来影响细胞生长和凋亡。因此,研究生物材料的核心之一是模拟细胞微环境,通过仿生途径设计制造生物材料,用于诱发特定细胞的生物学性能,从而提高医用材料植入物的生物相容性。超快激光表面微纳加工技术作为一种精密和超精密的微纳制造技术,能够模仿或构建类似于生物体内的细胞外环境实现对细胞形态和分布的精准调控[69-70]。
目前通过超快激光加工微结构对细胞行为进行控制还是静态的,大部分研究还限于细胞伪足伸展方向的选择上,不能完全涉及细胞迁移及运动的全过程,下一步可以通过超快激光技术与电化学或光化学方法相结合,通过表面微纳结构与表面化学性质[71]的共同作用,实现微纳结构对动态细胞的迁移和运动行为的实时监测。另一方面,多种细胞的共同培养对研究细胞间的信号传导和相互作用十分重要,普通的基体很难实现几种细胞的可控共培养,而且加工效率还有待进一步提高。超快激光具有简单精确的特点,有望提供一种新型微纳制造途径,实现将微图案应用于多种细胞的共培养。同时,在细胞尺度下,细胞与材料表面拓扑结构的相互作用机理仍未得到完全解释,表面拓扑形貌的评价体系还有待完整地建立。生物相容性仍然是生物材料今后一段时期的研究重点,纳米技术与材料的研发将是生物材料领域的热点之一,利用超快激光的先进制造也将是生物材料及其制品今后的研发重点。
