不同水生植物对大肠杆菌去除作用的比较研究
2019-05-13章熙锋
章 熙 锋
(1.中国科学院 水利部 成都山地灾害与环境研究所,四川 成都 610041; 2.西南交通大学 地球科学与环境工程学院,四川 成都 611756; 3.中国科学院大学,北京 100049)
美国环境保护署(USEPA)早在1990年就指出饮用水系统(尤其是地下水)的病原微生物(细菌、原生动物、病毒)污染已成为威胁人类身体健康最具挑战性的问题之一[1]。污水中病原微生物是传播疾病的主要媒介。以大肠杆菌为例,其致病物质包括侵袭力、内毒素和肠毒素,侵袭力则包含有抗原和定居因子等[2],感染大肠杆菌易引起腹泻、出血性大肠炎、肾衰竭和脑膜炎等疾病[3]。埃希氏大肠杆菌具有多个血清型,发病范围较广,严重影响人类健康发展[4]。据报道,由不卫生水引发的疾病占全球疾病发病率的5.7%,占全世界死亡率的4%,其中大肠杆菌引起的疾病备受关注[5]。我国7亿人饮用水源不合格,1.6亿人饮用受有机物污染的水源,大肠杆菌超标率达86%[6]。
由于污水源头污染状况加剧,农村自然沟渠水体中可能存在大量病原微生物(包括肠道致病细菌、肠道病毒及噬菌体等),其径流可能造成下游人畜饮用水病原微生物污染超标[7]。有关水体微生物指标的研究表明我国各大水系均受到一定程度的微生物污染[8]。但目前针对自然水体病原微生物去除研究相对较少, 主要去除途径为通过高温灭菌、熏蒸等实验室方法[9]。人工湿地与生态沟渠污水处理系统具有低投资、低能耗、低成本同时还具有美学价值,运行效果良好、维护管理方便、耐冲击负荷强等优点[10-11]。人工湿地也具有潜在的大肠杆菌污染去除能力,其中湿地水生植物的调控作用十分重要[12]。1949年Hasler和Jones首次发现水生植物能够抑制微藻等微生物生长[13]。1984年Rice指出植物化感作用通过向环境中释放化学物质对附近微生物产生直接或间接、促进或抑制作用[14]。同时许多研究已经检验出植物组织可内化人体病原体(例如:玉米、花生、三叶草、菠菜、香菜、莴苣和红叶莴苣、芝麻菜、西红柿、绿色洋葱、小麦、大米、萝卜芽、绿豆、萝卜、卷心菜、大麦)[15-17],Nicholson等也发现长叶莴苣能内化肠出血性大肠杆菌O157: H7[18]。由于目前利用人工湿地与自然生态沟渠水生植物吸附去除大肠杆菌的技术研究较少,本研究拟筛选几种适宜的水生植物作为人工湿地或生态沟渠的构建物种,从而用于去除污水中大肠杆菌。本研究可为构建农村地区消除病原微生物(如大肠杆菌)污染的工程方法提供科学依据。
1 材料与方法
1.1 实验条件材料及装置
实验所用生活污水样于盐亭县林山乡场镇生活污水池采集。实验所用土样取自中国科学院盐亭紫色土农业生态实验站(以下简称盐亭站)实验地旱地壤土,水生植物为实验站内生态沟渠和池塘内本地适生植物(见图1)。所需实验仪器及装置包括:100 mL灭菌取样瓶、97孔定量检测盘、程控定量封口机、紫外手持式紫外分析仪(西安立科环保科技有限公司),并以直径30 cm陶钵作为盆栽实验培养器[19]。

图1 水生植物Fig.1 Aquatic plants
1.2 实验设计
室内盆栽实验于2017年4~5月进行,如图2所示,采集同一块试验田旱地土壤,磨碎(<2 mm)后暴晒(减少土壤中原有微生物对实验的影响),将晒干土壤混合均匀并称取27份(各2 kg)分别装进27个不漏水的盆栽陶钵中,然后各加入5 L蒸馏水。选取8组水生植物(野茭白、狐尾藻、香菇草、莲藕、美人蕉、水葫芦、岩菖蒲、水芹、)进行合理密度移栽,另设置1组无水生植物作为对照,每组3个重复[19]。培养15 d后将各盆中水倒干,静置1 d(促进根系微生物生长)。采集150 L含大肠杆菌的生活污水[19],摇匀后以普通采样瓶取50 mL水样,分别用测定酸度计和电导率仪测定pH及电导率,同时以灭菌取样瓶取100 mL污水样,测定生活污水中大肠杆菌的初始浓度。初始数据测定完成后,向27个盆钵加入摇匀后的生活污水各5 L,保持室温25℃继续培养。
实验初期大肠杆菌浓度变化较大,所以加入生活污水12 h后,进行第1次取样检测,此后取样检测周期改为48 h,每次取样均同时测定各实验处理的大肠杆菌(包括总大肠菌群和埃希氏大肠杆菌)、pH和电导率,共持续7个取样周期,直至各实验处理中大肠杆菌含量变化不明显。考虑每周期取样量和试验处理盆中水分自然蒸发,每周期取样后向各试验处理盆中加200 mL蒸馏水,由于添加量较小,因此忽略由此引起的大肠杆菌浓度变化。

图2 盆栽试验步骤示意Fig.2 The procedure of pot experiment
沟渠实证实验位于盐亭站200 m长的实验生态沟渠。在每场降雨事件发生后用100 mL灭菌取样瓶分别采集源头污水(主要来自场镇生活污水)和经过野茭白、再力花、香菇草、美人蕉、岩菖蒲、美人蕉、岩菖蒲、野茭白水生植物段的沟渠径流,取样点为沿水流路径的0,1,2,3,4,5,6,7,8号点(见图3),同时用普通取样瓶取50 mL径流样测定其pH及电导率[19]。生态沟渠水生植物基本指标见表1。

图3 生态沟渠植物配置与实景Fig.3 Configuration of ecological ditch plantation and the real scene

表1 生态沟渠水生植物基本指标Tab.1 Aquatic plant index of ecological ditches
1.3 检测方法与数据分析
本研究采用酶底物法测定水样大肠杆菌(总大肠菌群和埃希氏大肠杆菌)含量[19-20]。用灭菌取样瓶从各水生植物试验处理盆中心位置取100 mL水样稀释到适当的倍数,加入ONPG和 MUG两种营养指示剂,摇晃至完全溶解后均匀水平置入97孔定量检测盘,利用程控定量封口机封口,将封口好的97孔定量检测盘放入培养箱(37℃)培养24 h。总大肠菌群为97孔定量检测盘大小孔变色个数计数;埃希氏大肠杆菌利用紫外灯下暗室中97孔定量检测盘大小孔呈荧光个数进行计数,并通过查MPN表换算。
同时采集各实验处理水样50 mL,用雷磁PHS-3C+酸度计和便携式BEC520电导率仪分别测定相应实验处理pH及电导率。
本实验数据处理采用Microsoft Excel 2007,运用origin 8.0作图。采用SPSS软件完成统计分析,方差分析基于LSD法,相关性分析采用Pearson法。
2 结果分析
2.1 不同水生植物对大肠杆菌的去除率
由盆栽实验结果(见图4~5)发现:加入含大肠杆菌的生活污水后,不同处理盆钵中大肠杆菌含量发生了较为一致的变化,第1周期各试验处理大肠杆菌(总大肠菌群和埃希氏大肠杆菌)含量出现剧增现象,从第2周期开始各实验处理中大肠杆菌含量开始呈现不同程度的下降趋势。第3周期后,美人蕉和岩菖蒲对大肠菌群的去除率分别高达95.99%,96.80%,显著高于无水生植物的空白处理率(P<0.01)。上述结果表明在一定水力停留时间内(4.5 d),美人蕉、岩菖蒲去除总大肠菌群的效果更佳。对比其他水生植物处理实验,香菇草、野茭白试验处理对总大肠菌群的去除率仅为32.83%,67.60%,明显偏低(P<0.05),去除效果不佳。总体而言,水生植物美人蕉、岩菖蒲对总大肠菌群具有更加明显的去除效果。
截至第3周期,水芹、狐尾藻、香菇草、岩菖蒲4中水生植物对埃希氏大肠杆菌的去除率分别高达99.13%,98.23%,97.78%,96.85%,莲藕和无水生植物试验处理对其去除率分别为76.60%、66.53%,去除效果明显较差(P<0.05)。截至第7周期,各实验处理对埃希氏大肠杆菌的去除率均达到较高水平。结果表明,各水生植物试验处理对埃希氏大肠杆菌都具有一定的去除效果,其中水芹、狐尾藻、香菇草、岩菖蒲去除速度较快,效果最佳。

图4 不同去除周期总大肠杆菌去除率动态Fig.4 Dynamic of total coliform removal rates in different cycles under different hydrophyte

图5 不同去除周期埃希氏大肠杆菌去除率动态Fig.5 Dynamic of E. coli removal rates in different cycles under different hydrophyte
2.2 不同水生植物水环境变化特征
盆栽实验结果表明:水生植物会不同程度地影响盆钵中生活污水的pH和电导率。由图6可知,实验开始时加入生活污水的初始pH值为8.24,从第2周期开始各水生植物处理组中生活污水pH值相对于空白对照处理均呈现显著下降的趋势,在第5周期狐尾藻和水葫芦处理中生活污水pH值分别下降至7.41,7.51,显著低于无水生植物空白对照处理(8.66)(P<0.05)。结果表明,水生植物能够显著降低水体pH。

图6 盆栽实验中不同周期pH动态Fig.6 pH dynamic in different cycles in the pot experiment
各处理盆钵中生活污水的电导率从实验开始时的761.67 μs/cm下降到实验结束时的600~760 μs/cm(见图7)。结果表明,水生植物处理对电导率的影响并不显著(P>0.05)。

图7 盆栽实验中不同周期电导率动态Fig.7 Electrical conductivity dynamic in different cycles in the pot experiment
2.3 生态沟渠不同植物段大肠杆菌原位去除率
与盆栽实验结果一致,生态沟渠水体原位监测结果显示,污水经过生态沟渠各植物段后大肠杆菌含量及pH均明显下降,具体表现为总大肠菌群去除率为41.20%,埃希氏大肠杆菌去除率为78.58%,pH值由8.19降为7.52。各植物段大肠杆菌净去除率如表2所示,再力花植物段对总大肠菌群去除率较高,美人蕉植物段对埃希氏大肠杆菌去除率较高,生活污水经过香菇草植物段时总大肠杆菌含量呈现增加趋势。大肠杆菌去除率与图8中各折线斜率相关,折线斜率表示经过该植物时相应影响因子变化程度,从图8中可以看出污水经过再力花时总大肠菌群的适生因子大幅度恶化,污水流经美人蕉植物组时埃希氏大肠杆菌的适生因子大幅恶化。
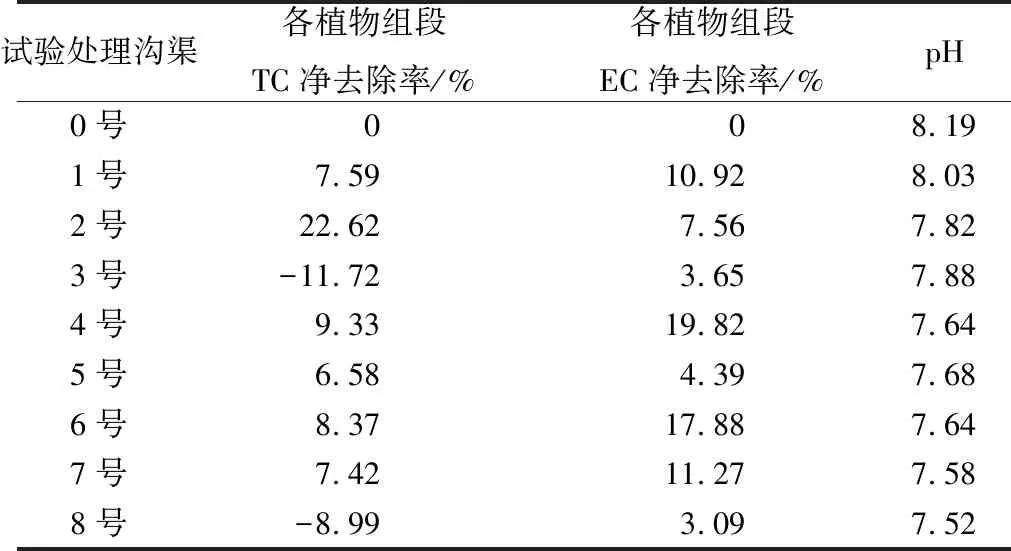
表2 生态沟渠不同植被段大肠杆菌去除率Tab.2 The removal rate of total coliform and E. coli in different sections in ecological ditch
注:TC为总大肠菌群;EC为埃希氏大肠杆菌。

图8 生态沟渠不同植被段大肠杆菌去除率Fig.8 The removal rate of different vegetation sections in thecological ditch
3 讨 论
3.1 不同水生植物大肠杆菌去除动态机理
Moore等研究表明病原微生物易吸附在比表面积大的土壤上[21-22],同时植物存在对包括大肠杆菌在内的病原微生物的内化吸附去除作用[15-17]。其他研究也证明多种微生物可以通过植物细胞降解酶的作用,渗透到宿主植物的根部,在根皮层细胞中形成内生菌根[23-25];Gurtler等人[26]发现通过植物内化作用,微生物能与多种病原菌形成共生关系,并且证明了韭菜根部能内化大肠杆菌O157:H7。理论上实验开始第1周期大肠杆菌含量应急剧减少,但本实验结果表明:从实验开始向各处理中加入含大肠杆菌生活污水到实验检测第1周期,实验结果发现总大肠菌群和埃希氏大肠杆菌都呈现猛增现象(见图4~5),第2周期后各试验处理大肠杆菌才呈现不同程度的下降趋势。原因可能是因为盆钵土壤中含有大肠杆菌及有利于其生长繁殖的营养物质,污水加入后导致大肠杆菌呈现指数增长趋势,繁殖速率远大于土壤和水生植物对大肠杆菌的初始吸附去除速率。但伴随着水生植物内化吸附去除作用逐渐加强,以及土壤中维持大肠杆菌生长的营养物质消耗殆尽,大肠杆菌自然衰亡,从而使各试验处理大肠杆菌的含量从实验第2周期后呈现减少趋势。
牟金明[27]研究发现,不同植物根系分泌物对微生物生存起到促进或者抑制作用。根系分泌物作用于根系周围环境,根系分泌物使根际微生物数目和种类都有很大变化,使得根际微生物数量远远超过非根际。本研究中岩菖蒲为中草药,其根系分泌物可能具有抑制大肠杆菌生长繁殖的成分,因此岩菖蒲大肠杆菌去除能力较强;本实验研究还发现第2周期后,随着维持大肠杆菌生长的营养物质消耗,无水生植物试验处理大肠杆菌的含量也呈现下降趋势,第5周期时总大肠菌群去除率达到93.56%,但香菇草和野茭白试验处理去除率仍较低,仅为32.83%,67.60%。该现象可能是由于水生植物香菇草、野茭白根系分泌物有利于总大肠菌群的生长,从而导致其总大肠菌群含量超过无水生植物试验处理。
罗中捷[28]研究发现,环境温度、营养物质、盐度、渗透压以及pH等都是导致大肠杆菌进入VBNC(可生存但不可培养)状态的主要胁迫因子。李影等[29]研究发现pH对鸡源大肠杆菌新陈代谢具有很大影响,水环境偏弱碱性有利于大肠杆菌的生存,而在冰醋酸(pH=2.0)诱导鸡源大肠杆菌,7 d后菌液中可培养菌数即降为零。本实验结果发现水生植物组相能显著降低水体pH(见图6),因此本研究认为水生植物也可以通过改变水体pH进而影响大肠杆菌的生存繁殖能力。
3.2 水力学特征对生态沟渠大肠杆菌去除的影响
本实验结果发现污水在生态沟渠水力停留时间(HRT)影响大肠杆菌去除率(见图4~5)。盆栽实验水生植物大肠杆菌去除率伴随实验周期的增加呈现正相关关系,经过7个周期后大肠杆菌去除率高达95%以上,而经过生态沟渠时,污水水力停留时间仅为2 h左右,水生植物不能充分吸附去除大肠杆菌,使得整个系统不同植被段大肠杆菌平均去除率较低,其中总大肠杆菌去除率约32%,埃希氏大肠杆菌约为55%。说明在生态沟渠净化污水过程中,宜通过增加水力停留时间(如>5 d)提高病原微生物去除效率。
4 结 论
除香菇草、野茭白外,大部分水生植物具有较强大肠杆菌去除能力,美人蕉、岩菖蒲对总大肠菌群具有最佳去除效果。在构建人工湿地和自然生态沟渠时,应考虑选取具有高效去除大肠杆菌(总大肠菌群和埃希氏大肠杆菌)的当地适生水生植物及其组合,如岩菖蒲、狐尾藻、水葫芦、美人蕉、再力花、水芹等,且人工湿地和生态沟渠水力停留时间应设置为5 d以上。不同水生植物对大肠杆菌的去除效果和机理仍有待进行深入研究。
