临床危险评分系统对结直肠癌肝转移患者生存预测及指导新辅助化疗的意义研究*
2019-05-11李原万德森
李原,万德森
中山大学肿瘤防治中心结直肠科,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心 广东广州 510060
结直肠癌是世界上最常见的恶性肿瘤之一[1]。2018年发布的研究数据显示,我国的结直肠癌发病率已位居常见恶性肿瘤的第三位,并有逐年上升趋势[2]。肝脏是结直肠癌最常见的远处转移部位,虽然肠癌肝转移是肿瘤的晚期阶段,但是通过积极的全身化疗以及局部治疗,该类患者仍有望获得长期生存。据文献显示,接受手术切除肝转移灶的患者5年生存率接近50%[3],10年生存率接近20%[4]。1999年MSKCC的Fong教授[5]提出的转移性结直肠癌(mCRC)临床风险评分(clinical risk score,CRS)是目前最普遍用于预测结直肠癌肝转移患者生存情况并为治疗决策提供参考的评分系统。此评分系统由5个因素组成,每个因素计1分,危险因素越多,生存率越低。虽然CRS系统已提出多年,但是我国对该系统应用的研究较少,其对临床制定治疗方案的参考价值仍不明确。本研究旨探讨CRS系统对我国结直肠癌肝转移患者生存情况的预测作用及对新辅助化疗决策的指导作用,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2000年1月至2012年12月在中山大学肿瘤医院结直肠科及肝胆外科行原发灶和转移灶切除或消融手术的165例结直肠癌肝转移患者的临床病历资料,术后随访截止时间为2015年12月31日。其中12例患者失访、8例患者CRS资料不全,予以剔除,最终纳入145例患者为本次研究对象。研究对象中男性93例(64.1%),女性52例(35.9%);年龄20~80岁,中位年龄58岁;82例(56.6%)患者的原发灶位于结肠,63例(43.4%)位于直肠;同时性肝转移91例(62.8%),其中68例接受同期手术;异时性肝转移54例(37.2%);84例(58.0%)患者为单发肝转移,61例(42.0%)患者的肝转移灶数目多于1个;全组患者肝转移灶最大径中位数为2.7 cm,其中37例(25.5%)患者肝转移灶最大径>5 cm;56例(38.6%)患者接受术前新辅助化疗;术后行辅助化疗130例(89.7%)、未行辅助化疗15例(10.3%)。
1.2 CRS评分情况
CRS系统有以下5项内容,每项各计1分:(1)CEA>200 ng/mL;(2)肝转移发生在原发灶发现后12个月内;(3)原发灶淋巴结转移;(4)肝转移灶最大径>5 cm;(5)肝转移灶>1个。145例患者CRS得分情况如下:0分11例、1分26例、2分55例、3分33例、4分18例、5分2例。按照文献的标准[5],将0~2分患者设为低危组(共92例),3~5分患者设为高危组(共53例)。
1.3 观察指标
随访两组患者的总生存时间和无复发生存时间。两组患者均先行原发灶切除术,后接受转移灶切除或消融手术。总生存时间定义为从肝转移灶切除手术至患者死亡的时间。无复发生存时间定义为从肝转移灶切除手术至患者肿瘤复发或转移的时间。
1.4 统计学方法
本研究使用SPSS 20.0软件进行数据分析。符合偏态分布的数据采用M(QL,QU)表示,采用Kaplan-Meier曲线描述生存情况,并采用Log-rank检验或Wilcoxon检验比较生存曲线的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 随访期间患者总体生存情况
145例结直肠癌肝转移患者均接受肝切除术,术后随访时间为2~126个月,截止于2015年12月31日,中位随访时间为40个月。145例患者的总生存时间中位数为38个月,术后1、3、5年生存率分别为86.2%、51.7%和26.9%;无复发生存时间中位数为15个月,术后1、3、5年无复发生存率分别为60.7%、33.8%和19.3%。
2.2 高危组和低危组患者生存情况
低危组总生存时间中位数为47.5(32,75)个月,高危组总生存时间中位数为21(12,38)个月,两组比较差异有统计学意义(P=0.047),见图1;低危组和高危组的无复发生存时间中位数分别为32(9,67)个月和11(7,18)个月,两组比较差异有统计学意义(P<0.05),见图2。
2.3 高危组和低位组患者接受新辅助化疗的情况
低危组接受新辅助化疗26例(28.3%),直接手术66例(71.7%),两个亚组中位总生存时间分别为42(26,64)个月和55(32,78)个月,亚组间比较差异无统计学意义(P=0.230),见图3;无复发中位生存时间分别为11(7,56)个月和45(13,73)个月,亚组间比较差异有统计学意义(P=0.018),见图4。高危组接受新辅助化疗30例(56.6%),直接手术23例(43.4%),两个亚组中位总生存时间分别为33.5(12,48)个月 和17(13,26)个月,亚组间比较差异无统计学意义(P=0.762),见图5;无复发中位生存时间分别为10(16,22)个月和12(7,16)个月,差异无统计学意义(P=0.417),见图6。
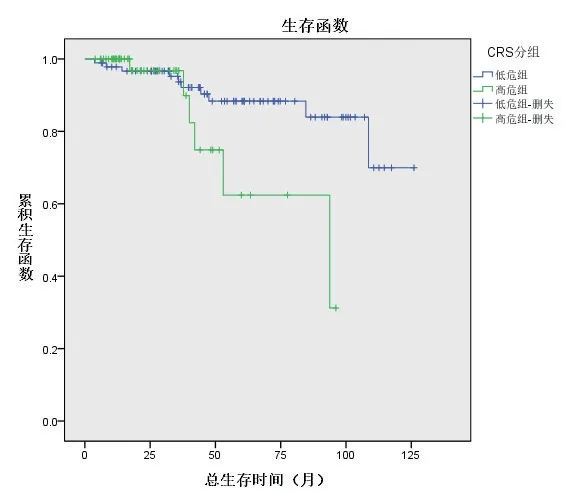
图1 低危组和高危组结直肠癌肝转移患者的总生存曲线
3 讨论
目前,结直肠癌出现肝转移被诊疗指南归为疾病最末期,但是仍有部分患者通过积极的治疗能够长期存活。因此,针对不同情况的结直肠癌肝转移患者应予以区别对待,积极探讨个体化的治疗方案。2018年发布的ESMO指南中对晚期结直肠癌提出了寡转移和广泛性转移的概念,并针对寡转移做出了相对比较系统的治疗策略规划[6]。国际上诸多学者也提出了一些风险评估系统用来预测肠癌肝转移患者的预后以及为制定治疗方案提供参考。CRS评分由于提出的时间早、评分的各项因素容易获得,因此临床医生对它的接受程度较高,是一个方便、有效的评分预测系统。
CRS系统在结直肠癌肝转移患者中的预后预测价值已得到多个研究的证实,但是我国有关此系统临床应用的研究较少。为了评估CRS系统对我国结肠癌肝转移患者生存预后的预测作用,在本研究中,笔者首先回顾性分析本院收治的145例接受肝切除的结直肠癌肝转移患者的临床资料,按照CRS体系进行评分,并比较高危患者与低危患者的预后差异。结果显示,CRS评分能较好地预测我国结肠癌并肝转移患者的生存情况,评分结果为高危的患者,其总体中位生存时间和无复发中位生存时间均短于低危患者,差异均有统计学意义。
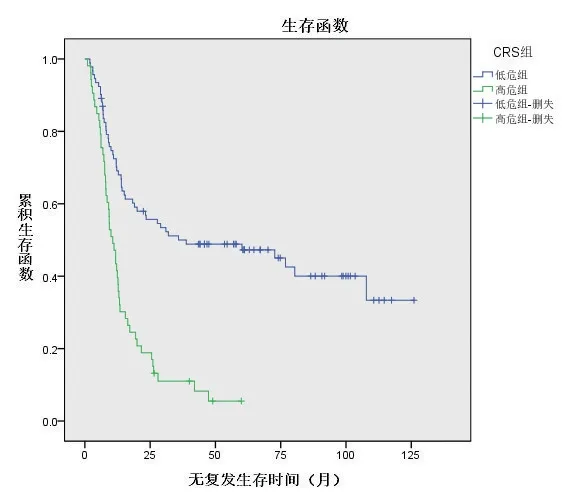
图2 低危组和高危组结直肠癌肝转移患者的无复发生存曲线
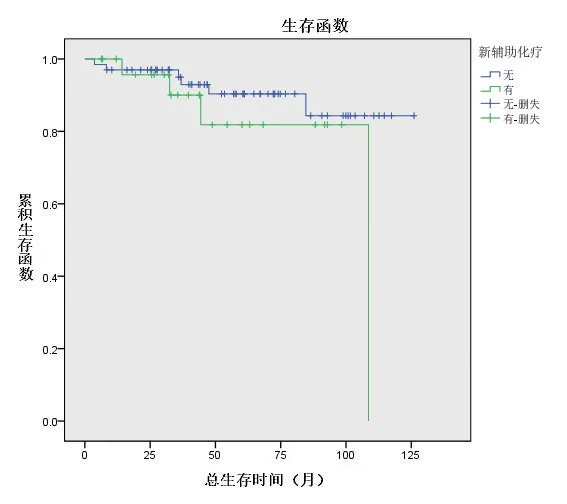
图3 低危组接受新辅助化疗与直接手术患者的总生存曲线
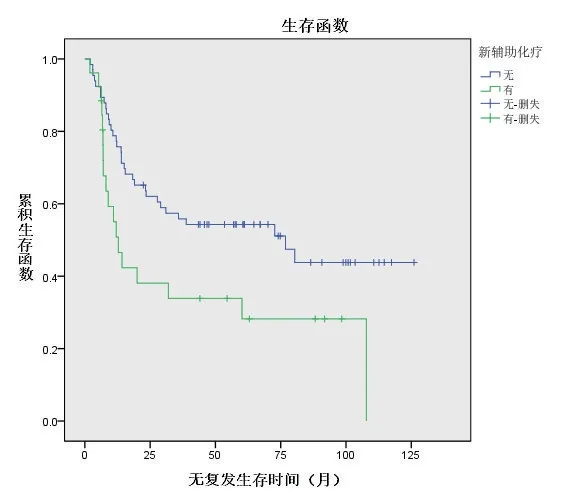
图4 低危组接受新辅助化疗与直接手术患者的无复发生存曲线
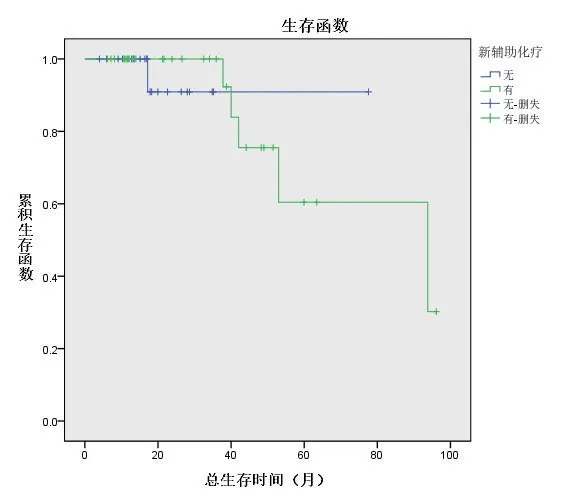
图5 高危组接受新辅助化疗与直接手术患者的总生存曲线
此外,CRS系统除了能较好地预测结直肠癌患者的生存预后,还有多个研究结果显示CRS评分可作为临床制定不同诊疗策略的依据。2001年,Jarnagin等[7]的研究发现:当CRS评分≥3分时,腹腔镜探查示42%的患者会发现不可切除的新病灶;而CRS≤2分时,只有12%的患者可能发现不可切除的病灶;因此,该研究提出对CRS≥3分的患者应常规进行腹腔镜探查,避免无效的开腹手术。Ayez等[8]在可切除结直肠癌肝转移患者的新辅助化疗方面的回顾性研究结果同样表明,CRS≥3分的患者接受新辅助化疗才是获益的,并据此设计了前瞻性随机对照研究——CHARISMA。但是这个结论尚有争议,NEWEPOC研究对可切除的结直肠癌肝转移患者实施新辅助化疗,发现新辅助化疗对这部分患者的总生存时间并没有统计学意义上的改善[9]。
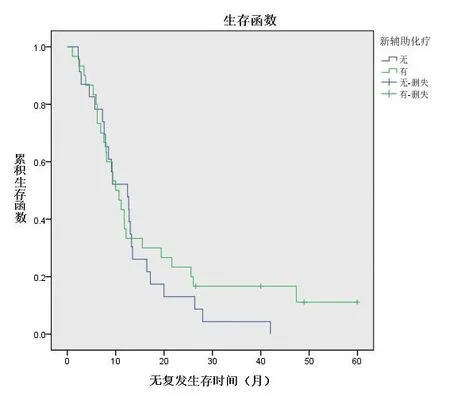
图6 高危组接受新辅助化疗与直接手术患者的无复发生存曲线
为了评估CRS系统对结肠癌肝转移患者新辅助化疗的指导作用,本次研究在根据CRS评分将患者分为低危组和高危组的基础上,根据治疗方案在组内再分出接受新辅助治疗和直接手术两个亚组。统计分析结果显示,低危组内的两个亚组之间总生存时间差异无统计学意义,但直接手术患者的无复发生存时间长于接受新辅助化疗的患者。而高危组内的两个亚组之间比较中位总生存时间和无复发生存时间差异均无统计学意义。总的来说,本次研究中仅在低危组观察到接受新辅助化疗对患者的无复发生存时间有影响,而低危组和高危组总生存时间并没有差异。这提示我们,对于CRS评分为低危的患者接受新辅助化疗似乎意义不大,直接手术可能是一个更好的选择。由于本次研究样本量较小,低危组只有92例,且组间也有一定差异,低危组接受新辅助化疗的患者,肝转移瘤数目大于1个的有12例(46.2%),最大径大于5 cm的有5例(19.2%),而直接手术的患者分别为11例(16.7%)和8例(12.1%),这些不均一性对患者的生存情况也会造成一定影响。对于CRS评分高危的患者是否接受新辅助化疗方面,虽然本次研究的数据未存在统计学差异,但是对于一些切除难度大、转移相对更广泛的患者,建议进行MDT讨论,目前治疗经验倾向进行新辅助化疗。关于CRS评分高危患者新辅助化疗是否获益,期待随机对照研究CHARISMA得出更可靠的结果[10]。
CRS系统也存在一定的缺陷,它对所包含的5个因素赋予了一样的权重,但实际上每个因素在临床的重要性是不同的。Beppu等[11]总结了多个医疗中心肠癌肝转移患者的数据,赋予每个预后因素不同的分值,绘制了列线图来预测该类患者群体的无复发生存时间,显示了较好的预测效能。随着分子生物学的发展和新药物的研发应用,化疗的有效性越来越高,同时,局部治疗的手段越来越丰富、肿瘤的基础研究越来越深入,诸多学者开展对CRS的改进研究。2008年,Andres等[12]在CRS 5个评价因素的基础上增加“肝左右叶均有转移”这一因素,提出mCRS的概念。2014年,Ivanecz等[13]将p53、Ki-67加入CRS系统。此外,我国学者设计的TBS评分系统纳入术前化疗后效果评价、CRS评分及RAS基因型状态三个方面的因素,将外科学与肿瘤学因素相结合,全面评价肿瘤的生物学行为[14]。近来,Margonis等[15]提出了一个新的基因和形态学评分(GAME)系统,在CRS评分的基础上整合了肿瘤负荷评分,并将KRAS基因分型纳入评分系统中,新纳入的几个因素均是术前可以采集的,具有较强的实用意义。
综上所述,CRS系统提出较早,虽然并不完美,但简单、实用便于临床使用。CRS系统对结直肠癌肝转移患者的复发、生存情况仍具有较好的预测作用,但是否能作为此类患者接受新辅助化疗的依据还需要更大样本更深入的的研究证实。
