枸杞发酵液抗氧化和免疫调节作用研究
2019-05-09张瑞雪崔欣悦马勇刘金虎张子韬谷瑞增魏颖
张瑞雪,崔欣悦,马勇,刘金虎,张子韬,谷瑞增,魏颖,*
(1.中国食品发酵工业研究院有限公司,北京 100015;2.北京市蛋白功能肽工程技术研究中心,北京 100015;3.宁夏光彩生物科技有限公司,宁夏 银川 750004)
枸杞(Lycium chinense Mill)为茄科枸杞属(Lycium Linn.)植物,其果实是一种“药食同源”的功能保健性食品,也是一味常用的补肝益肾中药,其色鲜红,味酸甜[1]。枸杞在地球上约80 多种,在我国有7个种3个变种,主要分布于我国北部地区[2],尤其宁夏枸杞在我国宁夏地区已形成大规模种植。
现代科学研究发现枸杞中化学成分类型多样[3],主要涉及生物碱类、黄酮类、萜类等化合物,此外,多糖及类胡萝卜素衍生物也是枸杞中常见的成分。现代药理研究发现枸杞具有多种活性,包括抗氧化、抗肿瘤、抗炎、肝保护、神经保护、抗微生物及辐射保护活性等。近年来,随着人们对养生保健的重视,枸杞加工的研究越来越深入。传统枸杞产品,如枸杞汁、枸杞醋和枸杞酒的工艺逐渐改进;枸杞多糖、黄酮和籽油提取产品,枸杞干制品和枸杞复合产品开发已成为枸杞加工业研究的热点。
枸杞是著名的防衰老滋补品[4],被列为首选的延缓衰老食品之一[5],许多养生方剂中都有枸杞。目前,枸杞功能活性方面,较侧重于提取物和多糖,对枸杞全果的利用研究鲜有报道。乳酸菌(lactic acid bacteria,LAB)是存在于人类和动物体内的天然有益肠道菌群,果蔬经过乳酸菌发酵后,能够延长果蔬的保质期,改善新鲜蔬菜的感官特性,并且产生多种功能性物质[6-7],如超氧化物歧化酶、还原性谷胱甘肽、阿魏酸等,提升其营养价值和功能活性。本文选用经乳酸菌发酵后的枸杞全果发酵液,以细胞模型为基础,研究其抗氧化活性和免疫调节活性,为枸杞的功能评价、合理开发利用奠定实验基础并提供理论依据。
1 材料与方法
1.1 材料与试剂
枸杞发酵液原液(1 号~3 号):宁夏光彩生物科技有限公司(1 号)、台湾大汉酵素有限公司(2 号)、日本万田酵素有限公司(3 号);小鼠(Balb/c,6 周龄~8 周龄):北京维通利华实验动物技术有限公司;偶氮二异丁脒盐酸盐[2,2'-azobis(2-methylpropionamidine)dihydrochloride,AAPH]、2’,7’-二氢二氯荧光黄双乙酸钠(2’,7’-dichlorofluorescin diacetate,DCFH-DA)、刀豆蛋白A(concanavalin A,ConA)、脂多糖(lipopolysaccharides,LPS):sigma 公司;RPMI-1640 培养基:Hyclon 公司;胎牛血清:杭州四季青公司;胰蛋白酶和中性红:Amresco 公司;台盼蓝、红细胞裂解液、4-羟乙基哌嗪乙磺酸(Hepes)、NO 试剂盒、CCK-8 试剂盒:碧云天生物技术研究所;磷酸缓冲盐溶液(phosphate buffer saline,PBS):现用现配,装瓶灭菌后待用。
1.2 仪器与设备
Spectra MR 多功能酶标仪:美国dynex;AC2-6S1生物安全柜:新加坡艺思高科技有限公司;HF90 CO2培养箱:上海力申科学仪器有限公司。
1.3 方法
1.3.1 枸杞发酵液清除自由基的影响
1.3.1.1 样品处理
样品处理前,单细胞悬液以1.0×105个/mL 接于6孔板,每孔2 mL 细胞悬液。待24 h 后细胞单层贴壁,样品溶于荧光染料处理细胞(2 mL/孔),同时设空白对照组和AAPH 组,每组设置6个平行样本。培养箱37 ℃继续孵育1 h 后,吸弃含有样品的培养液,用PBS 缓冲液清洗细胞两次,除空白对照组外,每孔加入800 μmol/L AAPH,继续培养 30 min,MTT 法测定OD 值,计算细胞相对存活率。
1.3.1.2 活性氧簇(reactive oxygen species,ROS)测定
以1.0×105个/mL 细胞密度接种 96 孔细胞培养板,每孔 2 mL,放置 37 ℃、5%CO2细胞培养箱中培养24 h。随后小心吸走6 孔中的细胞上清液,用PBS 清洗一次。加入无血清的RPMI-1640 培养基稀释的枸杞发酵液和荧光染料DCFH-DA,终浓度为25 μmol/L 2 mL,于 37 ℃、5%CO2细胞培养箱中培养 30 min,然后取出吸走上清液,用PBS 小心清洗3 次。最后加入抗氧损伤剂AAPH,置于流式细胞仪测定相对荧光值。细胞内抗氧化能力以ROS 相对产生率来表示。
1.3.2 枸杞发酵液对T/B 淋巴细胞增殖的影响
1.3.2.1 小鼠脾细胞悬液的制备
将小鼠(Balb/c)拉颈处死,于75 %乙醇中浸泡5 min 进行消毒处理,无菌分离完整脾脏,用PBS 冲去浮血,剥除结缔组织及脂肪成分。注射器吸取约5 mL PBS,轻轻插入脾内吹出细胞,重复操作数次至脾外膜透明,剩余脾组织剪成大小1 mm3小块,剪碎后置于小烧杯上的200 目不锈钢滤网上,用注射器针芯研磨,PBS 液洗涤,收集冲洗液至离心管,1 200 r/min 离心5 min,弃上清液,加入3 mL 红细胞裂解液,静置2 min,加入 10 mL PBS 终止反应,离心(1 200 r/min,5 min)弃上清,用 PBS 液洗两次,离心(1 200 r/min,5 min),用RPMI-1640 不完全培养基洗一次,离心(1 200 r/min,5 min),弃上清。加适量RPMI-1640 完全培养基(含10%胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素和10 mmol/L Hepes)。调整细胞浓度至 2×106个细胞/mL,台盼兰染色检测细胞存活率大于95%。
1.3.2.2 枸杞发酵液对脾淋巴细胞增殖的影响
将脾细胞悬液(2×106个细胞/mL)按 100 μL/孔加入到96 孔培养板中,再添加10 μL ConA/LPS(终浓度为 5 μg/mL)和不添加 ConA,10 μL 样品溶液,设置对照组、模型组和样品组,每组做6 次重复,将培养板置于37 ℃、5%CO2的培养箱中培养72 h。
选用CCK-8 试剂盒反应样品对脾细胞和淋巴细胞增殖能力,在490 nm 测定吸光值,结果分别用增殖率和刺激指数(SI)表示,计算如下:

1.3.3 枸杞发酵液对小鼠腹腔巨噬细胞的影响
1.3.3.1 小鼠腹腔巨噬细胞的制备
Balb/c 小鼠,于实验前3 d 腹腔注射1.5 mL4%肉汤淀粉溶液。拉颈处死小鼠,于无菌工作台上将其腹部皮肤剥离,用一次性注射器向腹腔内注入RPMI-1640 不完全培养液 4 mL,轻柔腹部 2 min~3 min,用一次性注射器取其腹部液体,反复2 次~3 次。1 200 r/min离心8 min 收集细胞,洗涤2 次,在倒置显微镜下进行细胞计数,用含10%灭活胎牛血清的RPMI-1640 培养液调整细胞密度达1×106个/mL,加入96 孔细胞培养板中,每孔100 μL,将细胞培养板放入37 ℃、5%CO2饱和湿度培养箱中培养2.5 h,吸弃上清,用预温培养基洗去未贴壁细胞,再加入含10%灭活胎牛血清的RPMI-1640 培养液,制备96 孔板巨噬细胞单层。
1.3.3.2 枸杞发酵液对小鼠腹腔巨噬细胞吞噬活性的测定
模型组每孔加入 10 μLLPS(浓度 30 μg/mL),实验组加入LPS 与不同浓度的枸杞发酵液各10 μL/孔,每组各设6个复孔,于37 ℃、5%CO2饱和湿度培养箱内培养。
培养24 h 后,用预温的无血清培养液洗涤细胞3次,每孔加入200 μL 预温的0.1 %中性红溶液,于37 ℃,5%CO2培养箱内继续培养1 h;倾去上清液,用预温RPMI-1640 培养液清洗3 遍,洗去未被吞噬的中性红;每孔加入200 μL 细胞溶解液(乙酸∶50%乙醇=1∶100,体积比),25 ℃下放置 2 h ~3 h,待细胞溶解后,用酶标仪测定OD550值。吞噬指数(pinocytosis index,PI)计算如下:

1.3.3.3 枸杞发酵液对巨噬细胞NO 生成量的影响
小鼠腹腔巨噬细胞经样品24 h 干预后,收集上清液,依据NO 试剂盒说明书测定NO 生成量。
1.3.4 统计学处理
采用SPSS17.0 统计软件对数据进行处理,实验结果以均值±标准偏差(Mean±SD)表示,并采用组间t 检验,P < 0.05 具有显著性差异。
2 结果与分析
细胞内短时间ROS 水平的波动对于调节细胞功能具有重要的作用,但是如果细胞暴露在高剂量的或是持续性的ROS 中的时候,ROS 防御体系的能力不足以去应对机体内产生的ROS,此时ROS 动态平衡状态被打破,即会导致氧化应激状态的形成。大量存在的非生理水平的ROS 除了扰乱细胞正常的信号通路外,还会和多种细胞结构成份包括DNA、蛋白质、脂类在内的生物大分子发生反应,对机体产生一系列损害以致引发疾病[8]。
枸杞发酵汁处理HepG2 细胞后ROS 的测定结果见图1。
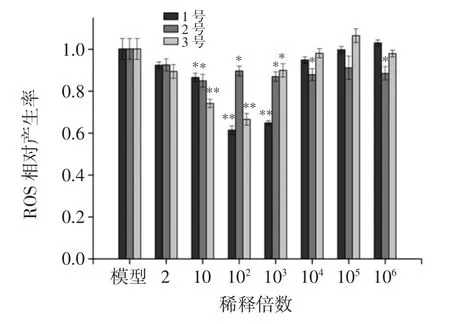
图1 枸杞发酵液缓解HepG2氧化应激的作用Fig.1 The oxidative stress effect of Lycium chinense Mill fermentation liquid on HepG2 cells
由图1可知,在稀释倍数为102时,1 号枸杞发酵液显著(P<0.01)提升细胞对抗氧化应激状态的能力,ROS 相对产生率最低,为0.61,同时ROS 相对产生率与稀释倍数呈U-型量效关系。2 号枸杞发酵液作用HepG2 细胞时,其降低细胞氧化应激状态的能力减弱。由图1可知,3 号枸杞发酵液作用效果优于2 号,在稀释倍数为102,ROS 相对产生率为0.67,具有极显著(P<0.01)抗氧化能力,但作用能力比1 号枸杞发酵液弱。
图2为小鼠脾细胞在不同浓度枸杞发酵液干预72 h 后,细胞增殖情况。
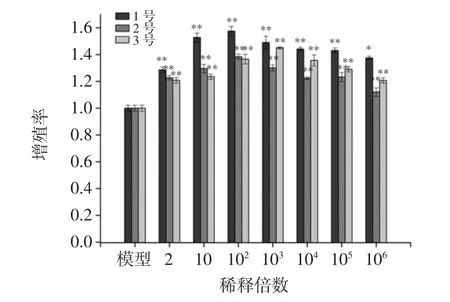
图2 枸杞发酵液对小鼠脾细胞增殖的影响Fig.2 Impacts of Lycium chinense Mill fermentation liquid on the proliferation of mice splenocytes
从图2可以看出,枸杞发酵液7个作用浓度均可明显刺激小鼠脾细胞增殖,对静止的淋巴细胞具有明显的促进作用,存在一定的丝裂原作用。在稀释倍数为 102时,1 号枸杞发酵液显著(P<0.01)促进脾细胞增殖,增殖率最大,为 1.58,明显高于 2 号(1.38)和 3 号枸杞发酵液(1.37),同时脾细胞增殖能力与作用浓度呈倒U-型量效关系。
脾细胞在有丝分裂原如ConA、LPS 等的刺激下,其形态和代谢会发生一系列的改变,转化为母细胞并分化增殖。其中ConA 刺激T 细胞增殖,LPS 刺激B 细胞增殖。因此根据非特异性促有丝分裂原激活T 和B细胞增殖反应的程度,可推测T 和B 细胞识别特异性抗原增殖反应。图3和图4分别为T 淋巴细胞和B 淋巴细胞在不同浓度枸杞发酵液干预72 h 后细胞增殖情况。

图3 枸杞发酵液对Con A诱导的T淋巴细胞增殖的影响Fig.3 Impacts of Lycium chinense Mill fermentation liquid on the proliferation of T lymphocytes induced by Con A
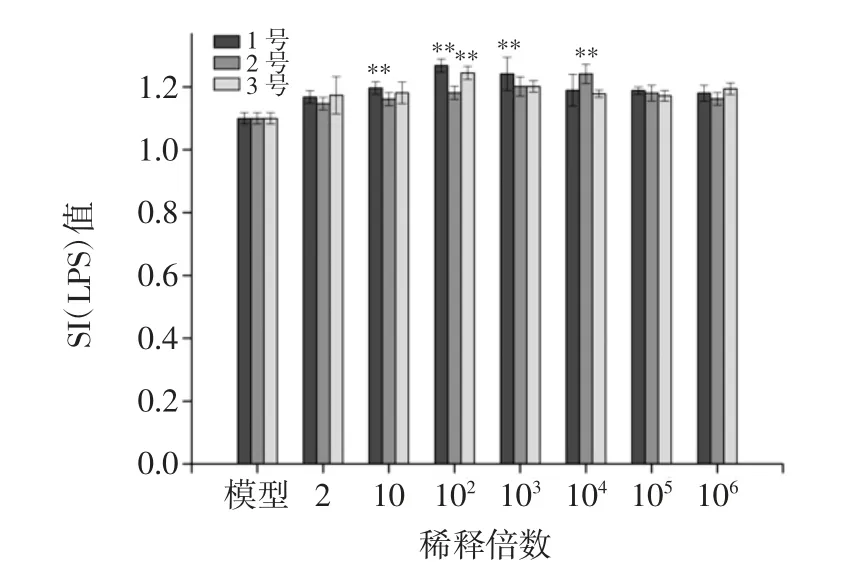
图4 枸杞发酵液对LPS诱导的B淋巴细胞增殖的影响Fig.4 Impacts of Lycium chinense Mill fermentation liquid on the proliferation of B lymphocytes induced by LPS
由图3得出:与模型组相比,在稀释倍数为2、10和102浓度作用下,1 号枸杞发酵液对ConA 诱导的T淋巴细胞增殖具有显著(P<0.01)促进作用,在稀释倍数为102浓度时,SI 值高达1.3,而2 号枸杞发酵液只在稀释倍数为102浓度时有明显(P<0.01)促进作用。3号枸杞发酵液在稀释倍数较大时有促进T 淋巴细胞增值的作用。
由图4得出:3 种枸杞发酵液对促进LPS 诱导的B 淋巴细胞增殖作用效果不明显,在稀释倍数为10、102和 103浓度作用下,1 号发酵液具有明显(P<0.01)促进增殖作用,其他两种发酵液在所有浓度下几乎没有显著促进B 淋巴细胞增殖作用。
巨噬细胞摄入大分子和颗粒状或细胞状物质时主要通过胞吞作用来完成。胞吞作用即指细胞膜接触大分子或颗粒状物质后,即将其包围形成小泡并吞入细胞内的转运过程。选用吞噬中性红能力来评价枸杞发酵液对巨噬细胞的吞噬能力的影响。枸杞发酵液对LPS 诱导的小鼠腹腔巨噬细胞吞噬中性红能力的影响见图5。
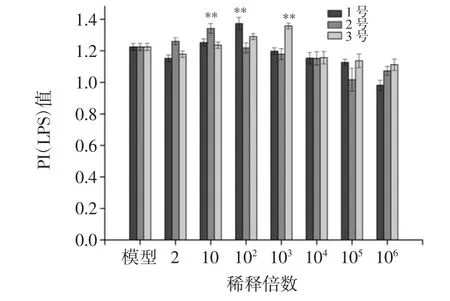
图5 枸杞发酵液对LPS诱导的小鼠腹腔巨噬细胞吞噬中性红能力的影响Fig.5 Impacts of Lycium chinense Mill fermentation liquid on neutral red pinocytosis by LPS-stimulated mice peritoneal macrophages
在LPS 的刺激下,1 号枸杞发酵液稀释倍数为102时,对小鼠腹腔巨噬细胞吞噬中性红能力具有显著(P<0.01)促进作用,可以促进巨噬细胞吞入较大的固体或分子复合物,同时吞噬能力和浓度呈倒-U 型量效关系。2 号枸杞发酵液稀释倍数为10 时、3 号枸杞发酵液在稀释倍数为103时对巨噬细胞吞噬中性红能力具有显著(P<0.01)促进作用。
激活的巨噬细胞利用L-精氨酸合成NO,增加巨噬细胞的细胞毒性,发挥非特异性杀菌和杀伤肿瘤细胞的作用,以及通过多条途径引起免疫联锁反应[9]。因此,NO 合成是巨噬细胞被激活的重要标志,可以使巨噬细胞发挥非特异性免疫作用,并参与炎症反应和免疫反应[10]。枸杞发酵液对小鼠腹腔巨噬细胞NO 生成的影响如图6,在7个作用浓度下枸杞发酵液均可以促进小鼠腹腔巨噬细胞NO 生成。1 号枸杞发酵液在稀释倍数为103浓度时,NO2-生成浓度最大,促进NO的生成最明显,同时NO 生成量和作用浓度呈倒-U 型量效关系。2 号和3 号枸杞发酵液均能促进NO 的生成。

图6 枸杞发酵液对体外小鼠腹腔巨噬细胞NO生成量的影响Fig.6 Impacts of Lycium chinense Mill fermentation liquid on in vitro NO production by mice peritoneal macrophages
3 结论与讨论
当机体存在大量的非生理水平的ROS 时,除了扰乱细胞正常的信号通路外,还会和多种细胞结构成份包括脱氧核糖核酸(deoxyribonucleic acid,DNA)、蛋白质、脂类在内的生物大分子发生反应,对机体产生一系列损害以致引发疾病。氧化应激与多种疾病中包括动脉粥样硬化、糖尿病、肺纤维化、肝硬化、神经退行性疾病和关节炎有着密切的关系,是衰老的主要原因[8]。同时,抗氧化剂可以使免疫系统保持活力,维持人体的稳定状态。
本研究表明:枸杞发酵液具有较好的清除细胞内ROS 水平的能力、促进脾淋巴细胞增殖和提高LPS 诱导的腹腔巨噬细胞吞噬中性红的能力,这3 种不同来源的枸杞发酵液在稀释倍数为10、102和103浓度时作用明显,1 号产品的稀释倍数为102浓度为后续相关试验研究具有借鉴意义。枸杞发酵液具有抗氧化和免疫调节能力这可能与其含有丰富的有机酸、维生素和矿物质有关。经前期研究发现,枸杞发酵液中含有23.07 g/L的有机酸,主要是乳酸、酒石酸和草酸等。枸杞中具有免疫调节的多糖类物质经发酵后分解为小分子糖类,更易于人体吸收利用,发挥功效作用。丰富的维生素、矿物质、黄酮类,有机酸和糖醇类物质协同发挥抗氧化和免疫调节作用,作用机理、量效关系和物质结构鉴定需要进一步的研究。
