油橄榄叶水提物的有效成分与抗氧化活性研究
2019-05-09郭晓强曹敏梁立陈芳姚倩
郭晓强,曹敏,梁立,陈芳,姚倩,*
(1.成都大学药学与生物工程学院,四川 成都 610106;2.成都大学药食同源植物资源开发四川省高校重点实验室,四川 成都 610106)
油橄榄叶富含橄榄苦苷、木犀草苷、咖啡酸、芹菜苷、槲皮素和芦丁等多种酚类化合物[1],具有广泛的生物活性。低浓度的油橄榄叶提取物可抗各种细菌感染,在治疗呼吸道及消化道感染上有潜在应用[2];预先口服40 mg/kg 的油橄榄叶提取物,可以完全阻止乙醇引起的胃黏膜损伤,此作用与油橄榄叶多酚降低炎症反应、提高机体的抗氧化能力相关[1];常食橄榄多酚可以帮助调整血压和血糖,减少低密度脂蛋白的氧化[3]。油橄榄叶多酚提取物还能保护大脑神经,减少大鼠脑梗死面积和脑水肿,对短暂性脑缺血后海马神经元的损伤具有神经保护作用[4]。
油橄榄叶常用的提取方法包括超声提取[5]、低压沸腾提取[6]和微波提取[7],由于超声提取操作简便、效率高、能耗低,成为实验室使用最为广泛的提取技术。常用的提取溶剂为不同浓度的乙醇和甲醇溶液[8-9]。水是廉价易得、绿色环保的溶剂,但较少被应用于植物提取,可能的原因为水提物成分复杂,后期纯化较为困难。该试验以总多酚为指标,采用响应面法优化了油橄榄叶水提工艺,水提物经浓缩、醇沉处理后冷冻干燥为粉末,不吸湿,分散性好,易进一步加工为片剂或胶囊剂等固体制剂。本研究比较了油橄榄叶水提物、乙醇提取物及甲醇提取物的有效成分及体外抗氧化活性,为油橄榄叶水提工艺的应用及后续产品开发提供理论指导。
1 仪器与材料
1.1 仪器
KQ-400KDE 型超声仪:昆山市超声仪器有限公司;RE-2000A 型旋转蒸发器:上海亚荣生化仪器厂;SCIENTZ 型冷冻干燥机:宁波新芝生物科技有限公司;7200 型可见-紫外分光光度仪:上海天普科技有限公司;Agilent 1100 高效液相色谱仪、Agilent 1100 紫外检测器:美国Agilent Technologies 公司。
1.2 材料
油橄榄叶:由四川天源油橄榄有限公司提供,经粉碎后过80 目筛,-20 ℃贮藏备用,临用前25 ℃下放置2 h;芦丁对照品:中国药品生物制品检定所,供含量测定用,纯度大于98%;1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH):日本 TCI 公司;2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonate,ABTS]:南京奥多福尼生物科技有限公司;高效液相色谱(high performance liquid chromatography,HPLC)用乙腈和甲醇(色谱纯)及其它试剂(分析纯):成都科龙化学试剂公司。
2 方法
2.1 油橄榄叶多酚的提取
2.1.1 水提取
取10 g 油橄榄叶,加200 mL 蒸馏水,0.125 g 硼砂,0.2 g NaHSO3,设置超声仪温度为60 ℃,超声提取60 min。提取结束后,过滤,滤液减压浓缩至60 mL,加入无水乙醇60 mL,4 ℃冷藏过夜。取上清液滤过,滤液经减压浓缩除去90%的溶剂,余下的浸膏冷冻干燥24 h,再置真空干燥箱中干燥至恒重,以干重除以投料量计算提取率。提取物密封后4 ℃低温保存。
2.1.2 乙醇溶液提取
取10 g 油橄榄叶,加入200 mL 浓度为44%的乙醇溶液(体积分数),在34 ℃下超声提取60 min[8]。提取结束后,滤过,取滤液减压浓缩除去溶剂,冷冻干燥24 h,步骤同水提取法。
2.1.3 甲醇溶液提取
取10 g 油橄榄叶,加入50 mL 浓度为80%的甲醇溶液(体积分数),25 ℃下超声提取15 min[9]。其余步骤同水提取法。
2.2 含量测定
2.2.1 总多酚
取没食子酸对照品,用甲醇制成浓度分别为10、20、30、40、50 μg/mL 的溶液,分别量取 0.5 mL,置 10 mL刻度试管中,加经10 倍稀释的Folin 酚试剂2.5 mL[10],混匀,25 ℃放置 5min;再加入 7.5%Na2CO3溶液 2.5 mL,混匀,30 ℃下反应 1 h,冷至 25 ℃,于 760 nm 波长处测定吸光度A,以没食子酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。另取3 组油橄榄叶提取物,分别制成浓度为1 mg/mL 的溶液,分别量取0.5 mL,按没食子酸对照品测定方法操作,记录吸光度值A,由标准曲线计算提取物中总多酚含量。
2.2.2 总黄酮
取3 组油橄榄叶提取物,分别用对应的提取溶剂制成浓度为2 mg/mL 的溶液。分别精密量取3 mL,置25 mL 量瓶中,加 5 %NaNO2溶液 1 mL,摇匀,静置6 min,再加入10 %Al(NO3)3溶液1 mL,摇匀,静置6 min,加4%的NaOH 溶液5 mL,用蒸馏水稀释至刻度,摇匀,25 ℃下放置 15 min 后,于 506 nm 波长处测定吸光度A;另配制不加试剂的提取物空白溶液,测定吸光度,作为背景吸收值。取浓度分别为0.025、0.05、0.1、0.2 、0.4 mg/mL 及 0.8 mg/mL 的芦丁对照品溶液,同法操作,绘制标准曲线,按外标法计算总黄酮含量。
2.2.3 羟基酪醇
HPLC 检测的色谱条件为:固定相为迪马C18 Diamonsil Plus 柱(4.6 mm ×250 mm,5 μm),流动相为甲醇-0.2 %磷酸(2∶98,体积比),流速 1 mL/min,柱温35 ℃,检测波长 235 nm。
测定方法为:油橄榄叶水提物用蒸馏水溶解并制成浓度为5 mg/mL 的溶液;乙醇和甲醇提取物样品的制备方法为:分别取提取物0.1 g,置10 mL 量瓶中,加蒸馏水7 mL~8 mL,超声5 min,用蒸馏水稀释至刻度,摇匀;在8 000 r/min 下离心10 min,取上清液,作为供试品溶液。取羟基酪醇对照品,用水稀释制成浓度分别为 0.1、0.5、2.5、12.5、62.5 μg/mL 的溶液,作为对照品溶液。精密量取供试品溶液及对照品溶液各20 μL,注入液相色谱仪,记录峰面积A,以对照品浓度为横坐标,峰面积为纵坐标,绘制标准曲线,按外标法计算含量。
2.2.4 橄榄苦苷
HPLC 检测的色谱条件为:固定相为迪马C18 Diamonsil Plus 柱(4.6 mm × 250 mm,5 μm),流动相为乙腈-水(22∶78),流速 1 mL/min,柱温 35 ℃,检测波长226 nm。
测定方法为:用水制备浓度为10 mg/mL 的提取物供试品溶液,制备方法同“2.2.3”项;取橄榄苦苷对照品,用水稀释制成浓度为 0.5、1、2、4、8 μg/mL 的溶液,作为对照品溶液。精密量取供试品溶液及对照品溶液各20 μL,注入液相色谱仪,记录峰面积A,绘制标准曲线,按外标法计算含量。
2.3 抗氧化活性检测
2.3.1 DPPH 自由基清除率
取DPPH 固体,加乙醇溶解并制成浓度约为50 μg/mL 的溶液。取3 组油橄榄叶提取物,分别用对应的提取溶剂溶解并制成浓度为 15、30、60、120、240 μg/mL 的溶液。分别精密量取DPPH 溶液和提取物样品溶液各2 mL,按文献报道方法检测[11]。
2.3.2 ABTS+自由基清除率
取3 组油橄榄叶提取物,分别用对应的提取溶剂溶解并制成浓度为 31.25、62.5、125、250、500 μg/mL 的溶液。分别精密量取提取物溶液及ABTS 溶液各2 mL,混匀,按文献报道方法测定[12]。
2.3.3 羟基自由基清除率
取3 组油橄榄叶提取物,分别用对应的提取溶剂溶解并制成浓度为 0.25、0.5、1、2、4 mg/mL 的溶液。按文献报道方法测定[11]。
2.3.4 还原力
取3 组油橄榄叶提取物,分别用对应的提取溶剂溶解并制成浓度为 0.25、0.5、1、2、4 mg/mL 的溶液。取系列浓度的提取物溶液1.0 mL,依次加入0.2 mol/L pH6.6 的磷酸盐缓冲液及 1%K3Fe(CN)6溶液各 2.5 mL,混匀,于50 ℃下保温20 min,冷至25 ℃,加入10%三氯乙酸溶液2.5 mL,混匀,从中取2.5 mL,加蒸馏水2.5 mL,0.1%FeCl3溶液 0.5mL,混匀,25 ℃放置 10 min,加冰醋酸1.5 mL 使溶解,于700 nm 波长处测定吸光度值;另取各提取物溶液1.0 mL,依次加入磷酸盐缓冲液、蒸馏水及三氯乙酸溶液各2.5 mL,混匀,从中取出2.5 mL,加入蒸馏水3.0 mL,冰醋酸1.5 mL,混匀,测定吸光度值,作为背景值;以测得值减去背景值,得到各提取物的还原力吸光度值。
2.3.5 主成分分析
采用SPSS19.0 软件对提取物总多酚、总黄酮等4个含量测定结果及4个抗氧化活性结果进行数据标准化处理,随后采用降维因子分析对8个变量进行主成分分析,找到最能代表提取物的特征值,根据各特征值的方差贡献,计算3 种提取方法的主成分综合得分。
3 结果与分析
3.1 总多酚、总黄酮、羟基酪醇及橄榄苦苷含量
橄榄苦苷是油橄榄叶最重要的活性成分,在提取过程中易降解为羟基酪醇,降解物的抗氧化作用优于橄榄苦苷,因此同时对这2个组分进行考察。在检测羟基酪醇时,由于2 种醇提物含量均较低,故配制浓度较水提物提高1 倍;原选择提取溶剂,即44%乙醇和80%甲醇分别溶解醇提物,但因制备浓度高,导致杂峰多,干扰大,羟基酪醇与其他组分的分离度很差。考虑到0.1 g 提取物羟基酪醇含量极微,故将制备供试品用溶剂改为水,不仅保证了低浓度羟基酪醇的提出,同时除去了醇溶性杂质的干扰,羟基酪醇分离度明显改善,检测的准确度提高。橄榄苦苷水溶性好,因此使用水制备样品溶液,减少水不溶性杂质的影响。
水提物、乙醇提取物及甲醇提取物的提取率分别为14.0%、10.4%及11.3%。总多酚(以没食子酸计)标准曲线为 A=5.83C+0.037(r=0.999 6),总黄酮(以芦丁计)标准曲线为 A=1.868 2C+0.005(r=0.999 8),羟基酪醇标准曲线为A=11.83C+1.152(r=1.000 0),橄榄苦苷标准曲线为A=3.23C-0.10(r=0.999 1),各提取物含量测定结果见表1。
橄榄苦苷仅在甲醇提取物中检测到,可能由于乙醇提取所用溶剂含大量水,水提法则完全以水为溶剂,超声过程引起了橄榄苦苷水解。

表1 提取物含量测定结果(n=3)Table 1 Contents of the extracts(n=3)
3.2 抗氧化活性
3.2.1 DPPH 自由基清除率
DPPH 自由基清除率测定结果见图1。

图1 油橄榄叶不同溶剂提取物对DPPH自由基的清除率Fig.1 The scanvenging rates of olive leaf extracts obtained by different solvents against DPPH free radicals
由图1可知,3 种提取物对DPPH·的清除率均表现出了浓度依赖的趋势,对DPPH·清除力的顺序为:水提物>甲醇提取物>乙醇提取物。
3.2.2 ABTS+自由基清除率
油橄榄叶不同溶剂提取物对ABTS+自由基的清除率结果见图2。

图2 油橄榄叶不同溶剂提取物对ABTS+自由基的清除率Fig.2 The scanvenging rates of olive leaf extracts obtained by different solvents against ABTS+free radicals
由图2可见,油橄榄叶水提物清除ABTS+自由基的能力明显高于2 种醇提物,乙醇提取物的清除能力略强于甲醇提取物。
3.2.3 羟基自由基清除率
油橄榄叶不同溶剂提取物对羟基自由基的清除率测定结果见图3。

图3 油橄榄叶不同溶剂提取物对羟基自由基的清除率Fig.3 The scanvenging rates of olive leaf extracts obtained by different solvents against hydroxyl free radicals
由图3可见,2 种醇提物对羟基自由基的清除能力优于水提物。
3.2.4 还原力
油橄榄叶不同溶剂提取物的还原力测定结果见图4。
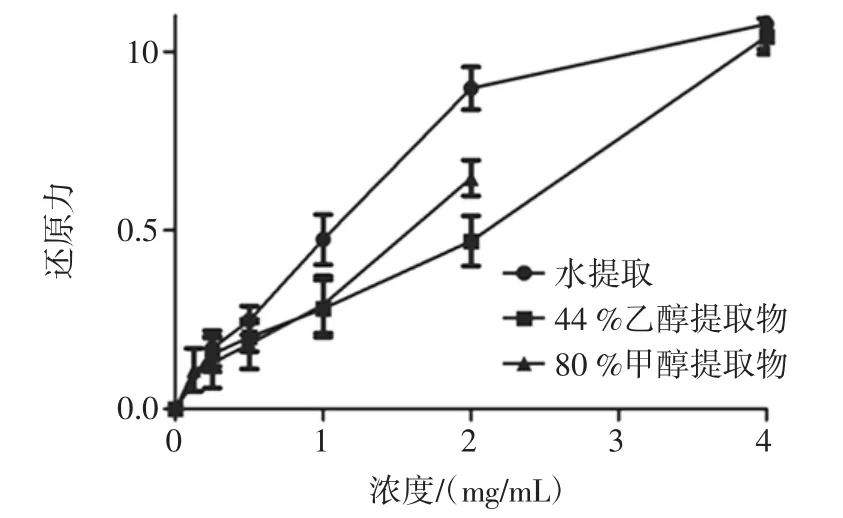
图4 油橄榄叶不同溶剂提取物的还原力Fig.4 The reducing power of olive leaf extracts obtained by different solvents
以80%甲醇为溶剂,油橄榄叶甲醇提取物的最大可配制浓度为2 mg/mL,超过此浓度即产生沉淀,因此甲醇提取物的还原力和羟基自由基清除率仅考察至2 mg/mL,水提物和乙醇提取物检测至4 mg/mL。由图可知,三者的还原力顺序为:水提物>甲醇提取物>乙醇提取物。
3.3 主成分分析
3.3.1 相关矩阵
由SPSS19.0 软件获得的相关矩阵见表2。

表2 相关矩阵表Table 2 Correlation matrix table
由表2可知,总多酚、总黄酮及羟基酪醇与提取物各抗氧化活性指标相关性较大,相关系数接近1.0,橄榄苦苷仅与DPPH·清除率和ABTS+·清除率有相对较弱的负相关,而与羟基自由基清除率和还原力关联度较小。
3.3.2 降维因子分析
成分含量与抗氧化指标对总方差的贡献结果见表3。

表3 提取物含量与抗氧化活性指标对总方差的贡献Table 3 The contribution of the extract content and antioxidant activity to total variance
由表3可知,总多酚对方差的贡献率高达84.04%,总多酚与总黄酮对方差的总贡献率达100%,说明描述提取物的特征值主要为总多酚和总黄酮,可将8个特征值降维为2个。
3.3.3 成分载荷图
主成分载荷图见图5。

图5 主成分载荷图Fig.5 Loading map of principle components
由图5可知,羟基酪醇、总黄酮及羟基自由基清除率对第一主成分总多酚有较大的正影响,三者取值高时则总多酚含量高,ABTS+·和DPPH·清除率对总多酚有较大的负影响,清除率高,消耗的多酚多,引起总多酚值下降。此外,橄榄苦苷和还原力对总多酚有中等程度的负影响,载荷系数在0.65~0.80 之间,这可能因为橄榄苦苷可降解为羟基酪醇多酚,当橄榄苦苷含量高时,则羟基酪醇含量低,导致总多酚值较低;还原力升高,消耗的多酚增加,也会引起总多酚值下降。橄榄苦苷和还原力对第二主成分总黄酮有中等程度的正影响,载荷系数在0.55~0.80 之间。
3.3.4 主成分得分
根据软件计算的因子值,按下式计算各提取物主成分总得分:
主成分总分=2.585×FAC1×84.044+1.148×FAC2×15.956
式中:2.585 和 1.148 分别为主成分 1 和 2 特征值的算术平方根,FAC1 及FAC2 分别为软件计算的主成分 1 和 2 因子值,84.044 及 15.956 分别为主成分 1 和2 的方差贡献率,由此,得到水提物、乙醇提取物和甲醇提取物主成分总分分别为249.87、-136.89 及-112.98。说明水提物综合评分明显优于二种醇提物,甲醇提取物略高于乙醇提取物。
油橄榄叶水提物主成分分析综合评分结果远高于二种醇提物,这可能源于水提过程中加入了硼砂保护酚羟基,并使用NaHSO3防止酚羟基氧化,随后提取物经减压浓缩,加入等体积乙醇沉淀醇不溶性杂质,在冷藏过程中,硼砂和NaHSO3析出,经滤过除去。保护剂的应用使得水提物含有高浓度的多酚和羟基酪醇;保护剂在醇溶液中溶解度差,限制了其在醇提技术中的使用。
4 结论
采用超声法,分别以水、44%乙醇及80%甲醇为溶剂提取油橄榄叶,水提物总多酚与羟基酪醇含量、对ABTS+自由基的清除率及还原力显著高于醇提物(p <0.01),但清除羟基自由基的能力不及醇提物。主成分降维因子分析结果显示,总多酚和总黄酮为代表提取物的主要特征值,水提物、乙醇提取物和甲醇提取物的主成分得分分别为249.87、-136.89 及-112.98,表明水提物有效成分含量和抗氧化活性的综合评分远高于二种醇提物,具有巨大的应用潜力。
