沙棘熊果酸对H22荷瘤小鼠抑瘤活性及其机制的探讨
2019-05-09张男男侯瑞丽李可欣张文龙高龙苗晓涵戈娜
张男男,侯瑞丽,李可欣,张文龙,高龙,苗晓涵,戈娜,*
(1.包头医学院营养与食品健康研究所,内蒙古 包头 014040;2.包头医学院第一附属医院骨外科,内蒙古 包头 014010)
沙棘(Hippophae rhamnoides L.)又名酸醋柳、黑刺、酸刺、其察日嘎纳(蒙名)、达普(藏名)、吉汗(维吾尔名)等[1],是胡颓子科沙棘属的一种野生浆果植物,多为橘黄色或橘红色。有“天然维生素宝库”、“营养保健来源”、“神果奇树”等美称。是我国西部地区最具代表性的一种经济植物。沙棘含有的化合物种类多达百种以上,这些物质包含了人体必需氨基酸、维生素、微量元素、生育酚、类胡萝卜素、多酚、黄酮及其他一些对身体有益的脂肪酸等活性物质[2],具有降脂、抗氧化、抗炎症等作用,是珍贵的药食同源植物资源。内蒙古自治区是沙棘的主要种植区,既往对沙棘的开发利用多关注提取物黄酮类、多糖类等的功效研究,而对沙棘中熊果酸生物学作用罕有研究。
熊果酸(ursolic acid,UA)又名乌苏酸,是一种弱酸性五环三萜类化合物,在自然界分布广范,多以游离或与糖结合成甙的形式存在于沙棘、女贞子、山楂、蔓越莓、枇杷叶等植物中,是多种植物的主要功能成分[3],具有保肝、抗炎、抗氧化、抗肿瘤等多种活性。早在1990年就被日本列为最有希望的抗癌预防药物之一[4]。
肝癌(hepatocellular carcinoma,HCC),是世界范围内常见的恶性肿瘤,其发病率位居所有恶性肿瘤的第5位,死亡率位居第3位[5],我国是世界上肝癌发病率最高的国家之一,每年死于肝癌的患者约占世界肝癌死亡人数的45%[6]。虽然,目前临床上治疗肝癌的方法众多,如氟尿嘧啶和喃氟啶是肝癌临床常用药物,肝移植是治疗肝癌最有效的方法。然而,由于肝癌起病隐匿,发现时大多已进入中晚期,愈后复发转移率高,以及现存的治疗方法副作用大且易出现耐药现象等,使得肝癌难以实现根治。因此寻找一种高效、低毒、疗效稳定的天然抗肝癌药物成为研究的热点。本研究通过建立H22荷瘤小鼠模型,观察沙棘熊果酸对肿瘤的抑制作用,并通过检测白细胞介素-12(interleukin-12,IL-12)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、血管内皮生长因子(vascular endothelial growth factor,VEGF)以及 Ras 蛋白的表达水平,进一步探讨沙棘熊果酸抑制肿瘤生长的机制,为今后内蒙古地区沙棘的深度开发奠定基础,同时也有望填补蒙药沙棘在高效、低毒天然药用植物研发领域的研究空白。
1 材料与方法
1.1 材料
沙棘果:内蒙古农业大学于呼和浩特市和林县境内野生沙棘林采集、提供并鉴定,后经内蒙古科技大学分离纯化,并应用红外光谱(infra-red spectrum,IR)、高效液相色谱(high performance liquid chromatography,HPLC)、核磁共振(1H-nuclear magnetic resonance,1HNMR 和13C-nuclear magnetic resonance,13C-NMR)鉴定为五环三萜类化合物——熊果酸(ursolic acid,UA),分子式为C30H48O3,分子量为456.68,纯度93.8%。
1.2 主要试剂和仪器
环磷酰胺(cyclophosphamide,CP):江苏盛迪医药有限公司;鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体:美国Santa Cruz 公司;BCA 蛋白浓度测定试剂盒、超敏ECL 化学发光试剂盒、RIPA 裂解液、PMSF 蛋白酶抑制剂、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)蛋白上样缓冲液:江苏碧云天生物技术研究所;羊抗兔Ras 和VEGF 多克隆抗体:美国Abcam 公司;二抗(辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗小鼠IgG):北京中杉金桥生物技术有限公司;ELISA 检测试剂盒(TNF-α 和 IL-12):依科赛生物科技有限公司。
CX41 照相显微镜:日本Olympus 公司;550 型酶标仪、UVP-GDS-8000 凝胶成像分析系统:美国Bio-Rad 公司;BAYGENE 电泳仪:北京百晶生物技术有限公司。
1.3 动物和瘤株
SPF级雄性KM种小鼠50只,体重(20±2)g,购自中国人民解放军军事医学科学院实验动物中心,动物许可证号:SCXK 军2012-0004。瘤源为腹水型H22肝癌种鼠:中国科学院。
1.4 实验方法
1.4.1 H22荷瘤小鼠模型的建立及分组
分别于50 只雄性KM 种小鼠左前肢腋窝皮下接种浓度为2.8×107个/mL H22细胞悬液0.2 mL,整个操作30 min 内完成。接种24 h 后,根据体重随机分成5组,每组10 只。模型组给予0.2 mL/(kg·d)瓜子色拉油灌胃,UA 低、中、高剂量组小鼠分别给予 UA100、150、300 mg/(kg·d),采用瓜子色拉油为溶剂;CP 组予以CP 25 mg/(kg·d)。连续给药2 周。末次给药12 h 后,记录体重并断头取血,分离血浆;剥离肿瘤组织、肝、肾、脾,称重。瘤组织除用于病理检测外,剩余标本均冻存在-80 ℃冰箱中备用。
1.4.2 沙棘熊果酸对H22荷瘤小鼠的抑瘤作用及对肝、肾、脾的影响
抑瘤率/%=(模型组平均瘤质量-熊果酸组平均瘤质量)/模型组平均瘤质量×100
脏器指数=脏器质量(mg)/体质量(g)
1.4.3 苏木精-伊红染色法(hematoxylin-eosin staining,HE)观察瘤组织的病理形态学变化
将0.9 cm×0.9 cm×0.5 cm 新鲜肿瘤组织固定于4%多聚甲醛缓冲液中过夜,常规石蜡包埋,切片,脱蜡,HE 染色,中性树胶封片,光学显微镜下观察瘤组织形态学变化。
1.4.4 免疫组织化学法检测瘤组织基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)的表达
取新鲜肿瘤组织做石蜡切片,按照免疫组化试剂盒说明进行操作,测定光密度值(A)及平均灰度值,阳性信号以胞浆内出现棕黄色颗粒为判定标准,A 值越大/平均灰度值越低,表明MMP-2 阳性表达越强。
1.4.5 沙棘熊果酸对H22荷瘤小鼠血浆中TNF-α 和IL-12 的影响
酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测各组血清中 TNF-α 和 IL-12 水平的影响,测定过程严格按照ELISA 试剂盒说明书进行,用酶标仪测450 nm 处OD 值,按照各自标准曲线计算 TNF-α 和 IL-12 浓度。
1.4.6 蛋白免疫印迹法检测瘤组织Ras、VEGF 等的表达
裂解瘤组织提取总蛋白,12 000 g×20 min 离心,收集上清液用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,按5 份样品体积与1 份加样缓冲液混匀,100 ℃孵育 3 min,上样体积为 10 μL~20 μL 混合液,经5%~12%SDS-PAGE 分离样品后将蛋白转至硝酸纤维素膜上,以5%脱脂奶粉封闭2 h,按操作加入相应的一抗(GAPDH 抗体体积比为1∶800、Ras 抗体体积比为1∶1000、VEGF 抗体体积比为1∶1000)及适当稀释倍数的二抗。凝胶成像系统拍照分析。以GAPDH 为内参,以靶蛋白积分光密度(IOD)值与GAPDH(IOD)值的比值显示靶蛋白相对水平。
1.5 统计学分析
应用SPSS17.0 软件整理和分析实验数据。符合正态分布且方差齐的计量资料多组间比较,采取单因素方差分析,以±s 表示,不同组间两两比较采用LSD-t检验,检验水准α=0.05。
2 结果与分析
2.1 各组小鼠一般状况的比较
接种前,各组小鼠左前腋下预注射部位未触及包块,各组小鼠精神状态良好,反应灵敏,动作自如,皮毛顺滑,有光泽,呈乳白色,体重明显增加,进食饮水正常;接种H22细胞第7天,各实验组小鼠左前腋部皮下出现肉眼可见的类圆形结节,质地坚硬,高出皮肤表面,不可活动,呈现反应呆滞,少动,皮毛无光,体重降低,少食的现象;接种后第14天,模型组小鼠,精神萎靡,毛色晦暗,枯黄,懒怠少动,体型消瘦,且左前肢活动受限,并存在个别荷瘤小鼠左前肢皮下肿瘤溃破,爬行缓慢。相较于模型组,CP 组小鼠瘤体增长缓慢,但体重急剧下降,耳朵苍白无血色,精神、食量差,少动。而UA 各剂量组与模型组比较,瘤体增长慢,精神、活动及饮食情况均有所缓解。
2.2 各组小鼠体重及脏器指数的变化
各组小鼠给药前后体重变化及对脏器指数影响见表1。
表1 各组小鼠给药前后体重变化及对脏器指数影响(±s,n=10)Table 1 The weight change and the influence on organ index before and after administration of each group(±s,n=10)
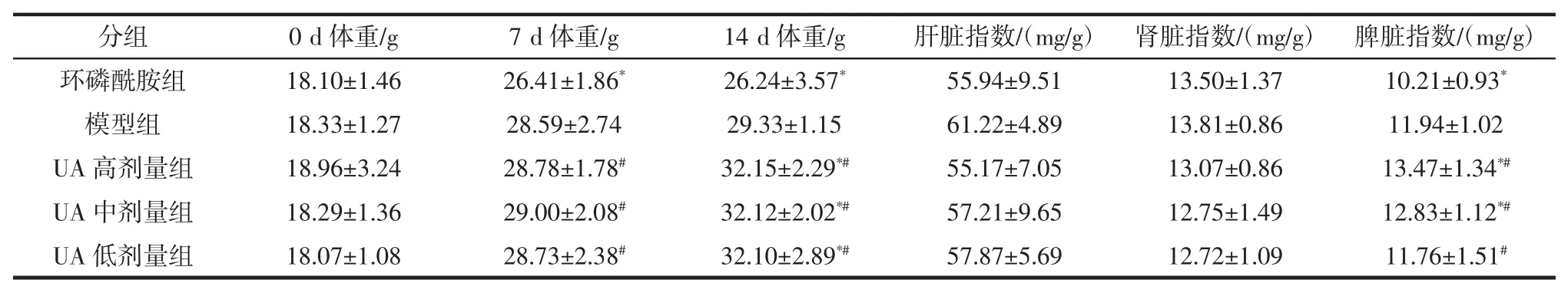
表1 各组小鼠给药前后体重变化及对脏器指数影响(±s,n=10)Table 1 The weight change and the influence on organ index before and after administration of each group(±s,n=10)
注:与模型组相比,*P<0.05;与环磷酰胺对照组相比,#P<0.05。
分组0 d 体重/g7 d 体重/g14 d 体重/g肝脏指数/(mg/g)肾脏指数/(mg/g)脾脏指数/(mg/g)环磷酰胺组 18.10±1.46 26.41±1.86* 26.24±3.57* 55.94±9.51 13.50±1.37 10.21±0.93*模型组 18.33±1.27 28.59±2.74 29.33±1.15 61.22±4.89 13.81±0.86 11.94±1.02 UA 高剂量组 18.96±3.24 28.78±1.78# 32.15±2.29*# 55.17±7.05 13.07±0.86 13.47±1.34*#UA 中剂量组 18.29±1.36 29.00±2.08# 32.12±2.02*# 57.21±9.65 12.75±1.49 12.83±1.12*#UA 低剂量组 18.07±1.08 28.73±2.38# 32.10±2.89*# 57.87±5.69 12.72±1.09 11.76±1.51#
由表1可知,接种前各组小鼠体重均无显著性差异(P>0.05);实验前 7 d,相比模型组,CP 组荷瘤小鼠体重明显下降(P<0.05),但低、中、高 UA 组荷瘤小鼠体重无显著性差异(P>0.05);实验后 7 d,低、中、高 UA组荷瘤鼠体重显著高于模型组(P<0.05)。相比模型组,低、中、高UA 组肝、肾脏器指数均无显著性差异(P>0.05);脾脏指数明显升高(P<0.05);CP 组脾脏指数明显降低(P<0.05)。
2.3 沙棘熊果酸对小鼠肿瘤生长的抑制作用
各组H22肝癌小鼠移植瘤见图1,沙棘熊果酸对小鼠肿瘤的影响见表2。
由表2可知,与模型组相比,沙棘熊果酸各剂量组肿瘤抑制率分别达到17.46%、35.11%、55.22%,其以UA 中、高剂量组小鼠肿瘤的平均质量下降最为显著(P<0.05)。沙棘熊果酸高剂量组与低剂量组相比,肿瘤的平均质量均降低明显(P<0.05),与 CP 组比较,无显著性差异(P<0.05)。(见图1)

图1 各组H22肝癌小鼠移植瘤Fig.1 Transplantation tumor of H22 liver cancer mice in each dose group
表2 沙棘熊果酸对小鼠肿瘤的影响(±s,n=10)Table 2 Effect of seabuckthorn ursolic acid on tumor in mice(±s,n=10)

表2 沙棘熊果酸对小鼠肿瘤的影响(±s,n=10)Table 2 Effect of seabuckthorn ursolic acid on tumor in mice(±s,n=10)
注:与模型组相比,*P<0.05;与环磷酰胺组相比,#P<0.05;与高剂量组相比,▲P<0.05。
分组剂量/(mg/kg)瘤质量/g抑瘤率/%环磷酰胺组 25 1.18±0.46* 55.59模型组 2.65±1.11 UA 高剂量组 300 1.19±0.81* 55.22 UA 中剂量组 150 1.72±1.01* 35.11 UA 低剂量组 100 2.18±1.23#▲ 17.46
2.4 HE染色法观察瘤组织的病理形态学变化
HE 染色观察各组肿瘤组织病理学变化见图2。
HE 染色病理观察结果显示,模型组肿瘤细胞核体积相对较大,异型性明显且染色较深,胞质较多,间质较少,而沙棘熊果酸低、中、高剂量组及CP 组肿瘤细胞核相对较小,或破裂或固缩而深染,且相比模型组细胞间质明显增多。
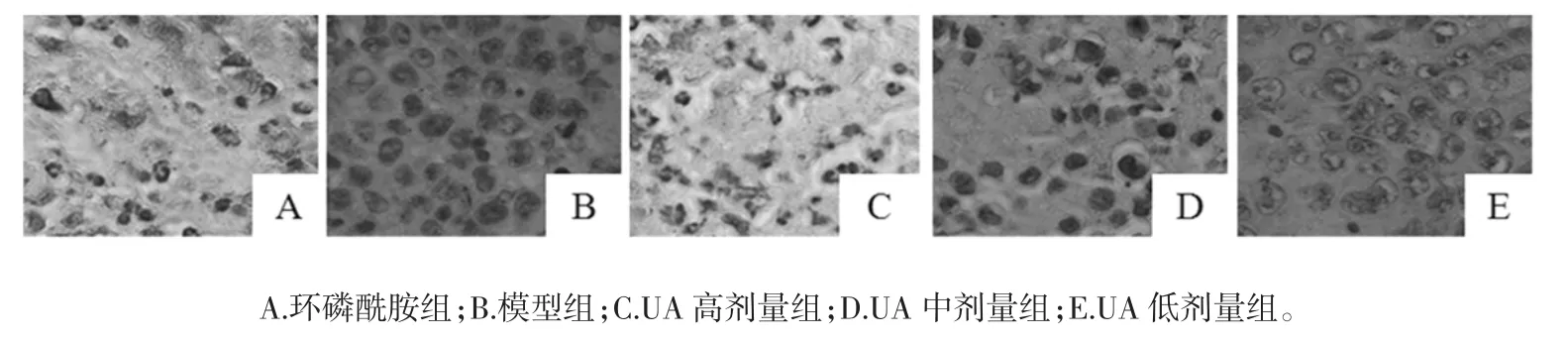
图2 HE染色观察各组肿瘤组织病理学变化(×400)Fig.2 Histopathological structure of tumor tissues at high magnification(×400)
2.5 沙棘熊果酸对小鼠瘤组织MMP-2的表达的影响
光镜观察结果显示MMP-2 在肿瘤细胞中大量表达,在胞浆中呈黄色到棕黄色颗粒着色。大都分布弥漫,定位于细胞质,少数细胞膜有阳性表达。(见图3)
由表3可知,与模型组相比,沙棘熊果酸低、中、高剂量组移植瘤组织中MMP-2 蛋白表达显著降低,故其平均灰度值显著偏高;且通过平均光密度值测定可知,UA 各剂量组MMP-2 平均光密度值较模型组显著降低(P<0.05)。
MMP-2 在各组瘤组织中的表达情况见图3,MMP-2 在各组瘤组织中的表达情况见表3。

图3 MMP-2在各组瘤组织中的表达情况(SABC,×400)Fig.3 MMP-2 positive expression in tumor tissue(SABC×400)
表3 沙棘熊果酸对瘤组织MMP-2表达的影响(±s,n=10)Table 3 Effect of seabuckthorn ursolic acid on MMP-2 expression in tumor tissues(±s,n=10)

表3 沙棘熊果酸对瘤组织MMP-2表达的影响(±s,n=10)Table 3 Effect of seabuckthorn ursolic acid on MMP-2 expression in tumor tissues(±s,n=10)
注:与模型组相比,*P<0.05。
分组 光密度值(A)平均灰度值环磷酰胺组 0.18±0.03* 161.67±15.82*模型组 0.32±0.06 117.79±16.51 UA 高剂量组 0.21±0.03* 157.99±10.72*UA 中剂量组 0.24±0.07 148.81±18.51*UA 低剂量组 0.25±0.028 146.59±9.71*
2.6 沙棘熊果酸对小鼠血浆中TNF-α和IL-12的影响
沙棘熊果酸对小鼠血浆中TNF-α 和IL-12 的影响见表4。
表4 沙棘熊果酸对小鼠血浆中TNF-α和IL-12的影响(±s,n=10)Table 4 Effect of seabuckthorn ursolic acid on TNF-α and IL-12 in mice plasma(±s,n=10)

表4 沙棘熊果酸对小鼠血浆中TNF-α和IL-12的影响(±s,n=10)Table 4 Effect of seabuckthorn ursolic acid on TNF-α and IL-12 in mice plasma(±s,n=10)
分组TNF-α 浓度/(pg/mL)IL-12 浓度/(pg/mL)环磷酰胺组 109.23±18.61* 265.64±87.93*模型组 72.82±33.74 177.00±60.26 UA 高剂量组 119.72±20.82* 309.70±91.94*
续表4 沙棘熊果酸对小鼠血浆中TNF-α和IL-12的影响(±s,n=10)Continue table 4 Effect of seabuckthorn ursolic acid on TNF-α and IL-12 in mice plasma(±s,n=10)

续表4 沙棘熊果酸对小鼠血浆中TNF-α和IL-12的影响(±s,n=10)Continue table 4 Effect of seabuckthorn ursolic acid on TNF-α and IL-12 in mice plasma(±s,n=10)
注:与模型组相比,*P<0.05;与高剂量组相比,#P<0.05。
分组TNF-α 浓度/(pg/mL)IL-12 浓度/(pg/mL)UA 中剂量组 100.00±31.64 261.90±108.53*UA 低剂量组 90.00±5.84# 216.72±72.70#
由表4可知,与模型组相比,沙棘熊果酸高剂量组和CP 组小鼠血浆中细胞因子TNF-α、IL-12 的浓度明显升高(P<0.05),且沙棘熊果酸高剂量组 TNF-α、IL-12 的浓度高于CP 组。
2.7 沙棘熊果酸对小鼠肿瘤组织VEGF与Ras蛋白表达的影响
沙棘熊果酸对VEGF、RAS 蛋白表达的影响见图4。
与模型组比较,沙棘熊果酸高、中剂量组肿瘤组织中VEGF、RAS 的蛋白表达量均明显降低(P<0.05;而沙棘熊果酸高剂量组VEGF、RAS 的表达水平显著低于中、低剂量组(P<0.05),但与 CP 组比较,无显著性差异(P>0.05)。

图4 沙棘熊果酸对VEGF、Ras蛋白表达的影响Fig.4 Effect of ursolic acid extracted fromhippophae rhamnoides L on expression level of VEGF and RAS
3 讨论
既往的研究发现,肿瘤的发生、发展与机体的免疫功能失调密切相关[7]。大量的临床和试验研究表明,大多数癌症患者免疫功能的抑制与癌细胞的增殖相一致,而目前用于治疗肝癌的化疗药物主要集中在攻击和杀死快速增殖的肝癌细胞,忽略了对机体免疫应答的影响[8],如临床常用治疗恶性肿瘤的广谱抗肿瘤药物——环磷酰胺,它对多种肿瘤都具有抑制作用,且效果显著,但有严重的免疫抑制作用,对机体的免疫系统造成危害[9]。本研究选择CP(25 mg/kg)为阳性对照组,印证了既往的研究,环磷酰胺具有良好的抑瘤效果,但在延长带瘤生存时间上不具优势,在CP 治疗过程中,小鼠的摄食量明显减少,与模型组相比,体重下降严重。相反,在3 种剂量的沙棘熊果酸给药没有改变小鼠的体重,并且它们显示正常的活动,能显著减轻荷瘤小鼠恶病质,恢复正常活动。脾脏作为机体重要的免疫器官,脾脏指数可反映机体免疫细胞的功能状态以及脾脏的发育情况[10]。当恶性肿瘤发生时,脾脏内的T 淋巴细胞和B 淋巴细胞分裂增殖释放细胞因子。细胞因子在机体内起到相互促进或相互抑制的作用,调节全身系统免疫,可作为判断机体免疫功能的重要指标[11]。IL-12 为细胞免疫应答过程中的关键调节因子,能刺激T 细胞及NK 细胞分泌TNF-α、IFN-γ 等细胞因子,增强机体细胞免疫反应,使机体有效的识别并清除肿瘤细胞[12]。而TNF-α 是迄今为止所发现的直接杀伤肿瘤作用最强的生物活性因子之一,具有抑制肿瘤细胞增殖、促进肿瘤细胞血管形成血栓而发生出血坏死、增强机体抗肿瘤免疫功能等作用[13]。本次研究发现,与CP 对照组相比,沙棘熊果酸各干预组脾脏指数、荷瘤鼠血浆IL-12、TNF-α 水平显著升高。并且,沙棘熊果酸在较好的抑制肝移植瘤的生长、缩小肿瘤细胞核体积、增加细胞间质的同时对肝、肾功能无毒副作用。综合各项指标提示沙棘熊果酸是一种安全、低毒的天然抗肿瘤活性物质,在改善荷瘤小鼠的一般状况的同时,增强机体的免疫功能。
肝癌的复发、转移是其预后较差的首要表现形式之一,也是致使其低生存率的重要原因。研究发现,肝癌对周围基质的降解是肿瘤生长、侵袭、转移的先决条件,其中MMP-2 发挥主要作用。MMP-2 是基质金属蛋白酶的一个亚型,可降解具有屏障作用的细胞外基质(ECM)以及Ⅳ型胶原,形成局部溶解构成肿瘤细胞移动的通道,在多种肿瘤的侵袭和转移过程中起关键作用[14]。通过检测大鼠肝细胞癌模型肿瘤组织及瘤旁组织MMP-2 发现此两部分均有表达,瘤组织的表达阳性率显著高于瘤旁组织,且有转移者的肿瘤组织阳性表达显著高于无转移者[15]。此外,另有学者发现VEGF 与MMP-2 在肿瘤病灶表达具有一致性[16]。VEGF 是最重要的肿瘤血管生成刺激因子,能诱导瘤旁正常血管形成新的毛细血管,促进肿瘤生长和肿瘤间质形成[17]。肝癌细胞和肝星状细胞通过旁分泌和自分泌产生大量VEGF,高释放的VEGF 为肝癌的快速增殖和转移提供条件。提示下调MMP-2、VEGF 在肝癌中的表达可能是治疗肝癌的潜在靶点。同时,Rak等[18]指出Ras 癌基因可以间接地推进肿瘤血管生成,促进肿瘤增殖。Ras 是首个被发现的人类原癌基因,其表达产物为 ras 蛋白(P21ras 蛋白/小 G 蛋白),有两种存在形式,即 Ras-GTP(活化状态)、Ras-GDP(非活化状态),可视作分子开关参与细胞外增殖及生长、分化等相关信号传递至细胞内过程[19]。当ras 基因被激活后,Ras 与GTP 持续性的结合,开关打开,活化的Ras 激活其下游效应蛋白,促使正常肝细胞向恶性转化,促进原发性肝癌的发生和发展。研究结果显示,沙棘熊果酸可剂量依赖性的抑制MMP-2、VEGF、RAS 的表达,提示沙棘熊果酸可能通过抑制肝癌细胞外基质降解、新生血管形成及肿瘤细胞的增殖等过程,从而抑制肝癌的增殖、侵袭和转移。
综上所述,沙棘熊果酸能够明显抑制肿瘤的生长,其抑制瘤机制可能与其提高机体免疫力,下调MMP-2、VEGF、RAS 的过表达有关。此外,与环磷酰胺相比,沙棘UA 无肝肾毒性及免疫抑制作用,其高效低毒的特性使其有望成为安全有效的新型抗癌药物。
