3-羟基丁酸对HeLa癌细胞生长与凋亡的影响*
2019-05-09苏佳佳邵邻相
苏佳佳, 曾 杰, 邵邻相
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
生酮饮食对人乳腺癌[1]、神经性母细胞瘤[2]、结肠癌[3]、前列腺癌[4]和胃癌[5]等肿瘤具有明显的治疗效果,通过逆转基因表达模式、降低活性氧的水平、抗血管生成和抗炎等作用抑制肿瘤生长,延长患癌动物生存时间[6-9].生酮饮食产生酮体,包括3-羟基丁酸、乙酰乙酸和丙酮等,其中起主要作用的成分是3-羟基丁酸.3-羟基丁酸能够诱导胰腺癌细胞凋亡[10],但3-羟基丁酸在细胞水平上抑制癌细胞增殖方面的研究报道甚少.
肿瘤细胞从胞外环境摄取的葡萄糖的量是正常细胞的十几倍[11].大量摄取葡萄糖为肿瘤细胞生长提供了充足的能量;糖尿病患者患癌风险比普通人高25%以上[1],患胰腺癌风险比普通人高5倍以上[12].因此,葡萄糖饥饿的癌症治疗方法受到人们广泛关注.实验室前期工作表明,碳源饥饿能抑制HeLa细胞的增殖与生长,诱导HeLa细胞的凋亡[13-16];并且HeLa癌细胞与人体脐带正常细胞在葡萄糖饥饿共培养条件下,HeLa癌细胞先于正常细胞凋亡,这为临床上饥饿疗法治疗肿瘤提供了理论依据.饥饿疗法或道家服气辟谷期间机体处于较低的血糖水平(空腹血糖),人体动用脂肪在肝脏产生酮体(如3-羟基丁酸),进入血液给机体细胞提供能量.为模拟人体环境,实验设计了相当于人体空腹血糖条件下,用3-羟基丁酸处理HeLa癌细胞和人脐带正常细胞共培养组作为对照组,观察3-羟基丁酸对人体正常细胞生长的影响.探讨了3-羟基丁酸抑制HeLa癌细胞生长的作用与诱导HeLa癌细胞凋亡的机制,为肿瘤的生酮饮食疗法和酮体疗法提供理论依据.
1 材料与方法
1.1 主要试剂与仪器
3-羟基丁酸为杭州昊天生物技术有限公司产品;caspase-3,Bim,Bad兔抗体,P27鼠抗体为Cell Signaling Technology公司产品;HRP-标记山羊抗兔IgG,HRP-标记山羊抗小鼠IgG,HRP-GAPDH-mAb为Bioworld Technology公司产品;其他常规试剂均为金华医药公司产品.
流式细胞仪为美国BD公司产品;半干转蛋白印迹系统为Bio-Rad公司产品;全自动化学发光成像分析系统为上海天能科技有限公司产品.
1.2 HeLa癌细胞培养和细胞活力检测
G25K0组:25 mmol/L葡萄糖+0 mmol/L 3-羟基丁酸组;G5K0组:5 mmol/L葡萄糖+0 mmol/L 3-羟基丁酸组;G5K25组:5 mmol/L葡萄糖+25mmol/L 3-羟基丁酸组;G25K25组:25 mmol/L葡萄糖+25 mmol/L 3-羟基丁酸组.HeLa癌细胞培养和细胞活力检测实验方法参照文献[15].
1.3 单细胞凝胶电泳检测 DNA 损伤
3-羟基丁酸处理HeLa癌细胞48 h,收集细胞.单细胞凝胶电泳实验方法参照文献[17].
1.4 流式细胞分析
3-羟基丁酸处理HeLa癌细胞48 h后,胰酶消化,离心,用PBS冲洗2遍,每组细胞加入1×Annexin V结合缓冲液,调整细胞密度为1×106个/mL,分别取400 μL重悬液加入到1.5 mL EP管中.G25K0组分别用单染(10 μL 20 μg/mL Annexin V),单染(5 μL 50 μg/mL PI),双染(10 μL Annexin V+5 μL PI),阴性空白染色(无Annexin V和 PI);实验组G25K25组双染(10 μL Annexin V+5 μL PI).室温避光孵育15 min后 ,1 h内完成流式细胞检测.数据采用Flow Jo 7.6软件进行处理.
1.5 Western Blot 检测蛋白表达
3-羟基丁酸处理HeLa癌细胞48 h后,收集细胞,提取总蛋白.Western Blot 检测实验方法参照文献[18].
1.6 统计分析
应用 SPSS 19.0软件进行单因素方差分析,以P<0.05为统计学显著性差异.
2 结 果
2.1 3-羟基丁酸对HeLa癌细胞活力的影响
为了检测3-羟基丁酸对HeLa癌细胞活力的影响,利用MTT法检测肿瘤细胞的生长,结果如表1所示:G5K0组,G5K25组和G25K25组3-羟基丁酸处理HeLa癌细胞后增殖抑制率,24 h时分别为10.2%,41.4%,1.2%;48 h时分别为28.8%,65.1%,12.6%;72 h时分别为51.2%,66.3%,17.8%.以上结果表明3-羟基丁酸能够降低HeLa癌细胞活力,且呈时间依赖性;在低葡萄糖条件下,3-羟基丁酸对抑制HeLa癌细胞活力的作用更明显(见表1).
2.2 AO/EB荧光染色检测3-羟基丁酸对HeLa癌细胞凋亡的影响

表1 3-羟基丁酸对HeLa癌细胞活力的影响
注:*P< 0.05为差异有显著性统计学意义,**P< 0.01为差异有极显著性统计学意义.
利用AO/EB荧光染色实验检测3-羟基丁酸对HeLa癌细胞凋亡程度的影响.G25K0组细胞利用AO/EB荧光染色实验检测3-羟基丁酸对HeLa癌细胞凋亡程度的影响.G25K0组细胞(见图1A)为分布均匀的绿色,细胞膜与细胞核完整,细胞呈多边形或梭形,边界清晰;G5K0组细胞(见图1B)大多数为分布均匀的绿色,仅有极少数细胞皱缩变圆,呈典型的早期凋亡特征;G5K25组细胞(见图1C)密度明显减小,大多数细胞收缩变圆,细胞为橘红色,出现凋亡小体,呈典型的晚期凋亡特征;G25K25组细胞(见图1D)密度明显减小,多数细胞呈椭圆形,少数细胞为淡橘色,出现凋亡小体,呈典型的中期凋亡特征.结果表明,3-羟基丁酸能够抑制HeLa癌细胞增殖,诱导HeLa癌细胞凋亡;在低葡萄糖条件下,3-羟基丁酸诱导HeLa癌细胞凋亡的作用更明显.

A:G25K0组;B:G5K0组;C:G5K25组;G25K25组
图1 AO/EB荧光染色检测3-羟基丁酸诱导HeLa癌细胞凋亡
2.3 3-羟基丁酸对HeLa癌细胞DNA的损伤
为了进一步探究3-羟基丁酸抑制肿瘤细胞生长的细胞生物学机制,采用单细胞凝胶电泳法检测肿瘤细胞DNA的受损情况.如图2所示,G25K0组细胞(见图2A)的彗星头荧光强,细胞核在电场的作用下仍较圆,极少彗尾形成,细胞核DNA保持完好未受到损伤;G5K0组细胞(见图2B)在电场的作用下,细胞核DNA有少量跑出,造成轻微的拖尾现象,彗星头大小不均一,细胞核DNA受到轻微的损伤;G5K25组细胞(见图2C)在电场作用下,彗星头明显缩小甚至消失,彗尾长,细胞核DNA受到严重损伤;G25K25组细胞(见图2D)在电场的作用下,分子量大小不等的DNA片段跑出细胞核,彗星头明显缩小,形成细长的彗尾,呈扇形散开,细胞核DNA受到损伤,但损伤程度低于G5K25组细胞.CASP彗星分析软件进行数据分析,结果如表2所示.与G25K0组相比较,G5K0组、G25K25组和G5K25组彗星头部DNA含量百分比(HDNA%)逐渐减少(P<0.01),尾部DNA含量百分比(TDNA%),彗星全长(CL),彗星尾长(TL),尾矩(TM)和Olive尾矩(OTM)都明显增多(P<0.05).
这些结果均表明,HeLa癌细胞经3-羟基丁酸处理后,细胞核DNA受到损伤,可能引起细胞凋亡的发生;在低葡萄糖条件下,HeLa癌细胞经3-羟基丁酸处理后,细胞核DNA损伤程度增加.
2.4 流式细胞仪检测3-羟基丁酸对HeLa癌细胞凋亡的影响
通过流式细胞凋亡实验检测3-羟基丁酸对HeLa癌细胞凋亡的影响,结果如图3所示.G25K0组与G25K25组的早期凋亡率分别为2.74%和24.80%;晚期凋亡率分别为1.79%和14.90%.因此,G25K25组细胞的早期凋亡率和晚期凋亡率均显著增加.


A:G25K0组;B:G5K0组;C:G5K25组;G25K25组图2 单细胞凝胶电泳检测DNA的损伤表2 单细胞凝胶电泳检测细胞DNA链断裂的各项指标
注:*P< 0.05为差异有显著性统计学意义,**P< 0.01为差异有极显著性统计学意义.

图3 流式细胞仪检测3-羟基丁酸对HeLa癌细胞凋亡的影响
2.5 Western Blot检测细胞凋亡相关蛋白的表达
Western Blot检测3-羟基丁酸对HeLa癌细胞凋亡相关蛋白的表达.结果表明,HeLa癌细胞经3-羟基丁酸处理48 h,与G25K0组相比,G25K25组、G5K0组和G5K25组caspase-3主带蛋白含量逐渐减少,灰度值分别减少10.63%,38.95%,52.04%,与G25K0组相比具有极显著性差异(P<0.01);G5K0组,G5K25组中促凋亡蛋白Bim表达量逐渐增多,G25K0组与G5K25组比较具有极显著性差异(P<0.01);与G25K0组相比,G25K25组、G5K0组和G5K25组Bad蛋白表达量均有增多,具有显著性差异(P<0.05)(见图4和表3).说明3-羟基丁酸可以通过caspase依赖性细胞凋亡途径诱导HeLa癌细胞凋亡.

图4 3-羟基丁酸处理后凋亡相关蛋白的表达量

表3 3-羟基丁酸对HeLa癌细胞蛋白表达的影响
注:*P< 0.05为差异有显著性统计学意义,**P< 0.01为差异有极显著性统计学意义.
2.6 3-羟基丁酸对共培养的HeLa癌细胞和人脐带正常细胞的影响
上述结果表明,3-羟基丁酸能够抑制HeLa癌细胞增殖,诱导细胞凋亡.为检测3-羟基丁酸对人体正常细胞的生长情况,设计了HeLa癌细胞和人脐带正常细胞共培养的实验.结果显示:G25K0组人脐带正常细胞和HeLa癌细胞为分布均匀的绿色荧光,细胞生长良好(见图5A1~A2).G5K0组人脐带正常细胞少数细胞收缩变圆为橘红色,半数细胞为绿色(见图5B1);而HeLa癌细胞多数细胞收缩变圆,为淡橘红色,呈典型的中期凋亡特征,仅有少数细胞为绿色(见图5B2).G5K25组人脐带正常细胞大多数细胞染色为分布均匀的绿色,仅少数细胞为橘红色,呈早期凋亡特征(见图5C1);而HeLa癌细胞密度明显降低,大多数细胞为橘红色,呈明显的晚期凋亡特征,仅有极少数细胞为不明显的绿色,表明细胞状态差,大部分细胞已凋亡(见图5C2).G25K25组人脐带正常细胞为分布均匀的绿色荧光,极少数细胞为橘红色(见图5D1);而HeLa癌细胞密度减少,一些细胞为不明显的绿色荧光,一些细胞为橘红色,表明细胞状态差,部分细胞已凋亡(见图5D2).结果表明,在共培养条件下,3-羟基丁酸诱导HeLa癌细胞先于人脐带正常细胞凋亡.
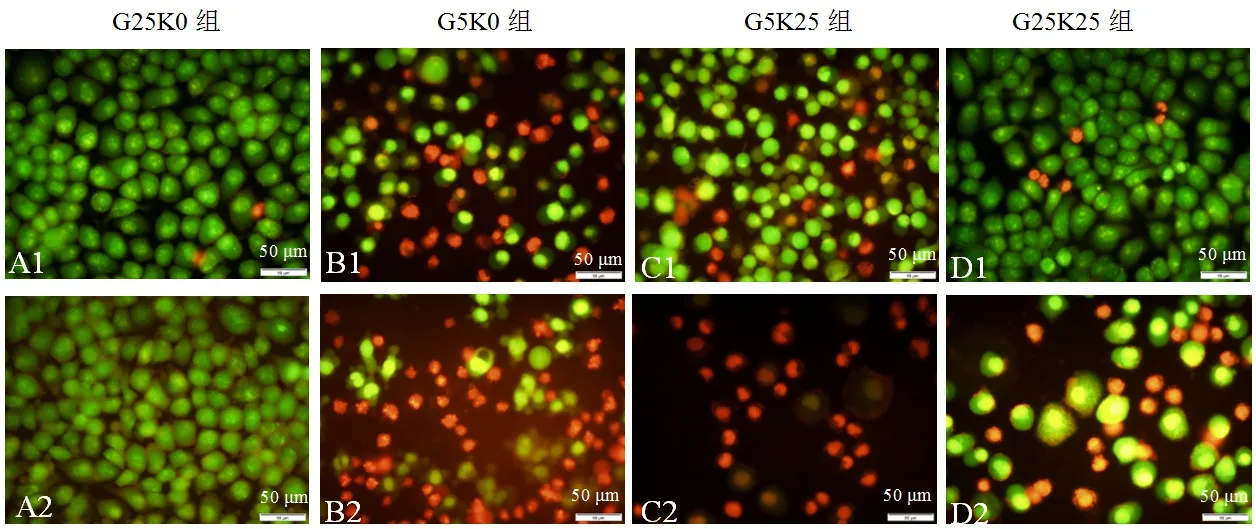
A1~A4:人脐带正常细胞;B1~B4:HeLa癌细胞
图5 AO/EB荧光染色检测3-羟基丁酸对共培养的HeLa癌细胞和人脐带正常细胞的影响
3 讨 论
恶性肿瘤的发生与能量代谢异常密切相关.正常细胞可以利用葡萄糖、脂肪酸和酮体提供能量;肿瘤细胞在有氧条件下以糖酵解作为主要产能方式[19],并且肿瘤细胞线粒体缺乏利用酮体供能的一种或多种关键酶,从而导致肿瘤细胞更依赖葡萄糖供能且不能利用酮体供能[19-20].
生酮饮食是一种由高比例脂肪、适量蛋白质、低碳水化合物及其他营养素组成的饮食.生酮饮食中脂肪含量占70%以上,在体内分解产生3-羟基丁酸.生酮饮食中起主要作用的成分是3-羟基丁酸.
用3-羟基丁酸处理HeLa细胞后,MTT检测表明,3-羟基丁酸能够降低HeLa癌细胞活力;AO/EB荧光染色、单细胞凝胶电泳和流式细胞仪检测都表明,3-羟基丁酸能够抑制HeLa癌细胞增殖,诱导HeLa癌细胞凋亡.Shukla等[10]用3-羟基丁酸处理人胰腺癌细胞,研究表明,3-羟基丁酸能够抑制胰腺癌细胞增殖,诱导细胞凋亡.该实验结果与Shukla等[10]研究结果一致.
促凋亡蛋白Bim从微管蛋白复合体上释放出来并移位于线粒体外膜,促凋亡蛋白Bad位于胞质,移位并插入线粒体外膜;Bim和Bad最终通过caspase-3依赖的细胞有丝分裂障碍而诱导细胞凋亡.3-羟基丁酸处理HeLa癌细胞后与G25K0组相比,G5K25组Bim蛋白表达上调41.23%;G25K25组、G5K0组和G5K25组Bad蛋白表达分别上调36.19%,140.95%,119.52%(见表3),从而诱导HeLa癌细胞凋亡.在细胞凋亡启动时,caspase-3需要从没有活性的全长caspase-3(35 kD)被剪切成17 kD的肽段而被激活;3-羟基丁酸处理HeLa癌细胞后与G25K0组相比,G25K25组,G5K0组和G5K25组caspase-3主带蛋白含量分别减少10.63%,38.95%,52.04%,说明caspase-3蛋白主带(35 kD)发生剪切而被激活,从而诱导HeLa癌细胞凋亡.综上所述,3-羟基丁酸可以通过caspase依赖性细胞凋亡途径诱导HeLa癌细胞凋亡.
癌症患者体内癌细胞数量占比少,而正常细胞数量占绝大多数.虽然3-羟基丁酸能够抑制HeLa癌细胞增殖,诱导细胞凋亡.但是3-羟基丁酸对人体正常细胞是否会产生副作用,由此进行了HeLa癌细胞和人脐带正常细胞共培养的验证实验.在共培养条件下,HeLa癌细胞组与人脐带正常细胞组相比,细胞密度减少、生长状态差、活力降低,HeLa癌细胞先于人脐带正常细胞凋亡.以上结果为癌症治疗提供了一个有益的治疗靶向,通过这一靶向作用既可以诱导肿瘤细胞的凋亡,又能较少损伤正常的健康组织,为肿瘤的生酮饮食疗法和酮体疗法提供理论依据.这也为饥饿疗法或道家服气辟谷(较低空腹血糖,较高的3-羟基丁酸)治疗肿瘤提供了理论上的依据.
