白光衍射相位成像应用于生物活细胞定量相位成像的研究*
2019-05-09张佳恒马利红应朝福
张佳恒, 马利红, 应朝福
(浙江师范大学 信息光学研究所,浙江 金华 321004)
0 引 言
由于生物细胞的细胞质和大部分细胞器的光学吸收系数很小,几乎无色透明,因此,传统明场显微图像通常对比度很低,很难观察到有用的细胞细节.生物细胞结构特征及各组分不同的折射率分布对于入射光波最直接的影响就是产生不同的相位延迟,即相移.泽尼克相衬显微[1]与微分干涉相衬显微技术[2]作为最常用的相位成像方法,可将相移差异转换为图像的强度对比,大大提高了细胞等弱吸收样品的图像衬度.但是这2种方法只是将相移分布定性地转化成了图像的强度分布,不能用于细胞的定量测量.随着生命科学与生物医学研究的不断深入,生物学家们也越来越意识到定量测量细胞和组织中的相位分布特性对于细胞显微观察、结构信息提取及动力学行为研究的重要性.因此,定量相位显微技术的产生与发展已成为必然趋势.
白光衍射定量相位显微术[3-5]是一种基于白光干涉的定量相位成像技术,可以精确地获取样品的高分辨率相位信息.该技术具有独特的优势:从光源上看,采用白光作为照明光源,其相干长度非常短,小于1 μm,因此,可以避免由光源强相干性产生的相干噪声及寄生条纹噪声[6-7];从结构上看,采用共路结构,由于其物光和参考光共路的特性,具有结构稳定、抗干扰能力强的优点[8-10];从记录方式上看,利用光栅衍射与4f系统实现离轴记录,具有离轴干涉成像的优势,可以从单张干涉图获取物体相位信息,实时记录细胞的动态变化过程.因此,白光衍射定量相位显微术已得到广泛的研究与关注.
为了实现生物活体细胞的高分辨率定量相位成像,笔者设计并组建了一套倒置式白光衍射显微相位成像系统.系统的空间成像噪声低于0.60 nm,时间成像噪声低于0.04 nm.首先用标准样品验证了系统测量的准确性;然后以活体血红细胞与大肠杆菌细胞为样品,获得了准确的定量相位像;最后对霉菌孢子进行了长时间的成像记录,获得了其在水中萌发的动态定量相位像.实验结果表明,系统成像精度高,且具有长时间观察生物活细胞的能力.
1 白光衍射显微相位成像基本原理
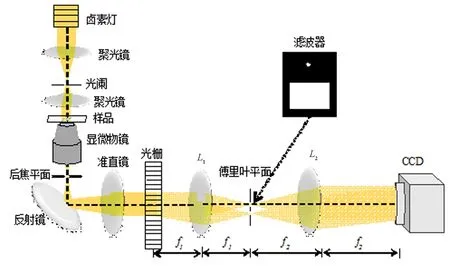
图1 白光衍射显微相位成像系统光路原理图
组建的白光衍射显微相位成像系统的光路原理如图1所示,它是在倒置式明场光学显微镜的基础上附加了一个4f结构光学模块.系统照明光源是卤素灯白光光源,采用科勒照明光路,并将显微镜照明数值孔径设置到最小,以获得部分空间相干光,使之满足干涉条件.被测样品被近似平面光波场照明,并通过显微物镜显微放大成像.在它的像平面放置一块黑白光栅以产生多级衍射光,每一级光均包含了物体的全部空间信息.通过透镜L1对衍射光波场进行傅里叶变换,在透镜的焦平面可以得到各级频谱分布.在该频谱面放置一个如图1所示的滤波器,其中针孔滤波器对0级光进行低通滤波,使直流信息通过,作为参考光波场;+1级滤波器让+1级光全部通过,从而得到完整的物光场信息.最后通过透镜L2进行逆傅里叶变换,在CCD像平面,物光场和参考光场干涉形成离轴干涉图.透镜L1和透镜L2形成一个4f结构的马赫-曾德干涉仪.
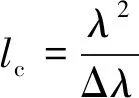
被测样品的频带受显微物镜衍射限制,在CCD 平面其最高频率β为
(1)
式(1)中:k0=2π/λ0;λ0表示中心波长,574 nm;NAobj表示显微物镜数值孔径;Mobj表示显微物镜放大倍数;M4f表示4f结构横向放大倍数.基于离轴干涉图的三项分离原则,光栅调制得到的参考光载频至少为样品最高频率的3倍才能避免混频.这样,在CCD平面上,干涉信号的最高频率至少为4β.同时为了满足Nyquist采样定理,CCD像素采样频率必须大于等于8β.系统中各光学元件的选择要求如参考文献[11].本系统采用的显微物镜为40x/0.75,因此,系统的横向分辨率达到0.765 μm;光栅常数为7.500 μm;4f结构横向放大倍率M4f= 3.0;CCD相机像元间距a=3.45 μm×3.45 μm,像素数为2 248×2 048,可根据需要选择成像区域的大小.
在CCD记录面,假设物光波为Uo,参考光波为Ur,则可以得到干涉场的强度分布为
I(x,y)= |Uo(x,y)+Ur(x,y)|2=
(2)
对记录的干涉图作傅里叶变换,得到0级、±1级分离的频谱图,通过滤波操作,滤除0级和-1级频谱,并将+1级移至中心,再作逆傅里叶变换,由于记录的是像面干涉图,直接得到物光波的复数场U(x,y).由该复数场得到相位分布:
(3)
式(3)中:Re表示取复振幅的实部;Im表示取虚部.但是,由反正切计算得到的相位值分布区间([-π,π] )是包裹相位值.因此,一般情况下,要得到物体的真实相位分布还通常需要利用二维解包裹算法得到展开的相位分布.本文采用基于离散余弦变换(DCT)的最小二乘相位解包裹算法[12],并为了消除由参考光波、显微物镜成像、系统像差及各种背景噪声引起的附加相位因子,采用减去参考平面相位的方法进行相位补偿[13].
2 系统成像准确度和噪声测量
首先测量了系统的相位成像准确性,选用标准聚苯乙烯微球作为被测样品进行成像测量.微球直径为(2±5%) μm,折射率为1.59.取少量微球散落于载波片,滴入显微物镜浸油(折射率为1.518)浸没微球,并盖上盖波片.将此标准样品放入载物台,进行调焦,使之成像于CCD相机平面.记录的干涉图如图2(a)所示,图2(b)是2(a)矩形框所选部分的放大图,图2(c)是干涉图2(a)的频谱图.移除样品,记录参考干涉图.对样品干涉图和参考干涉图分别进行数据处理,得到展开相位分布,并进行相位相减,得到相位像,如图2(d)所示.利用已知的微球折射率和浸油折射率,由测量的相位分布可以计算得到微球形貌,如图2(e)所示.图2(f)是沿图2(d)中所画过微球中心直线的微球厚度分布截线图,证实了组建的白光衍射显微相位成像系统具有准确的定量相位成像性能.
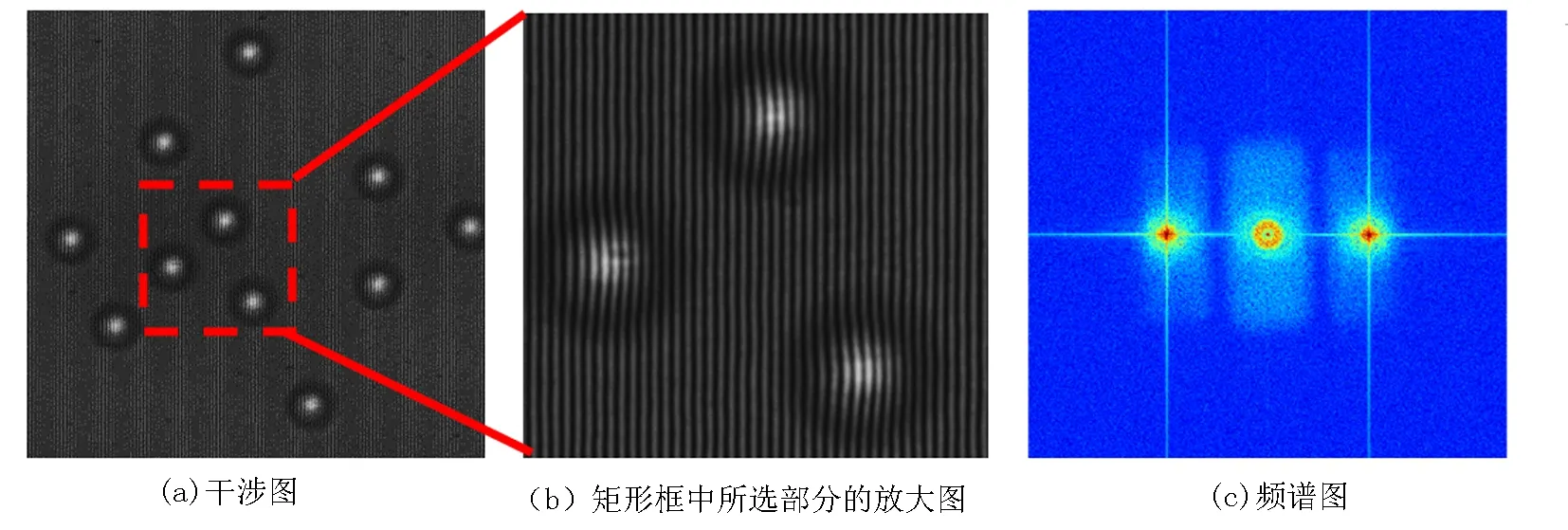
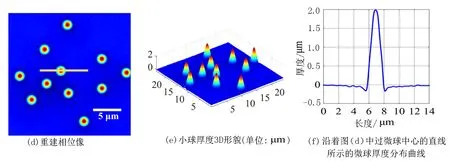
图2 标准聚苯乙烯微球实验结果
同时测量了系统的时空噪声.时空噪声是测量系统的一个重要参数,直接影响系统的测量敏感度,即决定系统能够测量的最小光程变化.在移除样品的情况下,以20 帧/s的速度记录了257 张干涉图,像素数为1 024×1 024.将第1帧干涉图作为参考干涉图,对所有的干涉图作数据处理,得到256 张相位图.利用相位和光程的关系,继而得到256张光程分布图.对任一张光程分布图求均方差,得到空间噪声均低于0.60 nm.对所有256张光程分布图作时间堆积,然后做空间均方差,得到时间噪声,时间噪声小于0.04 nm.因此,该系统具有很高的时空敏感度.
3 活体生物细胞相位成像
3.1 血红细胞相位成像
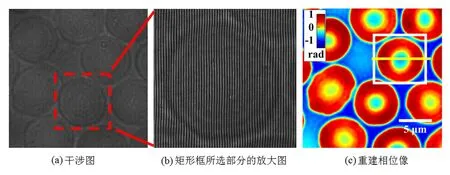
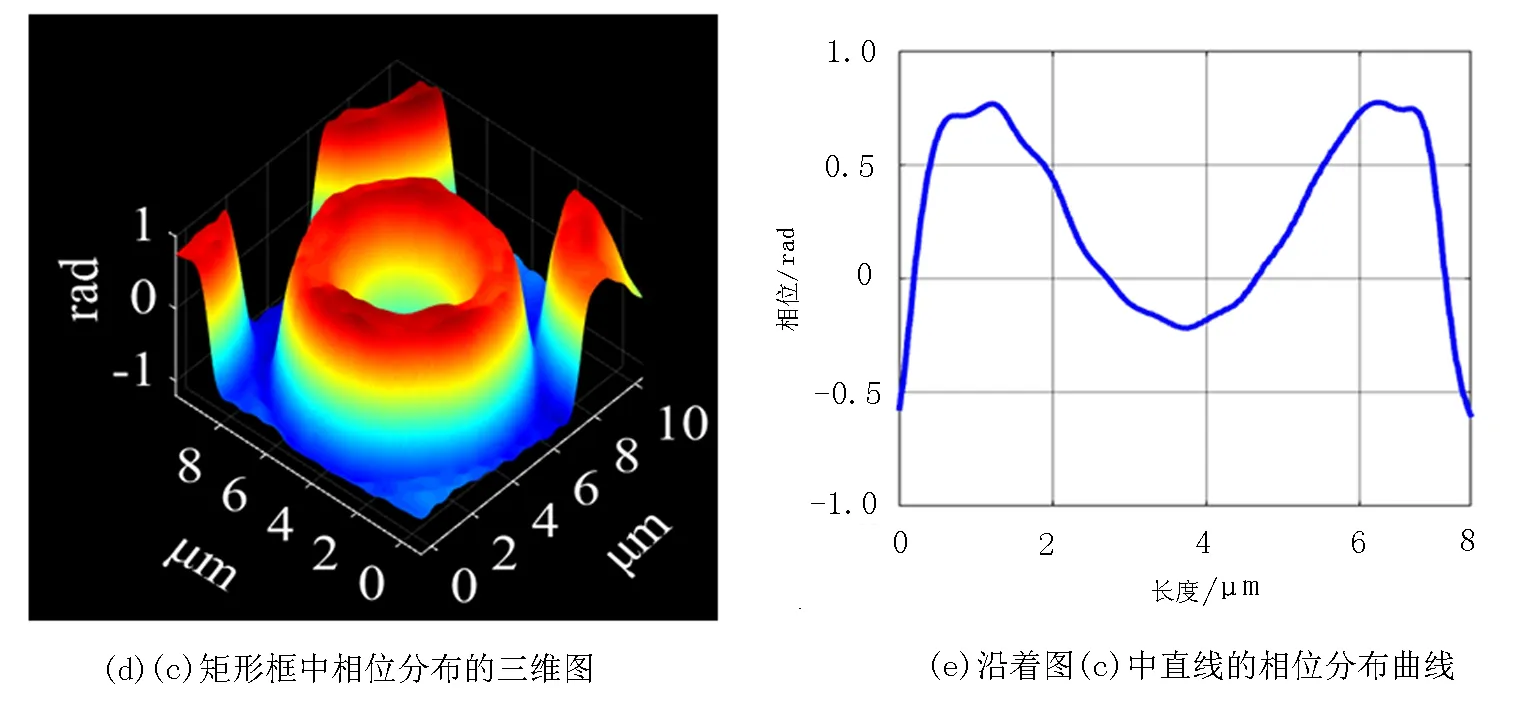
图3 血红细胞相位成像
血红细胞作为血液中个数最多的血细胞,具有运输氧气与二氧化碳的功能.血红细胞形态和动态特性的研究和检测,对临床诊断和病理研究具有重要意义.正常成熟的人血红细胞(直径只有6~8 μm)是“甜甜圈”型,中间下凹,边缘较厚,并且没有细胞核等细胞器,富含血红蛋白.从实验室健康成年男性指尖取少许血液,滴入质量浓度为0.9%的生理盐水中,保证血红细胞的活性和正常生理活动.用移液管取1 μL的溶液,滴到载玻片上,并盖上盖玻片,制作成样品.将样品放到载物台上,并待血红细胞粘滞到载玻片上后,对血红细胞聚焦成像.图3(a)为记录的干涉图,图3(b)是3(a)矩形框所选部分的放大图.移除样品,记录参考干涉图.对样品干涉图和参考干涉图分别进行数据处理得到展开相位分布,并进行相位相减,得到相位像,如图3(c)所示.图3(d)是3(c)矩形框中单个血红细胞相位分布的三维图.图3(e)是沿着图3(c)中过血红细胞中心的直线所示的血红细胞相位分布曲线.
3.2 大肠杆菌相位成像
大肠杆菌是人和许多动物肠道中最主要且数量最多的一种细菌,其结构成杆状,分裂方式为二分分裂.取微量大肠杆菌扩散在水中,用移液管取1 μL的溶液,滴在载玻片上,并盖上盖玻片,制作成样品.图 4(a)为大肠杆菌干涉图,图4(b)是4(a)矩形框所选部分的放大图.移除样品,记录参考干涉图.对样品干涉图和参考干涉图分别进行数据处理得到展开相位分布,并进行相位相减,得到相位像,如图4(c) 所示.图 4(d)是4(c)矩形框 1 中单个大肠杆菌的相位分布放大图,该大肠杆菌未开始分裂.图4(e)是4(c)矩形框 2 中单个大肠杆菌的相位分布放大图,该大肠杆菌已明显地处于二分裂状态.
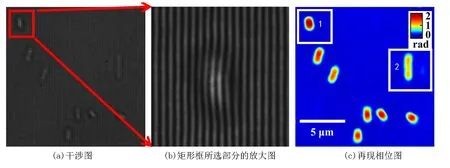
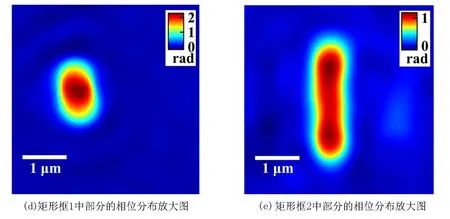
图4 大肠杆菌相位成像
3.3 生物细胞时间序列相位成像
霉菌繁殖迅速,常造成食品及用具的大量霉腐变质,但也有许多有益种类,如红曲霉便是有益种类中的一种.红曲霉能产生大量的天然红色素,并能产生有益降胆固醇、降血压等物质,因而已受到研究者的广泛关注.红曲霉孢子呈球形或椭圆形,大小为(6.5~10.5) μm× (7.0~9.0) μm.取微量红曲霉孢子扩散在水中,用移液管取1 μL的溶液,滴在载玻片上,并盖上盖玻片,制作成样品,在室温(25 ℃左右)下长时间观察.首先在不放置样品时,记录一张干涉图,作为参考干涉图.然后放入样品,每间隔5 min记录一张干涉图,连续记录24 h.图5是某孢子开始萌发后每隔15 min的重建相位像序列,可以看到孢子的萌发过程,正在形成孢子管.证明了该系统具有连续稳定的获取生物细胞定量相位像的能力.
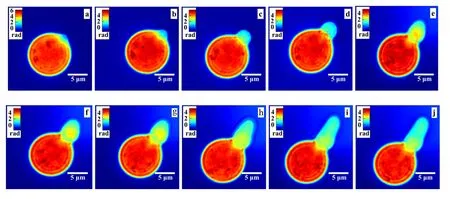
图 5 孢子萌发的动态相位像序列
4 结 论
构建了基于白光衍射的定量显微相位成像系统,并进行了生物活体细胞的成像研究.结果表明,该系统可以很好地应用于生物细胞的定量相位成像,尤其是该系统采用的白光照明,对生物细胞没有任何的损伤,适用于长期的生物活体细胞探测.因此,该系统在生物细胞定量测量方面很有优势,为活体细胞的动态研究提供了一种很有效的手段,期望为早期医学诊断和药物研发等提供一定的分析评价依据.
