Wnt7a蛋白在胃癌组织中的表达及其与预后的关系
2019-05-09刘博赵建国夏爱辉唐晶刘洋李永峰刘俊
刘博,赵建国,夏爱辉,唐晶,刘洋,李永峰,刘俊
(华中科技大学同济医学院附属协和医院 胃肠外科,湖北 武汉 430022)
胃癌是常见的恶性肿瘤之一,在癌症相关病死率中排第3位[1-2]。胃癌患者在发现时往往已是晚期,导致预后不佳[3]。由Wnt家族分泌的糖蛋白触发的信号通路在进化上相对保守,参与细胞增殖、分化调控[4]。Wnt7a是Wnt家族的一员,广泛表达于人体各种器官,包括肺、睾丸、淋巴结和脑等[5]。Wnt7a与肿瘤的关系已有报道,如肿瘤细胞分泌的Wnt7a能招募并激活肿瘤相关成纤维细胞营造适合肿瘤生长的微环境,从而促进肿瘤生长及恶性进展[6]。Wnt7a能够激活Wnt信号通路,导致β-连环蛋白(β-catenin)入核增加,从而促进膀胱癌细胞侵袭转移[7]。在子宫内膜癌中,Wnt7a高表达于肿瘤组织中,并与临床分期、淋巴结转移和血管浸润等恶性表型密切相关,高表达Wnt7a的子宫内膜癌患者更易复发,生存预后更差[8]。与之相反,Wnt7a的抑癌功能在其他肿瘤中也有报道,如在雌激素受体阳性的乳腺癌中,多因素分析发现Wnt7a低表达与乳腺癌患者预后差相关[9]。然而,Wnt7a在胃癌中的表达及与临床病理参数间的关系并不清楚。本文通过检测Wnt7a在胃癌组织中的表达,分析Wnt7a表达与胃癌患者临床病理因素间的关系及对预后的影响。
1 材料与方法
1.1 标本来源
收集2009年1月—2014年12月在华中科技大学附属协和医院行胃癌根治术后标本135例,其中乳头状腺癌75例,管状腺癌45例,低分化腺癌15例。纳入标准:⑴ 术前未经放化疗治疗;⑵ 行胃癌根治性切除术,并经病理医师确诊;⑶ 有详细完整的病例及随访资料。剔除标准:⑴ 临床病例或随访资料不全者;⑵ 合并其他肿瘤者。随访时间截止至2018年3月,共得到胃癌标本135例,分别做成石蜡标本,并保存于-80 ℃冰箱备用。
1.2 主要试剂
总蛋白提取试剂试剂盒、BCA蛋白浓度测定试剂盒均购于上海碧云天生物技术有限公司。SDS-PAGE凝胶配制试剂盒、特超敏ECL化学发光试剂盒、山羊抗小鼠HRP偶联标记的二抗、GAPDH小鼠抗人单克隆抗体均购于成都正能生物技术有限公司;Wnt7a小鼠抗人单克隆抗体购自美国Santa Cruz公司;即用型免疫组化MaxVisionTM试剂盒购自福州迈新生物技术有限公司。
1.3 Western blot法
组织蛋白提取采用总蛋白提取试剂盒按说明书进行。按取0.1 g冻存的组织标本经研磨后加入0.5 mL裂解液(加蛋白酶抑制剂)行冰上裂解1 h,4 h液(加蛋白酶抑离心10 min),吸取上清得到总蛋白提取液。BCA法测定蛋白浓度,将样品作适当稀释后加20 μL到96孔板的样品孔中,各孔加入200 μL样品孔中,各工作液,37 ℃放置1 h。用酶标仪测定A562 nm吸光度,根据标准曲线计算出蛋白浓度。取30 µg蛋白样品加入等体积2×电泳加样缓冲液煮沸10 min。经10%浓度的SDS-PAGE凝胶电泳分离,电泳转印到PVDF膜。5%脱脂奶粉封闭30 min,加入一抗Wnt7a(1:300)或者GAPDH(1:500)4 ℃过夜孵育,PBST漂洗3次。室温孵育HRP标记的二抗(1:1 000)2 h,漂洗3次,采用ECL化学发光试剂盒显影蛋白条带。
1.4 免疫组化
免疫组化实验步骤按免疫组化试剂盒步骤进行。石蜡切片于65 ℃烘片2 h,二甲苯和酒精常规脱蜡至水。3%双氧水灭活内源性过氧化物酶30 min。柠檬酸钠缓冲液微波加热至沸腾抗原修复5 min,漂洗3次。5%山羊血清封闭30 min后去除多余液体,加Wnt7a一抗(1:200)4 ℃孵育过夜,漂洗3次。加二抗(1:500)室温孵育1 h,漂洗3次。DAB显色试剂显色,当目标蛋白出现棕黄色时自来水终止反应,苏木素复染细胞核。根据显色深浅及阳性细胞百分比分级,Wnt7a表达强度采用组织学评分(阳性细胞百分比:0为没有细胞显色或阳性细胞百分数<5%;1为5%~35%细胞显色;2为36%~65%细胞显色;3代表>66%细胞显色。表细胞染色强度:0为不显色;1为浅黄色;2为棕黄色;3为深褐色。总分≥深分为高表达组,<5分为低表达组)。
1.5 统计学处理
采用SPSS 20.0统计软件。实验数据以均数±标准差(±s)表示,统计处理采用独立t检验对组间进行比较;计数资料采用χ2检验。患者总生存率和无瘤生存率均采用Kaplan-Meier分析,单因素和多因素分析采用Cox回归模型,统计显著性以P<0.05为标准。
2 结 果
2.1 Western blot检测结果
Western blot结果显示,胃癌组织中的Wnt7a蛋白表达量在明显高于癌旁组织(图1)。
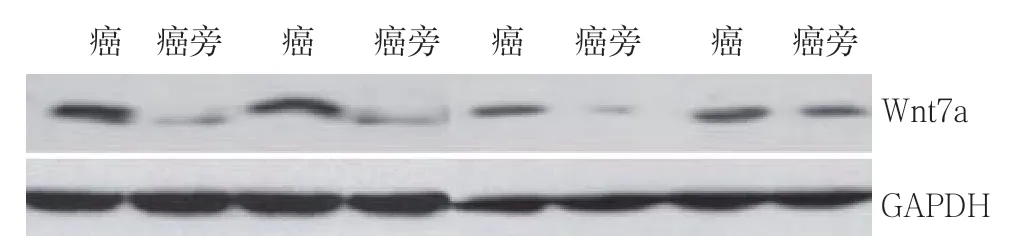
图1 Western blot检测Wnt7a蛋白表达Figure 1 Determination of Wnt7a protein expression by Western blot
2.2 免疫组化检测结果
Wnt7a低表达于癌旁组织中,染色强度较浅(图2A);Wnt7a在胃癌组织中染色强度深,同时在胃癌组织中Wnt7a的表达也存在差异,部分胃癌组织中低表达Wnt7a(图2B),部分胃癌组织高表达Wnt7a,染色强度深,主要定位在细胞质,胞外也着色(图2C)。胃癌组织Wnt7a低表达40例(29.6%),高表达95例(70.4%), 癌旁组织Wnt7a低表达130例(96.3%),高表达5例(3.7%),两者差异有统计学意义(χ2=30.5,P=0.00)。

图2 免疫组化检测Wnt7a蛋白表达(×100)Figure 2 Immunohistochemical staining for Wnt7a protein expressions (×100)
2.3 Wnt7a表达与胃癌患者临床病理特征的关系
统计分析结果显示,Wnt7a表达水平与胃癌患者性别、年龄、HP感染、分化程度和Lauren分型无明显关系(均P>0.05),而与胃癌患者TNM分期、远处转移和淋巴结转移明显有关(均P<0.05)(表1)。
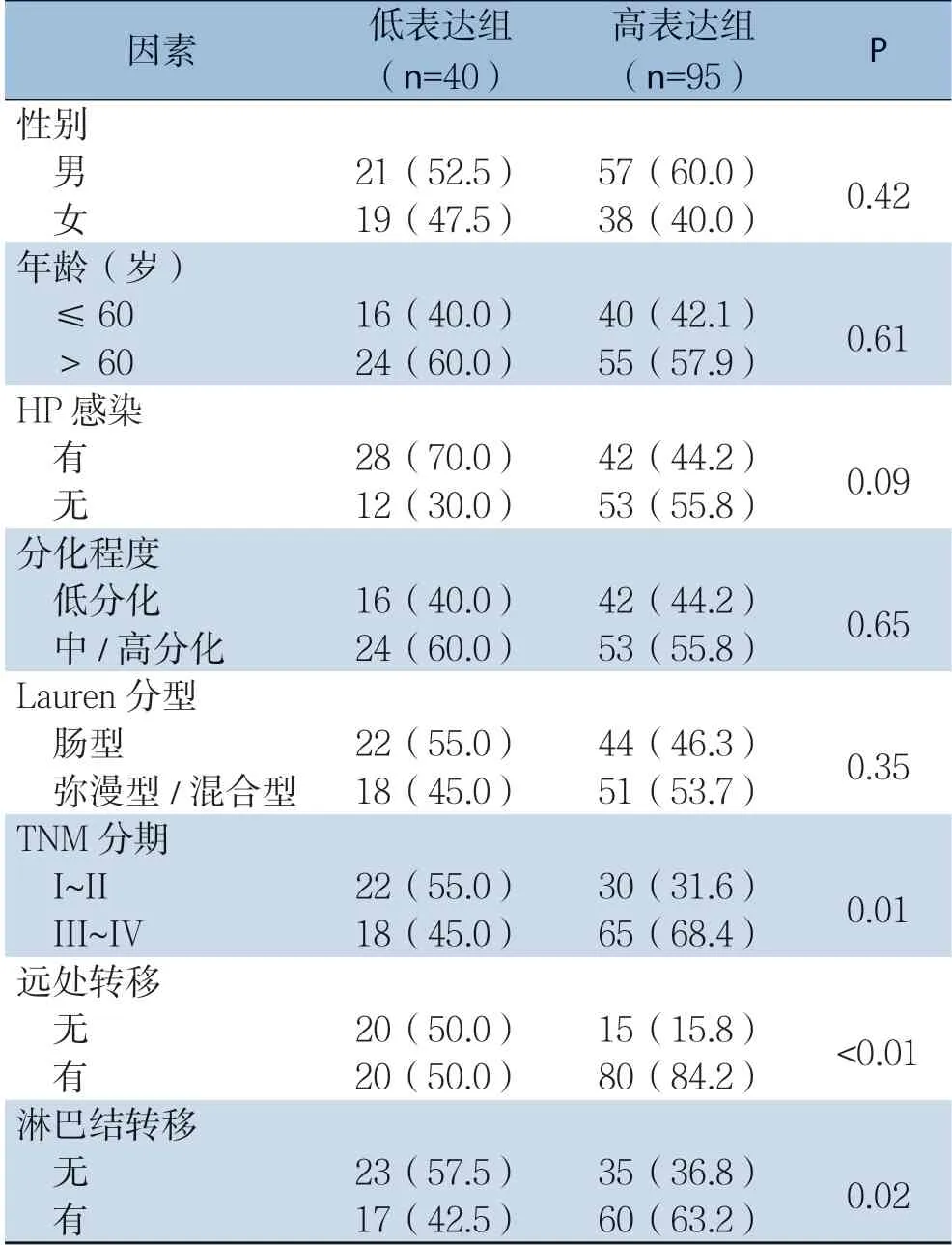
表1 Wnt7a表达与胃癌患者临床病理因素的关系Table 1 The relations of Wnt7a expression with clinicopathologic characteristics in gastric cancer patients
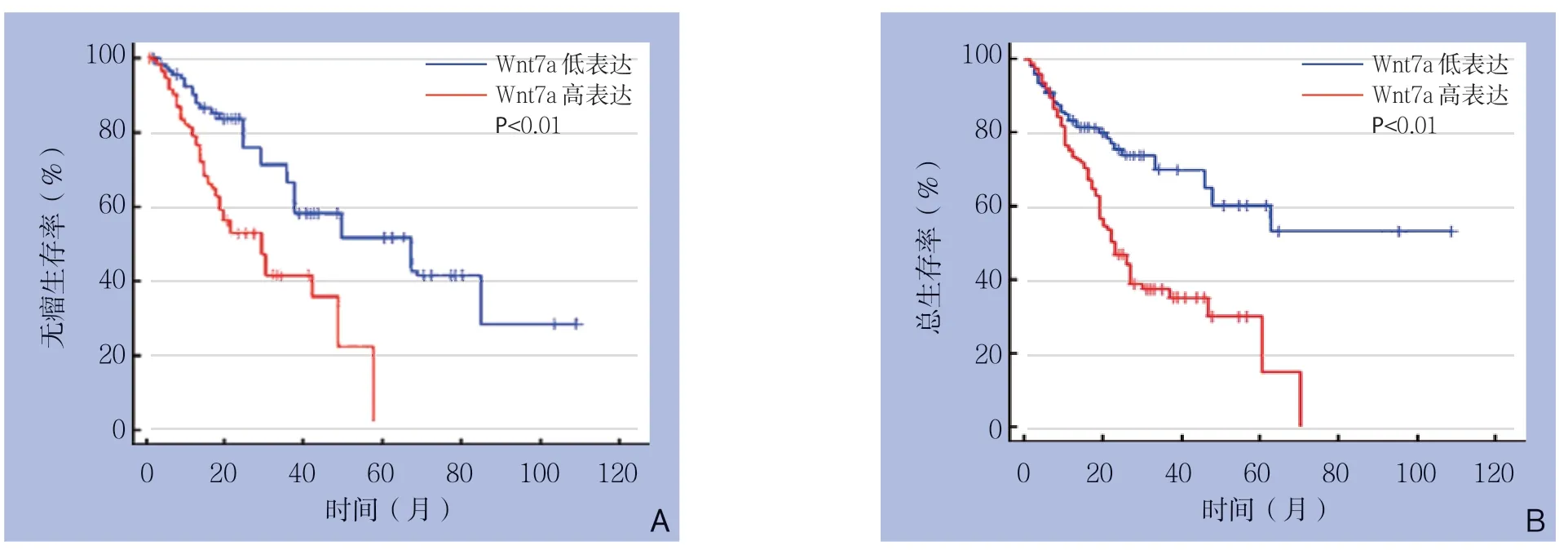
图3 Wnt7a高低表达组与低表达组生存曲线Figure 3 The survival curves of groups of Wnt7a high and low expression
2.4 Wnt7a表达水平与胃癌患者无瘤生存率和总生存率的关系
Wnt7a高表达组1年无瘤生存率为70.5%,Wnt7a低表达组为83.6%;Wnt7a高表达组5年无瘤生存率为3.6%,Wnt7a低表达组为47.4%,Wnt7a高表达组1、5年无瘤生存率低于Wnt7a低表达组(均P<0.01)(图3A);Wnt7a高表达组1年总生存率为78.1%,Wnt7a低表达组为85.1%;Wnt7a高表达组5年总生存率为17.2%,Wnt7a低表达组为60.9%,Wnt7a高表达组1、5年总生存率低于Wnt7a低表达组(均P<0.01)(图3B)。
2.5 影响胃癌患者无瘤生存率的危险因素
单因素分析示:TNM分期(P=0.01)、远处转移(P<0.01)、淋巴结转移(P=0.04)及Wnt7a表达(P=0.02)为影响胃癌患者无瘤生存率的因 素,多因素分析示:远处转移(P=0.02)及Wnt7a表达(P=0.01)为影响胃癌患者无瘤生存率的独立危险因素(表2)。
2.6 影响胃癌患者总生存率的危险因素分析
单因素分析示:TNM分期(P=0.04)、远处转移(P<0.01)及Wnt7a表达(P<0.01)为影响胃癌患者总生存率的因素,多因素分析示:TNM分期(P=0.03)、远处转移(P<0.01)及Wnt7a表达(P=0.02)为影响胃癌患者总生存率的独立危险因素(表3)。
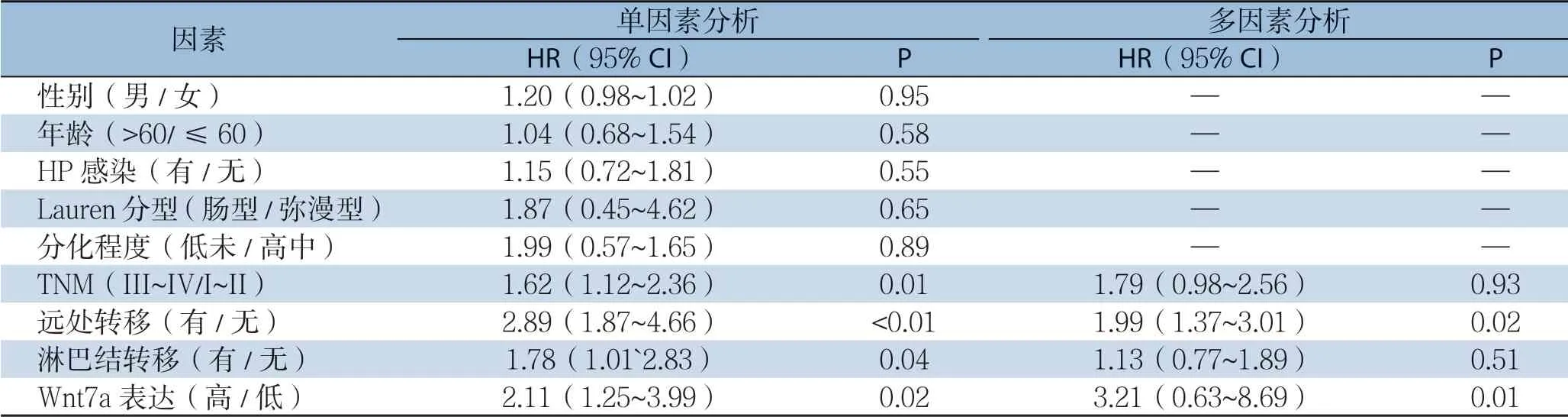
表2 单因素及多因素分析胃癌患者无瘤生存相关危险因素Table 2 The risk factors for disease-free survival analyzed by univariate and multivariate analyses
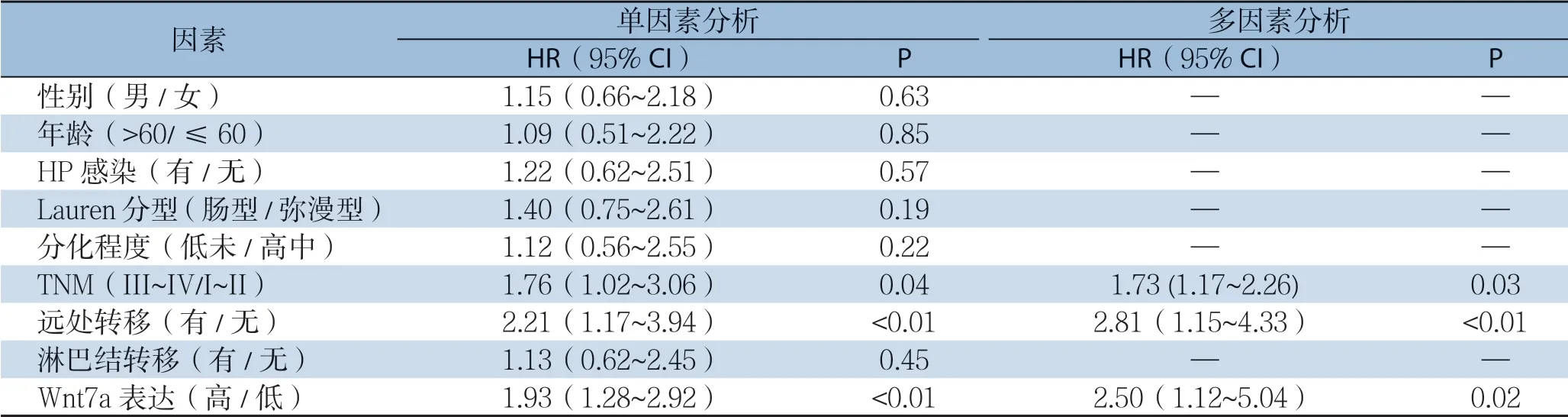
表3 单因素及多因素分析胃癌患者总生存相关危险因素Table 3 The risk factors for overall survival analyzed by univariate and multivariate analyses
3 讨 论
胃癌是常见的恶性肿瘤之一,每年约有100万例新胃癌病例被确诊,约70万例死亡,占全球癌症相关病死率的10%,已经构成严重的公共卫生安全问题[2]。胃癌的无进展生存和预后高度依赖于胃癌的早期诊断,其高病死率与缺乏标准筛查和早期症状缺乏相关。因此,胃癌早期诊断生物标志物的鉴定对治疗胃癌至关重要。
Wnt信号通路家族成员是由WNT基因编码一类高度保守的分泌型糖蛋白,通过与卷曲受体结合,调控细胞死亡、增殖、分化[10]。Wnt7a已被证实在多种生物学过程中发挥重要作用,如再生[11]、干细胞扩增[12]及恶性转变[13]等。Wnt7a在不同肿瘤中的表达状态存在较大差异。在子宫内膜癌中发现Wnt7a与肿瘤患者的总生存时间和无瘤生存时间显著相关,单因素和多因素分析发现,Wnt7a的表达可作为预测子宫内膜癌患者预后和复发的风险因子[8]。在卵巢癌研究中发现,相对于癌旁组织,Wnt7a在卵巢癌组织中高表达,并与患者预后差相关[14]。在结肠癌中,Wnt7a高表达于结肠癌组织中,并与肿瘤大小、淋巴结转移、TNM分期相关。Wnt7a高表达的肿瘤患者无瘤生存时间和总生存时间更短[15]。除了Wnt7a所为癌基因有文献报道外,其作为抑癌基因也有文献报道。如在宫颈癌组织和细胞系中,Wnt7a呈低表达状态[16]。Bikkavilli 等[17]在转基因鼠中发现,小鼠肺癌发病率升高,主要由于Wnt7a缺失表达。在白血病中[18],发现Wnt7a在白血病中低表达,高表达Wnt7a的T淋巴细胞能够抑制白血病细胞增殖,说明Wnt7a具有抑制肿瘤的功能。在肾细胞癌[19]中,88%的Wnt7a呈低表达状态,且过表达Wnt7a可抑制肿瘤细胞增殖和克隆形成能力。在本研究中,胃癌组织Wnt7a高表达。结合临床病理因素分析发现,Wnt7a高表达与TNM分期、远处及淋巴结转移显著相关,这与之前在乳腺癌、结肠癌和卵巢癌中的报道一致。生存分析发现,Wnt7a高表达的胃癌患者更易复发,生存时间更短。多因素分析提示Wnt7a的表达状态可作为预测患者预后的独立危险因素。
当然,本研究仅限于分析胃癌患者临床病理因素与Wnt7a表达水平的关系,对机制并未作深入研究。Wnt7a在不同肿瘤中表达状态存在差异,在机制研究方面,在宫颈癌组织和细胞系中,Wnt7a下调表达的原因是由于其启动子中CpG岛的甲基化所致[16]。结合已有的报道,肿瘤中低表达的原因可能是由于表观遗传修饰调控,比如启动子DNA的甲基化、mRNA被微小RNA降解等,从而导致细胞衰老和凋亡不受调控,进而促进肿瘤发生发展[18]。Wnt7a作为抑癌基因的机制方面,Bikkavilli等[17]发现,Wnt7a通过失活调控细胞衰老的重要调控因子S期蛋白激酶相关蛋白2的活性,从而调控细胞正常衰老和凋亡,一旦WNT7A的表达量异常降低,这一过程被干扰,细胞衰老和凋亡减少,进而导致小鼠肺癌的发生。Wnt7a作为癌基因的机制方面,King等[20]发现成纤维细胞生长因子1作为Wnt7a/β-catenin信号通路下游的直接靶分子促进肿瘤的发生。本研究发现Wnt7a的高表达与胃癌的转移显著相关。笔者推测Wnt7a可能参与了胃癌的侵袭转移。结合之前的报道,上皮间质转化在胃癌的侵袭转移中发挥重要作用,而Wnt7a/β-catenin信号通路能够促进胃癌上皮间质转化发生,从而促进胃癌转移[21-23]。因此,推测Wnt7a上调表达可能通过促进胃癌上皮间质转化转化,导致胃癌的远处转移。
综上,Wnt7a在胃癌组织中高表达,并与患者恶性病理特征和预后差相关。Wnt7a的表达可作为判断胃癌患者预后不良的独立危险因子。诚然,本研究也存在一定的不足,比如Wnt7a在细胞系中的结果如何,与胃癌侵袭转移的具体分子作用机制还有待后续深入研究。
