达芬奇机器人手术系统在残胃癌治疗中的应用:附8例报告
2019-05-09马凯刘宏斌孙建兵汪亚辉于建平韩晓鹏李洪涛
马凯,刘宏斌,孙建兵,汪亚辉,于建平,韩晓鹏,李洪涛
(1. 宁夏医科大学研究生院,宁夏 银川 750004;2. 兰州军区兰州总医院 普通外科,甘肃 兰州 730050)
我国胃癌的发病率及病死率位居所有恶性肿瘤的第2位[1]。胃癌的治疗仍以外科手术为主要方式,随着临床诊疗技术不断提高,胃癌患者术后的生存率也得到了很大的提高[2-3]。以及自20世纪70~90年代,对于消化道溃疡等良性疾病广泛采取胃大部切除术治疗,这使得近20年来我国残胃癌的发生率呈现逐年上升的趋势[4]。目前残胃癌的治疗仍是尽可能的施行根治性切除术,由于初次手术对原来消化道结构的改变及术后腹腔粘连等问题,导致手术难度增大,一般选择传统开腹手术[5]。但是随着微创技术及人工智能的发展,达芬奇机器人手术系统(简称机器人)以其消除震颤、高倍视野、3D成像等优势,使手术操作更加精准,将残胃癌的微创治疗推向了新的高度。笔者医院已成功为8例残胃癌患者行达芬奇机器人辅助下残胃癌根治术,现将结果报告如下。
1 资料与方法
1.1 一般资料及纳入标准
收集2017年1月—2018 年3月在兰州军区总医院就诊的8例残胃癌患者,其中男6例,女2例;年龄55~74岁,平均(64.8±6.6)岁。体质量指数(BMI)17.5~25.3 kg/m2,平均为(18.2±3.3)kg/m2(表1)。纳入标准:⑴ 术前经电子胃镜及病理活查明确诊断为残胃癌;⑵ 腹部CT或核磁检查未发现直接肿瘤侵犯及远处转移;⑶ 无严重的心肺疾病及其他手术禁忌证。排除标准:⑴ 术中见肿瘤浸润至周围脏器,甚至发生广泛腹膜转移;⑵ 腹腔内粘连严重者;⑶ 中转开腹。

表1 8例患者一般资料Table 1 The general data of the patients
1.2 手术方法
1.2.1 麻醉及操作体位行气管内插管全身全麻,患者取仰卧、头高脚低位,两腿分开。常规术区皮肤消毒,铺无菌巾单。Trocar的建立一般采用“V”型5孔法,在距脐孔下缘1~2 cm处做1 cm切口,穿刺并放置12 mm Trocar作为观察孔,建立气腹,压力维持在12~14 mmHg(1mmHg=0.133 kPa)。分别在左右腋前线与腋中线之间的中线肋缘下放置8 mm Trocar作为第1、3号机械臂操作孔,左锁骨中线脐上缘水平置入12 mm Trocar作为手辅助孔,右锁骨中线脐上缘水平放置8 mm Trocar作为第2号机械臂操作孔(图1A)。1号臂安装超声刀或电勾,2、3号臂装双孔抓持钳。
1.2.2 残胃切除及淋巴结清扫自右膈下逆时针探查腹腔,观察腹腔粘连情况以及肿瘤是否在腹壁、腹腔、盆腔脏器等存在转移灶,观察肿瘤的大小、位置、对周围组织的浸润程度及腹腔淋巴结转移情况。⑴ 探查可见肠管与腹壁粘连,用1号臂上的超声刀分离肠管与腹壁的粘连(图1B)。⑵ 3号臂向上提起残胃空肠吻合口,2号臂反向牵拉空肠,1号臂超声刀锐性分离残胃-空肠吻合口与横结肠及小肠之间之间的膜性粘连,游离空肠输入、输出肠袢约10~15 cm,充分暴露胃肠吻合口(图1C)。⑶ 在机器人高倍视野下1号臂超声刀精确分离残留的大网膜及胃结肠韧带至脾曲、清扫第4sb 组淋巴结。离断脾胃韧带清扫第4sa、10、11d组淋巴结,向上继续清扫第2组淋巴结(图1D)。⑷ 3号臂提起残胃显露胰腺,2号臂下压胰腺,超声刀分离残胃与胰腺之间的粘连,向右上腹翻起残胃,游离肝总动脉、脾动脉并横断胃左动脉(3例初次手术中已离断胃左动 脉),清 扫 第7、8a、8p、9、11p组 淋 巴结。⑸ 3号臂挑起肝脏暴露胃小弯及肝脏左叶间的粘连,游离小弯侧至贲门,清扫第1、3、12a、12b组淋巴结(图1E)。⑹ 打开横结肠系膜,注意保护肠系膜血管,清扫第14a、14v、15组淋巴结。⑺ 最后沿着食管裂孔向上分离至左、右膈肌脚,离断残胃前后迷走神经,裸化食管下段。清扫19、20组淋巴结。分别于输入袢和输出袢距残胃-空肠吻合口5~10 cm处用Endo-GIA离断空肠(图1F)。
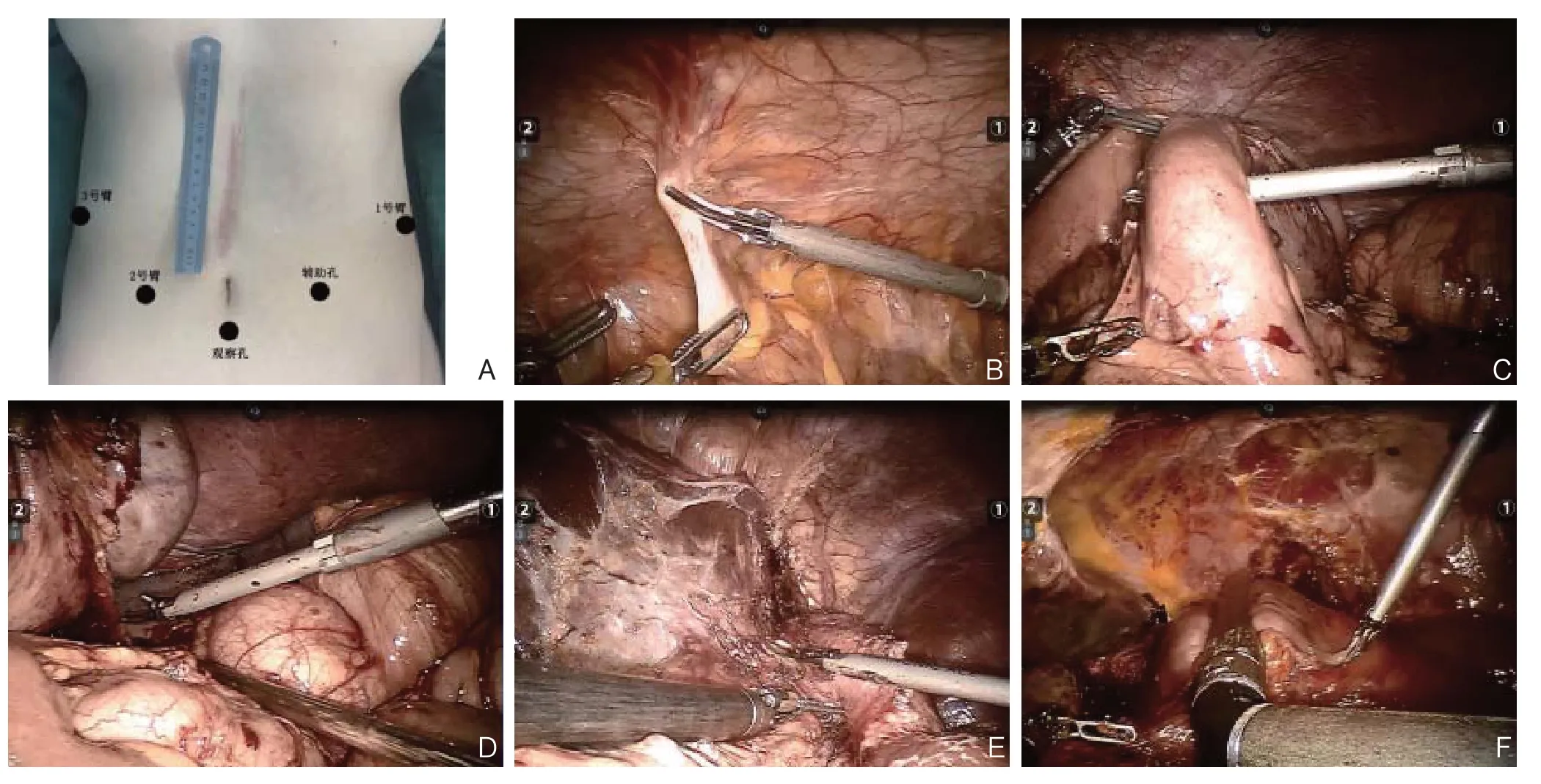
图1 术中照片Figure 1 Intraoperative views
1.2.3 消化道重建均采用食管空肠Roux-en-Y吻合术,于上腹正中取4~5 cm左右切口,放置切口保护套,在距贲门2~3 cm的食管上取1~1.5 cm左右的横切口,放入管型吻合器的抵钉座,荷包缝合固定抵钉座,用电刀横断剩余部分未断的食管,取出标本。提起远侧空肠断端,用超声刀切开原输出袢的残端,置入管型吻合器,将食管空肠端侧吻合,用Endo-GIA封闭远端空肠残端,在距食管-空肠吻合口50 cm处用Endo-GIA将输入袢断端与空肠侧侧吻合。检查吻合口是否通畅,加固吻合口并常规放置腹腔引流管后逐层关腹。
2 结 果
2.1 手术及术后情况
8例患者均成功施行达芬奇机器人辅助下残胃癌根治术,平均手术时间(237.8±11.0)min,平均术中出血量(147.5±28.2)mL,平均淋巴结清扫数目(32.3±7.6)枚。术后第1天均拔除胃管,术后首次下地活动时间(1.3±0.2)d,术后首次肛门排气时间(2.5±0.6)d,术后进食时间(2.7±0.5)d,平均住院时间(7.2±0.5)d。术后均未出现腹腔内出血、腹腔感染、吻合口瘘、吻合口狭窄、肠梗阻、切口感染等并发症,1例患者出现肺部感染。围手术期无死亡病例。术后病理:5例低分化腺癌,3例中分化腺癌;术后病理分期:IB期2例,IIA2期1例,IIB期2例,IIIA期2例,IIIB期1例。
2.2 随访情况
术后每月均进行门诊复查或电话随访,随访内容包括是否正常进食(进食哽咽感、返酸、烧心、腹痛、腹胀),进食的量及频率,营养状况,有无肿瘤复发转移。截止2018年3月,随访时间为6~12个月,随访期间无死亡病例。8例患者均进食正常,体质量无明显减轻,一般情况良好,未见肿瘤复发。
3 讨 论
1922年Balfour[6]首次提出了残胃癌的概念,指胃或十二指肠良性疾病行胃部分切除术后5年以上的残胃发生的原发性癌。日本《胃癌处理规约》第14版将残胃癌定义为:无论初次手术是何种病变,在胃切除术后的残胃上发生的胃癌即为残胃癌[7]。残胃癌作为胃癌的一种特殊类型,发病率正逐年上升,目前残胃癌的发病在胃癌中占到1%~8%[8-9]。早期残胃癌患者无明显特征性的临床表现,就诊时患者大多处于中、晚期[10]。但是尽可能施行根治性手术仍是胃癌乃至残胃癌的首要治疗手段,术后可明显改善患者预后,延长患者的生存期,提高患者的生存质量。微创手术技术以其创伤小,术后恢复快、并发症少等优势已广泛应用于临床[11-12]。自2008年笔者医院开始探索用腹腔镜根治残胃癌,岂今成功完成98例,掌握了腹腔镜下残胃癌手术的技术方法。与传统开腹手术相比腹腔镜手术也存在一些弊端:腹腔镜下电勾、针持是不能旋转的,狭窄空间内的精细化操作难度大;助手长时间暴露视野,容易疲惫,不够平稳;二维画面真实感差等。而机器人手术系统克服了这些缺点[13-14]。近来的研究[15-18]表明机器人胃癌根治术是安全可行的,并且手术适应证也扩大到了进展期胃癌。但是残胃癌中应用机器人鲜有报道。笔者认为机器人继承了腔镜的优势并将其放大化。
Trocar的正确建立在机器人手术中至关重要,是影响手术操作的重要因素之一。残胃癌手术方式与胃癌略有不同,根据笔者医院在机器人残胃癌手术方面的经验,笔者认为手辅助孔和2号机械臂操作孔应建在左右锁骨中线脐上缘水平处,1号臂和3号臂的Trocar孔应建在左右腋前线与腋中线之间的中线肋缘下,并且在安装1号臂和3号臂时尽量要使其操作臂外展,这样才能减小1号臂和3号臂与水平方向的夹角,增加超声刀在腹腔内的活动范围及操作的灵活性,降低操作的难度。并且各Trocar之间的距离要>8 cm,避免机械臂之间的相互干扰。残胃癌患者大多腹腔粘连严重,通常把观察孔建立在脐下缘2 cm处,可避免损伤肠管,在视屏监视下避开肠管与腹壁粘连的部位,建立手辅助孔和1号臂Trocar孔,在助手辅助下,分离肠管与腹壁的粘连,再置入2、3号臂,双孔抓钳与肠管接触面积大,局部压强小,长时间钳加组织不会导致缺血坏死。这种“V”型的Trocar分布有利于术者在狭小空间内充分暴露腹腔脏器的解剖结构,分离脏器间的粘连。
目前,治疗残胃癌采取最多的方式是残胃切除术+D2站淋巴结清扫[10,19],对淋巴结彻底清扫是影响患者预后的重要因素之一。但是,残胃癌由于初次手术改变了胃的局部解剖结构,导致其淋巴引流方向也随之发生变化,并且研究表明残胃癌所在的部位、原胃肠吻合方式及初次淋巴清扫范围不同时,残胃癌的淋巴结清扫就有所变化[20]。所以,清扫残胃癌的淋巴结需要包括一些原发胃癌手术时不作为常规清扫的站别,Billroth I式重建者应清扫12、13、14组淋巴结,Billroth II式重建者尤其肿瘤长在吻合口时应清扫14a、14v、16a2、16b1、17组淋巴结,下段食管受侵犯时,应清扫19、20、110、111站淋巴结。这大大增加了淋巴结清扫的难度,而机器人手术系统拥有3D立体成像、高倍放大视野、高仿真手腕、振动消除、动作定标、远程操控等优势,使手术操作更加灵活、精细、准确,有利于术者更好的分辨手术区域的解剖层次,实现胃周血管的脉络化及淋巴结的彻底清扫[21]。Son等[22]比较了机器人组与腹腔镜组全胃切术除术的患者,认为机器人组在脾动脉及脾门淋巴结平均清扫数目明显高于腹腔镜组。JunFung等[24]报道了120例达机器人胃癌根治术与394例腹腔镜下胃癌手术的对比,结果显示:机器人组与腹腔镜组清扫淋巴结的数量为(34.6±10.9)枚与(32.7±11.2)枚,差异有统计学意义(P<0.05)。Iguchi等[11]研究表明残胃癌向脾脏方向的淋巴引流增加。机器人在清扫脾门淋巴结时具有独特的优势,因此机器人手术系统在残胃癌淋巴结清扫方面应比腹腔镜手术更具优势。
患者术后1例出现肺部感染,主要是因为患者长期吸烟,肺功能差,术后未能有效排痰,导致肺部感染。给予对症治疗后术后第5天肺部感染症状明显好转。本组手术用时平均手术时间(237.8±11.0)min,时间偏长,这与安装机器耗时有关。数据变异小,是因为我科从事腹腔镜残胃癌根治术的研究10年余,熟练掌握了镜下残胃癌的解剖结构及手术技巧,这为机器人手术操作打下良好的基础。本研究的不足之处在于样本量少,并且远期疗效有待进一步随访。
综上所述,本研究表明机器人可在微创条件下实现残胃癌的D2根治术,手术是安全、有效、可行的,手术更加微创,术中出血少,术后疼痛轻,并发症少,可明显改善患者预后。机器人手术系统已经代表了微创外科的发展方向,并凭借其灵活性、准确性和精细度将在残胃癌手术中的应用越来越广泛。相信随着生活水平的提高和科学技术的发展,达芬奇机器人手术系统将成为残胃癌治疗的起到重要的作用。
