血清CYS-C、β2-MG联合检测在肝肾综合征中的诊断价值及临床意义
2019-05-07陈兰兰张锦韩文薛顺和
陈兰兰 张锦 韩文 薛顺和
肝肾综合征(HRS)为终末期肝病患者最严重的并发症之一,是以肾功能损伤、血流动力学改变和内源性血管活性物质明显异常为特征的一种综合征。临床分为快速进展型(Ⅰ型)和缓慢型(Ⅱ型)。部分肝硬化患者在血肌酐、尿素氮升高之前( 即临床诊断为HRS之前),就已经存在肾小球滤过率(GFR)和肾血流量的下降,这就是亚临床肝肾综合征,此时常规肾功能检查不能识别该病[1-2]。本研究回顾性分析延安大学附属医院2013年1月至2018年6月肝硬化合并肝肾综合征、亚临床肝肾综合征的特点及危险因素,提高对肝肾综合征的认识,有助于早期诊治肝肾综合征、改善预后。
资料与方法
一、研究对象
回顾性分析2013年1月至2018年6月于延安大学附属医院住院治疗且资料完整的的肝硬化患者2 102例。纳入标准:所有患者均经实验室、影像学或病理检查确诊为肝硬化。疾病诊断符合中华医学会肝病学分会、中华医学会感染病学分会制定的《慢性乙型肝炎防治指南(2015年更新版)》[3]、《酒精性肝病防治指南(2018版)》[4]、《丙型肝炎防治指南(2015年更新版)》[5]、《非酒精性肝病防治指南(2018年更新版)》[6],自身免疫性肝病诊断符合《胆汁淤积性肝病诊断治疗专家共识2013年》[7],HRS诊断符合2015年国际腹水俱乐部(ICA)指导意见[8]。排除标准:(1)合并原发肾损害、继发性肾损害(心衰、糖尿病、高血压等)及其他器质性肾脏疾病;(2)合并慢性呼吸衰竭、甲亢、结核、风湿免疫性疾病等全身慢性或代谢性疾病;(3)妊娠、哺乳期妇女,儿童,合并原发性或继发性肿瘤患者。
二、研究方法
(1)收集患者一般资料:性别、年龄、病因、吸烟、饮酒、生活行为习惯。(2)血常规:Hb 、WBC 、PLT、RBC等;生化指标:血K、血Na、血CL、血Ca、Cys-C 、Urea、β2-MG、CRE 、UA、TP、Alb 、PA、 ALT、AST、ALP、γ-GGT、CHE、TBil、DBil、IBil 、TBA ;凝血功能:PT 、PT-%、INR 、APTT 、FIB 、TT、FDP、D二聚体。(3)并发症:上消化道出血、自发性腹膜炎、电解质紊乱、肝性脑病、胸腔积液、腹腔积液、门脉静脉血栓、器官或系统感染。
三、统计学方法

结 果
一、一般资料分析
三组间两两比较Child评分差异有统计学意义(P<0.05),HRS组以Child-C级为主(54%),亚HRS组以Child-B级为主(44.2%),肝硬化组以Child-A级为主(78.9%)。三组间病因构成、吸烟、饮酒差异无统计学意义(P>0.05)。HRS组男性比例(74%)显著高于亚临床HRS组(65.7%)、肝硬化组(69.5%)。HRS与肝硬化组、亚临床HRS与肝硬化组间年龄差异有统计学意义(P<0.05),而HRS与亚临床肝肾综合征组差异无统计学意义(P>0.05)。提示男性、年龄大、Child评分高的患者易合并HRS,见表1。
二、实验室结果比较
三组间两两比较NEU、RBC、Urea、Cys-C、β2-MG、Alb、PT、FDP、D二聚体之间差异有统计学意义(均P<0.05),ALT差异无统计学意义 (P>0.05)。HRS组与亚临床肝肾综合征组间Hb、PLT、血Na、血CL、血Ca、TP、PA、AST、GGT、CHE、TBil、DBil、TBA、PT-%、INR、APTT差异无统计学意义(均P>0.05),而HRS组与肝硬化组、亚临床肝肾综合征组与肝硬化组间差异有统计学意义(均P<0.05)。
HRS组与亚临床肝肾综合征组、亚临床肝肾综合征组与肝硬化组间WBC、血K差异有统计学意义(均P<0.05),而HRS组与肝硬化组间差异无统计学意义(P>0.05)。
HRS组与亚临床肝肾综合征组、HRS组与肝硬化组间ALP、FIB、TT差异无统计学意义(P>0.05),而亚临床肝肾综合征组与肝硬化组间差异有统计学意义(P<0.05)。
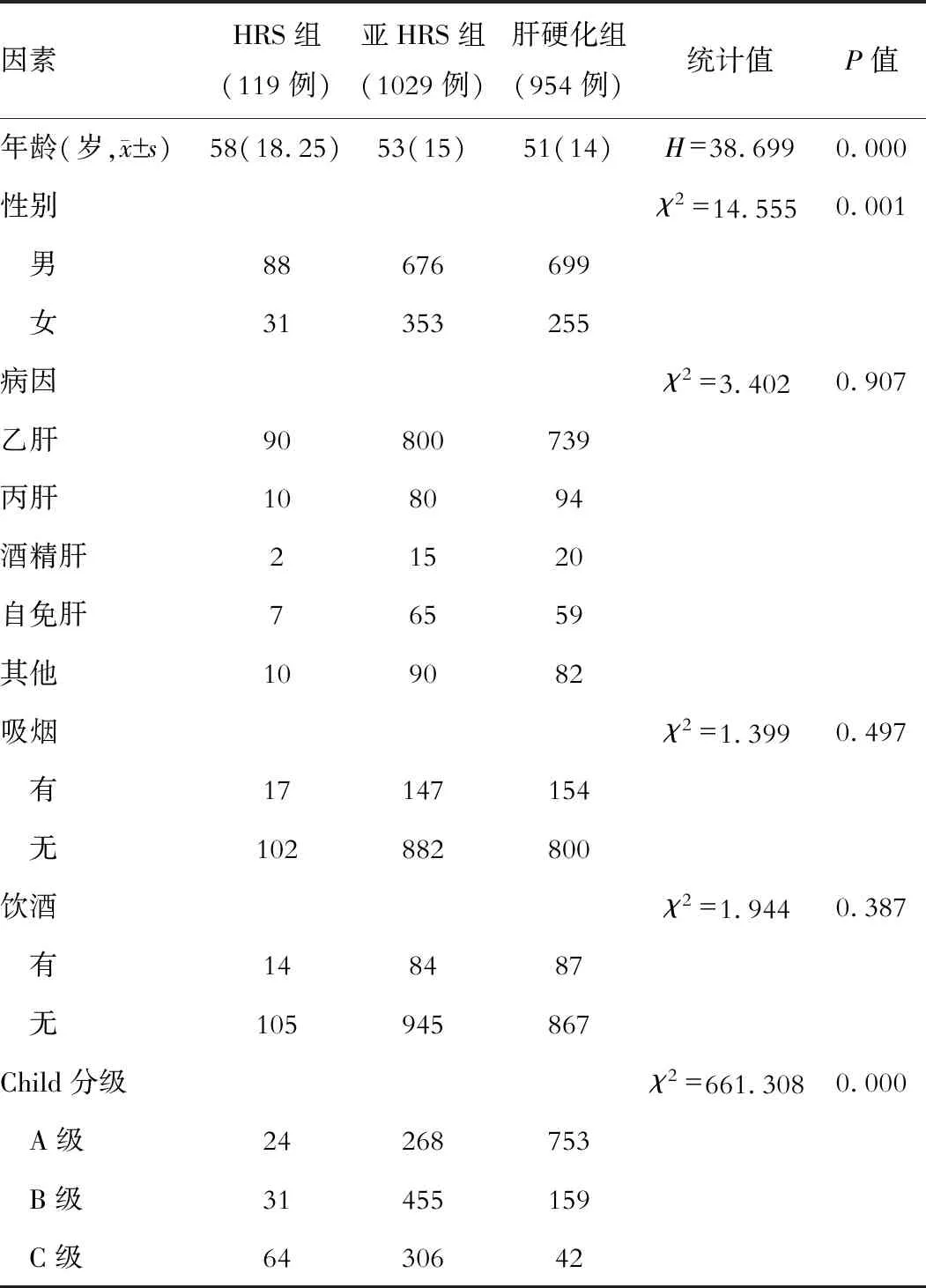
表1 一般资料分析比较
HRS与亚临床肝肾综合征组、HRS与肝硬化组间Cr、UA差异有统计学意义(P<0.05),而亚临床肝肾综合征与肝硬化组间差异无统计学意义(P>0.05)。见表2。
三、临床并发症分析
单因素分析肝肾综合征的发生与上消化道出血、肝性脑病、食管胃底静脉曲张、自发性腹膜炎、胸腔积液、腹腔积液、电解质紊乱有关(均P<0.05),见表3。
四、HRS组的多因素相关分析
将HRS组患者的NEU、RBC、Urea、Cys-C、β2-MG、Cr、Alb、PT、FDP、D二聚体、Child评分、上消化道出血、肝性脑病、食管胃底静脉曲张、门静脉血栓形成、自发性腹膜炎、胸腔积液、腹腔积液、电解质紊乱、感染进行非条件Logistic回归模型分析,结果显示,Urea、Cys-C、β2-MG、Cr、上消化道出血、肝性脑病、自发性腹膜炎、电解质紊乱是肝肾综合征形成的独立危险因素。见表4。
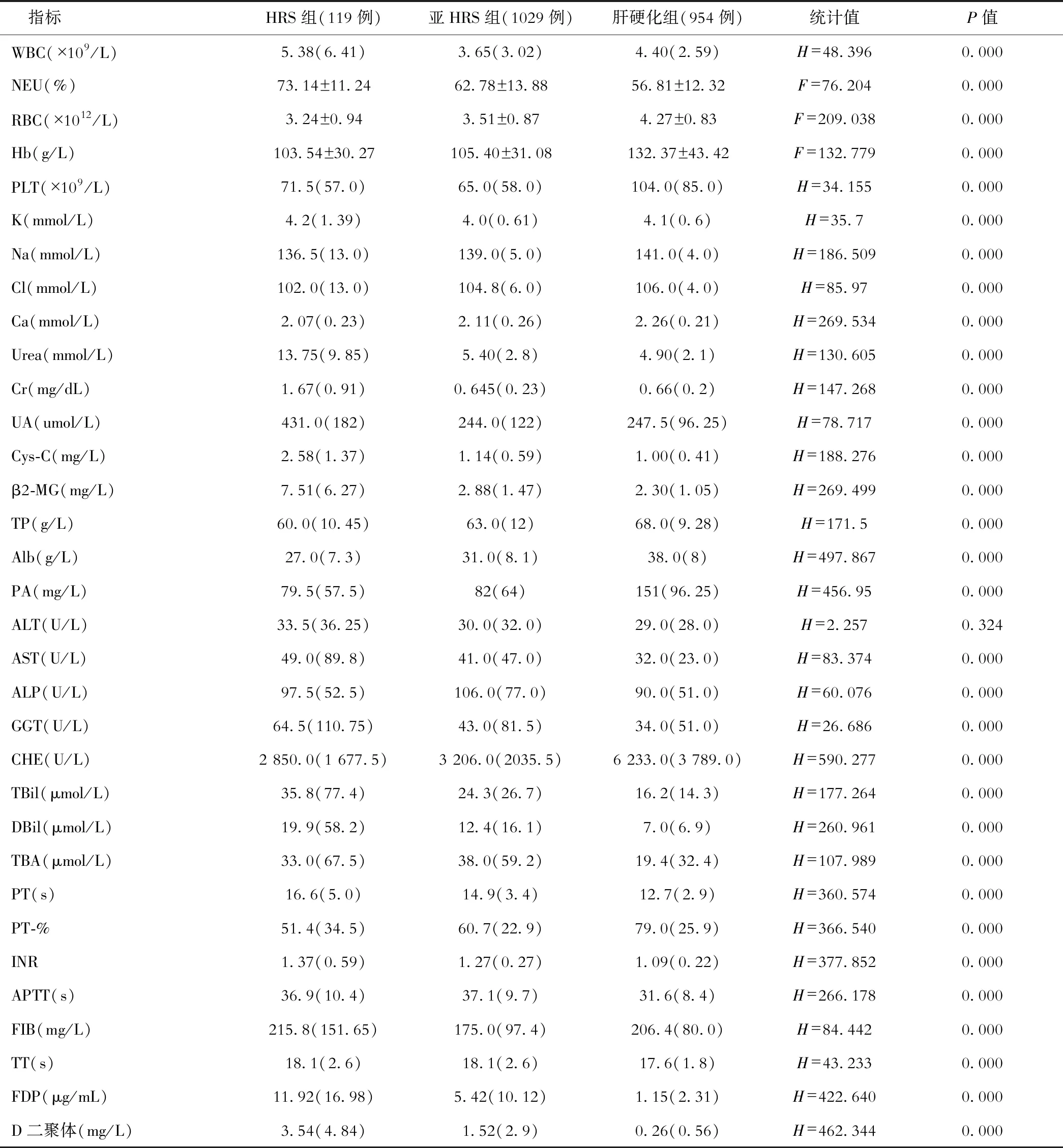
表2 实验室结果比较
五、Cys-C、β2-MG在HRS组、亚临床HRS组的受试者ROC曲线
分别对HRS组、亚临床肝肾综合征组Cys-C、β2-MG、Cr、Urea作ROC曲线,结果示,HRS组ROC曲线下面积:Cys-C、Cr、β2-MG联合检测(0.941)、Cys-C联合β2-MG(0.935)、Cr(0.932)、Cys-C(0.763)、β2-MG(0.732)、Urea(0.7)。
亚临床HRS组ROC曲线下面积:Cys-C联合β2-MG(0.759)、Cys-C(0.725)、β2-MG(0.724)、Urea(0.577)、Cr(0.485)。提示结果说明Cys-C联合β2-MG对HRS、亚临床肝肾综合征的诊断价值更高,更有利于发现肝硬化早期肾损害患者。

表3 临床并发症分析比较

表4 HRS组危险因素非条件Logistic回归
讨 论
本研究发现HRS患者NEU、PT、FDP、D二聚体水平升高,RBC、Alb水平降低。多因素分析显示,Urea、Cys-C、β2-MG、Cr、上消化道出血、肝性脑病、自发性腹膜炎、电解质紊乱是HRS形成的独立危险因素。肝硬化患者NEU升高可能与肝脏本身炎性病变、代谢物质蓄积有关,合并感染时NEU进一步升高。肝硬化患者肝脏合成凝血因子减少导致凝血时间进行性延长。本研究发现,肝硬化患者FDP、D二聚体水平升高,以往研究认为肝硬化患者凝血因子合成减少,因此血液处于低凝状态,而目前观点认为肝硬化患者的血液为低水平的高凝状态,提示HRS患者发生血栓的风险较高[9]。肝硬化患者肝脏合成功能减退、营养吸收不良,导致Alb合成减少,RBC降低与脾功能亢进、消化道出血有关。
此次研究发现,亚临床肝肾综合症组Cys-C、β2-MG水平升高早于Cr,Cys-C、β2-MG诊断亚临床肝肾综合征的ROC曲线下面积分别为0.725、0.724,显著高于Urea 0.577、CRE 0.485,二者联合检测曲线下面积0.759,提示Cys-C、β2-MG可作为亚临床肝肾综合征早期肾功能检测指标,与纪桂贤等[10]研究一致。在HRS组,Cys-C、β2-MG诊断HRS的ROC曲线下面积分别为0.763、0.732,低于Cr 0.932,但二者联合曲线下面积为0.935,与Cr无明显差异。Cys-C、β2-MG联合Cr三者联合检测效能最高,曲线下面积0.941,与文献报道基本一致[11],但考虑到目前HRS诊断标准存在争议,诊断标准不断降低[12],而此次HRS患者的选取仍以Cr为标准,因此结果可能存在一定的误差,有待于进一步研究。此外,Ayse 等[13]研究证实,在评估患者肾小球滤过率(GFR)及肾血浆流量(RPF)方面,Cys-C、β2-MG均优于Cr,提示Cys-C、β2-MG 可用于评估肝硬化患者合并HRS的风险。De Souza等[14]研究证实,Cys-C是比Cr更好的反映肾小球滤过标志物,且不受肝硬化程度的影响。值得注意的是,虽然Cys-C在评估肝硬化患者GFR、HRS风险方面优于Cr,但其并不能有效区分HRS与急性肾小管坏死(ATN),一些新型的肾损伤标记物如:中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤分子-1(KIM-1)、IL-18、肝型脂肪酸结合蛋白(L-FABP)有助于鉴别功能性肾损伤和结构性肾损伤[15]。但目前这些新型肾损伤标记物并未被广泛应用于临床。
综上,血清Cys-C、β2-MG可用于肝肾综合征的早期诊断,诊断效能不亚于Cr,且能灵敏反映肝硬化早期肾小球滤过率的变化,有利于早期发现肝硬化肾损伤患者,从而早期诊治,改善预后。
