MST4表达对MHCC97H肝癌细胞细胞因子、ERK蛋白、p-ERK蛋白表达的影响及其意义
2019-05-05赵小丽刘俊华周凤蕊王佳乐李广明
赵小丽,高 鹏,刘俊华,周凤蕊,王佳乐,李广明
(郑州市第六人民医院肝病五科,郑州450000)
肝癌在我国恶性肿瘤的发病率中居于高位,尽管目前临床具有放疗、化疗及手术等多种有效方法,但由于原发性肝癌早期临床症状较为隐匿,确诊时患者多存在肝癌细胞转移并多处于晚期,手术治疗的效果显著降低,而由于放疗、化疗较大的毒副作用在临床使用受限[1]。因此,探寻肝癌的侵袭、转移机制对制订有效的治疗方案具有重要意义。研究[2-3]提示丝氨酸/苏氨酸蛋白激酶4/(mammalian Ste20-like kinase 4,MST4)对肝癌的预后不良具有提示作用并可加速肿瘤细胞的侵袭、生长及转移,还可调节炎性细胞因子而介导肝癌的转移和侵袭,而肝癌细胞上皮间质(epithelial mesechymal transitional,EMT)转化可被MST4激活,进而增加肝癌严重程度[4]。因此,本研究深入探讨了MHCC97H肝癌细胞中MST4的表达与癌细胞增殖、侵袭迁移的关系,旨在为肝癌的转移、侵袭机制提供新的思路。
1 材料与方法
1.1 MHCC97H肝癌细胞系 MHCC97H肝癌细胞系购买于复旦大学医学院基础医学院教研室;实验所用质粒均由南京建成生物研究所提供。
1.2 实验药品、仪器 胎牛血清及DMEM培养液购于美国 Hyclone 公司;MST4(1:500)、EDTA 消化液(0.02%)及胰蛋白酶(0.25%)购于美国Proteintech公司;Western blot试剂盒及细胞核蛋白、总蛋白试剂盒购于 Millipore公司;白细胞介素-2(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、趋化因子-2(CCL2)ELISA试剂盒及Transwell小室试剂盒均购于南京建成生物研究所;大鼠ERK及大鼠抗人磷酸化ERK多克隆抗体均购于美国上海康城生物公司;辣根过氧化物酶标记羊抗大鼠IgG美国BD公司;酶标仪购于美国GE公司。
1.3 实验方法 胎牛血清(10%)高糖DMEN于5%CO2及37℃条件培养箱传代培养,3 d传代1次;将MHCC97H肝癌细胞培养至对数生长期后,接种于96孔板上培养,分为空白组、高表达组(MST4转染高表达)、低表达组(MST4转染siRNA)。
1.4 指标检测方法 采用ELISA法检测各组培养24h后上清液中白细胞介素-2(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、趋化因子-2(CCL2)。
采用Western-blot法检测各组的ERK、p-ERK的表达情况,提取总蛋白后,取20 g总蛋白行SDSPAGE电泳,常规转膜后5%脱脂奶粉2 h室温封闭,分别加入大鼠ERK及大鼠抗人磷酸化ERK一抗,次日常规洗膜后加入辣根过氧化物酶标记羊抗大鼠IgG,室温1 h孵育,暗室曝光显色。
采用MTT实验检测3组肿瘤细胞的增殖能力。取对数生长期MHCC97H肝癌细胞,接种于96孔板,每孔约2 000个,每组设5个平行孔,5%CO2、37℃条件培养箱培养,细胞贴壁后每孔加入5 g/L MTT 10 μL,37℃4 h孵育,弃除上清培养基后每孔加150 μL DMSO,振荡后酶标仪(492 nm波长)检测吸光度。
采用Transwell实验检测各组细胞的侵袭迁移能力。转染的MHCC97H肝癌细胞48 h培养后消化,取1×105个细胞于灭菌EP管(1.5 mL),细胞重悬后具体操作依据Transwell小室试剂盒说明书,24 h常规培养后取出小室,乙醇(95%)固定,结晶紫染色后取5个视野200倍显微镜下观察侵袭情况并计数。
1.5 统计学方法 统计软件采用SPSS16.0版本,数据表述采用±s表示,数据统计分析采用单因素方差分析法,组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组细胞MST4蛋白表达比较 高表达组的MST4蛋白表达显著高于空白组和低表达组(P<0.05);空白组和低表达组的MST4蛋白表达水平差异无统计学意义(P>0.05,表1)。
表1 3组细胞的MST4蛋白表达水平比较(±s,相对表达强度)Tab 1 Comparison of MST4 protein expression levels in cells of 3 groups of patients(±s,relative expression intensity)
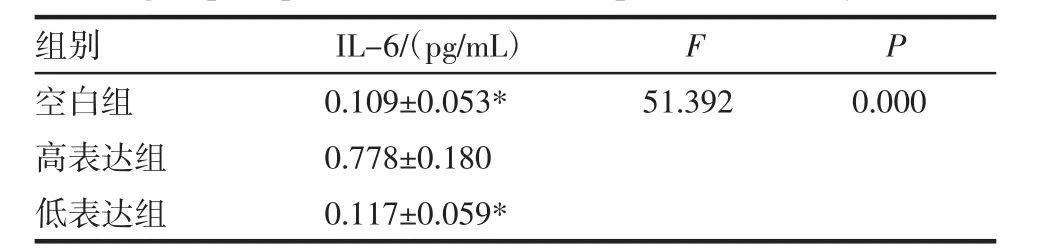
表1 3组细胞的MST4蛋白表达水平比较(±s,相对表达强度)Tab 1 Comparison of MST4 protein expression levels in cells of 3 groups of patients(±s,relative expression intensity)
与高表达比较*P<0.05
组别I L-6/(p g/m L)F P空白组 0.1 0 9±0.0 5 3* 5 1.3 9 2 0.0 0 0高表达组 0.7 7 8±0.1 8 0低表达组 0.1 1 7±0.0 5 9*
2.2 3组细胞的上清液中细胞因子水平比较 高表达组的上清液中 IL-6、IL-1β、TNF-α、CCL2 水平均显著高于空白组和低表达组(P<0.05);空白组和低表达组的上清液中 IL-6、IL-1β、TNF-α、CCL2 水平差异无统计学意义(P>0.05,表 2)。
表2 3组细胞的上清液中细胞因子水平比较(±s)Tab 2 Comparison of cytokine levels in the supernatant of three groups of cells(±s)

表2 3组细胞的上清液中细胞因子水平比较(±s)Tab 2 Comparison of cytokine levels in the supernatant of three groups of cells(±s)
与高表达比较*P<0.05
组别 I L-6(p g/m L)I L-1 β(p g/m L)T N F-α(p g/m L)C C L 2(p g/m L)空白组 4 4.7±1 2.0* 4 1.6±1 1.3* 2 8.5±6.9* 3 8.3±1 1.2*高表达组 1 4 3.8±3 9.5 1 8 2.5±2 8.0 3 9 5.6±5 5.3 1 9 0.5±4 4.0低表达组 4 0.0±1 0.5* 3 6.8±9.3* 2 7.0±6.3* 3 7.0±9.8*F 3 1.6 9 2 4 4.5 2 8 9 6.4 1 7 5 2.0 0 4 P 0.0 0 0 0.0 0 0 0.0 0 0 0.0 0 0
2.2 3组细胞中的ERK、p-ERK蛋白表达情况 空白组、高表达组和低表达组的ERK蛋白表达差异无统计学意义(P>0.05);高表达组的p-ERK蛋白显著高于空白组和低表达组(P<0.05),空白组和低表达组的p-ERK蛋白表达差异无统计学意义(P>0.05,表 3,图 1)。
表3 3组细胞的中ERK、p-ERK蛋白表达情况(±s)Tab 3 Expression of medium ERK,P-ERK protein in three groups of cells(±s)

表3 3组细胞的中ERK、p-ERK蛋白表达情况(±s)Tab 3 Expression of medium ERK,P-ERK protein in three groups of cells(±s)
与高表达比较*P<0.05
组别 E R K(相对表达强度) p-E R K(相对表达强度)空白组 0.8 3 1±0.1 1 7 0.2 6 9±0.1 0 5*高表达组 0.8 5 9±0.1 3 3 0.6 2 2±0.1 4 5低表达组 0.8 4 0±0.1 0 8 0.2 8 0±0.0 8 6*F 2.2 5 9 3 5.5 9 8 P 0.1 7 7 0.0 0 0

图1 Western-blot法检测结果Fig 1 Detection result Western-blot
2.3 3组细胞的MTT实验检测结果 高表达组的MTT实验吸光度值高于空白组和低表达组(P<0.05);空白组和低表达组的MTT实验吸光度值差异无统计学意义(P>0.05,表 4)。
表4 3组细胞的MTT实验检测结果(±s)Tab 4 Results of MTT assay in three groups of cells(±s)

表4 3组细胞的MTT实验检测结果(±s)Tab 4 Results of MTT assay in three groups of cells(±s)
与高表达比较*P<0.05
组别 M H C C 9 7 H肝癌细胞(吸光度值) F P空白组 0.2 0 6±0.0 7 7* 2 5.8 2 6 0.0 0 0高表达组 0.3 7 5±0.0 8 3低表达组 0.2 1 4±0.0 6 9*
2.4 3组细胞的Transwell实验检测结果 高表达组的Transwell实验MHCC97H肝癌细胞迁移数目高于空白组和低表达组(P<0.05);空白组和低表达组的Transwell实验MHCC97H肝癌细胞迁移数目差异无统计学意义(P>0.05,表 5)。
表5 3组细胞的Transwell实验检测结果(±s)Tab 5 Transwell test resules of three groups of cell(±s)

表5 3组细胞的Transwell实验检测结果(±s)Tab 5 Transwell test resules of three groups of cell(±s)
与高表达比较*P<0.05
组别 M H C C 9 7 H肝癌细胞(细胞数) F P空白组 8 8.3±1 4.6* 3 5.1 7 4 0.0 0 0高表达组 3 0 8.6±4 7.2低表达组 9 2.0±1 8.6*
3 讨论
肝癌是指起源于肝间叶组织和肝脏上皮细胞的恶性肿瘤,肝癌患者早期临床症状多隐匿,被诊断时已多为晚期并伴有乏力、消瘦、肝区疼痛及肝大等临床症状,临床治疗困难[5-6]。此外,肝癌细胞极易出现转移、浸润,这给肝癌的根治造成了严重障碍。因此,研究肝癌癌细胞侵袭、转移的相关机制并探寻灵敏、准确抑制肝癌转移的治疗靶点及方法对改善和提高肝癌患者预后意义显著。
MST4属于机体的重要激酶,可参与细胞骨架的形态形成、重排、细胞分化及凋亡等多种细胞活动,可促进细胞的转化及生长[7-8]。高表达组的MST4蛋白表达显著高于空白组和低表达组;空白组和低表达组的MST4蛋白表达水平差异无统计学意义。文献[9-10]提示前列腺及乳腺癌患者肿瘤的恶性程度及侵袭性与MST4的高表达具有高度相关性,这也与本研究结果一致。
研究[11-12]证实肿瘤的转移及侵袭过程与炎症因子具有密切联系,炎症因子可激活肿瘤细胞及炎症细胞,对抑制免疫介导的肿瘤监视作用显著。IL-6、IL-1β、TNF-α、CCL2 均为重要的促癌炎症因子,认为上述炎症因子的分泌失调可促进肝癌的早期发生及进展[13]。本研究结果显示,高表达组的上清液中IL-6、IL-1β、TNF-α、CCL2 水平均显著高于空白组和低表达组;而空白组和低表达组的上清液中IL-6、IL-1β、TNF-α、CCL2水平差异无统计学意义。上述结果提示,肝癌细胞存在较高的炎症因子水平,可能促进肝癌细胞的增殖、转移及侵袭。动物实验[14]证实,肝癌模型小鼠机体IL-1β及TNF-α表达水平明显升高,这也与本研究结果相符。炎症因子由免疫细胞和某些非免疫细胞产生和分泌,具有免疫调节作用,参与细胞生长、分化、修复和免疫过程。而慢性病大多为炎症因子参与的病理生理过程,肿瘤的发生均是由于一个长期的慢性炎症刺激而导致的。故而,MST4可能是通过调控IL-6、IL-1β、TNF-α、CCL2等炎症因子的分泌而影响肿瘤组织的病理发展。
本研究结果显示,空白组、高表达组和低表达组的ERK蛋白表达差异无统计学意义;高表达组的p-ERK蛋白显著高于空白组和低表达组;空白组和低表达组的p-ERK蛋白差异无统计学意义。上述结果提示,MHCC97H肝癌细胞中MST4高表达,将会激活p-ERK蛋白表达,从而提高细胞因子的表达,促进肝癌细胞的增殖和侵袭。MST4可通过MAPK通路的激活诱导EMT肝癌细胞转化,对肝癌的预后不良具有显著的提示作用。ERK属于MAPK家族最重要的蛋白激酶,其磷酸化后形成p-ERK才能成为具有活性的蛋白激酶,进而调节包括细胞分化、增殖、衰老及凋亡等多种细胞调节作用,并调节炎症因子的分泌及产生[15]。
增殖及侵袭实验结果显示,高表达组的MTT实验吸光度值、Transwell实验MHCC97H肝癌细胞迁移数目高于空白组和低表达组;空白组和低表达组的MTT实验吸光度值、Transwell实验MHCC97H肝癌细胞迁移数目差异无统计学意义。上述结果证实MHCC97H肝癌细胞中MST4高表达与癌细胞的迁移具有密切联系,与上述研究结果一致。
综上所述,MHCC97H肝癌细胞中MST4高表达,将会激活p-ERK蛋白表达,从而提高细胞因子的表达,提高MHCC97H肝癌细胞的增殖和侵袭能力。
