膳食纤维肠内营养制剂对结直肠癌患者术后肠道屏障应激及营养指标的影响
2019-05-05万音程曼王梦影杨柳张绪梅
万音,程曼,王梦影,杨柳,张绪梅
(天津医科大学公共卫生学院营养与食品卫生教研室,天津300070)
世界范围内,结直肠癌(colorectal cancer,CRC)发病率在女性恶性肿瘤疾病中排第2位,在美国男性恶性肿瘤中第3位[1],其发病率在我国呈逐年增加趋势,流行病学证据表明饮食在CRC疾病进展中起重要作用,其发病风险与高膳食纤维摄入呈负相关[2]。围手术期CRC患者常因手术肿瘤切除及放化疗等创伤、应激下,机体处于负氮平衡,营养不良状态较为严重。术后早期肠内营养(Enteral nutrition,EN)是快速制定手术方案的重要组成部分,首次24 h内给予肠内营养能显著降低患者死亡率[3]。膳食纤维(Dietary fiber,DF)是指植物性食物不能被人体小肠吸收、对人体有益的碳水化合物,具有改善肠道微生物菌群,降低肠道内炎症反应等作用[4]。Zavertailo等[5]发现,ICU患者膳食中添加纤维可抑制患者全身炎症反应与多器官功能衰竭的发生。此外,其代谢产物短链脂肪酸(short chain fatty acid,SCFA),如丁酸,丙酸和乙酸可集结在结肠腔内可作为结、直肠细胞的主要能量来源[6]。最近研究表明,丁酸钠抑制CRC细胞增殖[7]。因而有学者认为对结直肠癌患者术后早期给予含膳食纤维肠内营养支持可能具有显著的临床价值[8]。既往关于膳食纤维用于临床的研究大多局限在肠道局部炎性病变,而将膳食纤维应用于CRC患者术后的临床研究鲜有报道,因此,本研究观察膳食纤维肠内营养制剂对CRC患者术后肠道屏障功能、炎症应激反应以及肠道动力功能恢复的影响,并对术后患者的营养状态进行评价。
1 对象与方法
1.1 研究对象 本研究经选取2016年1月-2017年12月连续首次入住于中国人民解放军第二五四医院急救康复中心的结肠癌或直肠癌患者。纳入标准:(1)年龄 50~80 岁,(2)肠镜病理活检确诊为“结肠癌”、“直肠癌”,(3)术前检查明确符合手术条件,(4)术前未进行过放化疗(5)术前签署的知情同意书。排除标准:(1)年龄大于80岁;食管静脉曲张或已知胃或食管出血史,(2)肿瘤合并肠梗阻,肠穿孔和肠坏死,(3)合并精神疾病及自身免疫性疾病者等。
采用随机数字表法分为含膳食纤维组(DF组)与非膳食纤维组(NDF组),两组患者手术均由同一名术者操作,采用硬膜外加全身麻醉,术前0.5 h、术后24 h给予抗生素预防感染。
1.2 营养支持方案 二组均于术中放置鼻胃、肠管,术后24 h内借助肠内营养泵开始给予肠内营养支持,DF与DNF组分别使用含膳食纤维肠内营养制剂(商品名:瑞先,华瑞制药有限公司)与不含膳食纤维肠内营养制剂(商品名:瑞素,华瑞制药有限公司)首日速度均为20~30mL/h,术后第2天的剂量调整为40~50 mL/h,术后第 3 d,转换为 60~70 mL/h,术后第5~7 d 转换为 80~90 mL/h,总剂量均控制为500 mL,温度控制在36~38℃,两组均在急性应激期能量给予20~25kCal/kg·d,稳定期给予 30~35kCal/kg·d[9],DF 组应激期和稳定期膳食纤维的摄入量分别为0.27~0.33 g/kg·d 与 0.4~0.47 g/kg·d[9],符合国内居民膳食营养素推荐的摄入量12.6g/1000kcal[10]。不足的能量、液体由外周静脉补给。
1.3 观察指标 记录两组术前、术后7 d时的外周静脉血营养状况指标:血清白蛋白(ALB)、前白蛋白(PA)以及转铁蛋白(TRF);炎性指标:白细胞(WBC)、C 反应蛋白(CRP)、白介素-6(IL-6)、肿瘤坏死因子(TNF-α)和降钙素原(PCT),胃肠黏膜屏障指标:D-乳酸(D-LA)与血清二胺氧化酶值(DAO)。此外,记录术后肠道功能恢复指标:排气、排便时间以及并发症情况。
1.4 统计学分析 采用 SPSS19.0(SPSS 19.0,Chicago,IL,USA)软件进行统计学分析。定量资料采用t检验或配对t检验,以±s的形式表示,定性资料采用数值(百分比)的形式表示。定性资料的组间比较采用卡方检验或Fisher’s精确检验;定义P<0.05为分析结果具有显著的统计学差异。
2 结果
2.1 一般情况 两组患者一般资料(年龄、性别、BMI、肿瘤分型与分期)等比较,无统计学差异(P>0.05),具有可比性(表1)。

表1 两组患者治疗前一般情况比较Tab 1 The general conditions of the two groups compared before treatment
2.2 肠道屏障功能指标结果 两组患者术前D-乳酸与DAO水平比较无统计学差异(P>0.05);术后DAO水平与术前比较均显著下降,术后NDF组D-乳酸水平均与术前相比无统计学差异,但有降低趋势;术后DF组D-乳酸与DAO水平均低于NDF组,差异有统计学意义(P<0.05),见表 2。

表2 两组结直肠癌患者血D-乳酸与DAO值比较(ng/L)Tab 2 Comparison of blood d-lactic acid and DAO values between two groups of colorectal cancer patients(ng/L)
2.3 肠道炎症因子指标结果 两组患者术前炎症因子比较均无统计学差异(P>0.05);除NDF组WBC和CRP外,患者术后炎症因子水平与术前比较均降低;与NDF组相比,DF组术后炎症因子水平显著降低,差异有统计学意义(P<0.05),见表3。
表3 两组患者手术前后炎性指标比较(±s)Tab 3 Comparison of inflammatory indicators before and after surgery between the two groups(±s)
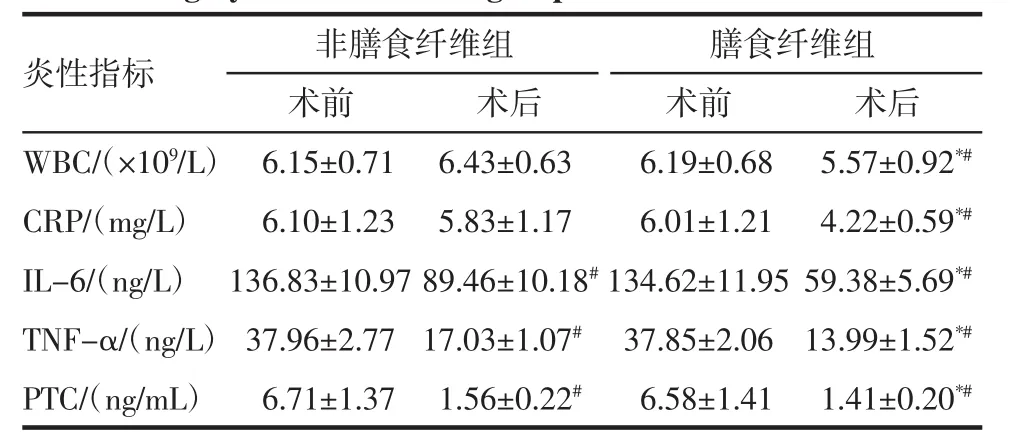
表3 两组患者手术前后炎性指标比较(±s)Tab 3 Comparison of inflammatory indicators before and after surgery between the two groups(±s)
与非膳食纤维组相比,*P<0.05;与术前相比,#P<0.05
炎性指标 非膳食纤维组 膳食纤维组术前 术后 术前 术后W B C/(×1 0 9/L)6.1 5±0.7 1 6.4 3±0.6 3 6.1 9±0.6 8 5.5 7±0.9 2*#C R P/(m g/L)6.1 0±1.2 3 5.8 3±1.1 7 6.0 1±1.2 1 4.2 2±0.5 9*#I L-6/(n g/L)1 3 6.8 3±1 0.9 7 8 9.4 6±1 0.1 8#1 3 4.6 2±1 1.9 5 5 9.3 8±5.6 9*#T N F-α/(n g/L)3 7.9 6±2.7 7 1 7.0 3±1.0 7#3 7.8 5±2.0 6 1 3.9 9±1.5 2*#P T C/(n g/m L)6.7 1±1.3 7 1.5 6±0.2 2#6.5 8±1.4 1 1.4 1±0.2 0*#
2.4 营养指标结果 两组患者术前营养指标水平比较无统计学差异(P>0.05);除NDF组TRF因子外,患者术后营养指标水平与术前比较均显著升高;术后DF组与NDF组营养指标水平比较无统计学差异,但有升高的趋势,见表4。
表4 两组患者手术前后营养指标比较(±s)Tab 4 Comparison of nutritional indicators before and after surgery between the two groups(±s)
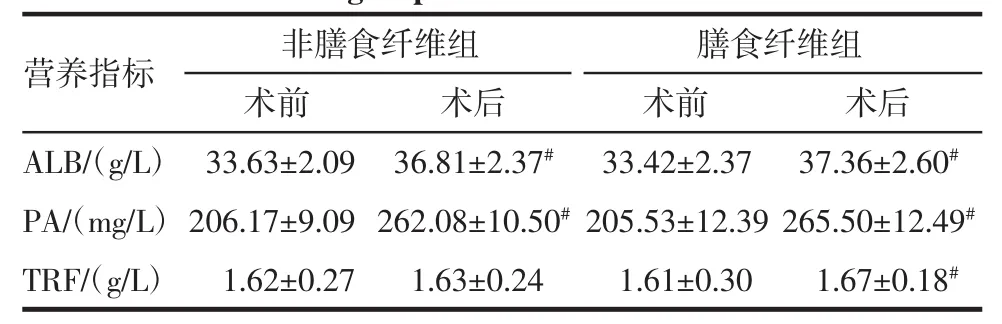
表4 两组患者手术前后营养指标比较(±s)Tab 4 Comparison of nutritional indicators before and after surgery between the two groups(±s)
与非膳食纤维组相比,*P<0.05;与术前相比,#P<0.05
营养指标 非膳食纤维组 膳食纤维组术前 术后 术前 术后A L B/(g/L)3 3.6 3±2.0 9 3 6.8 1±2.3 7#3 3.4 2±2.3 7 3 7.3 6±2.6 0#P A/(m g/L)2 0 6.1 7±9.0 9 2 6 2.0 8±1 0.5 0#2 0 5.5 3±1 2.3 9 2 6 5.5 0±1 2.4 9#T R F/(g/L)1.6 2±0.2 7 1.6 3±0.2 4 1.6 1±0.3 0 1.6 7±0.1 8#
2.5 肠动力结果及术后情况 两组患者术后排气、便时间比较,术后DF组显著低于NDF组,有统计学差异(P<0.05),其余指标比较无统计学差异(P>0.05),见表 5。
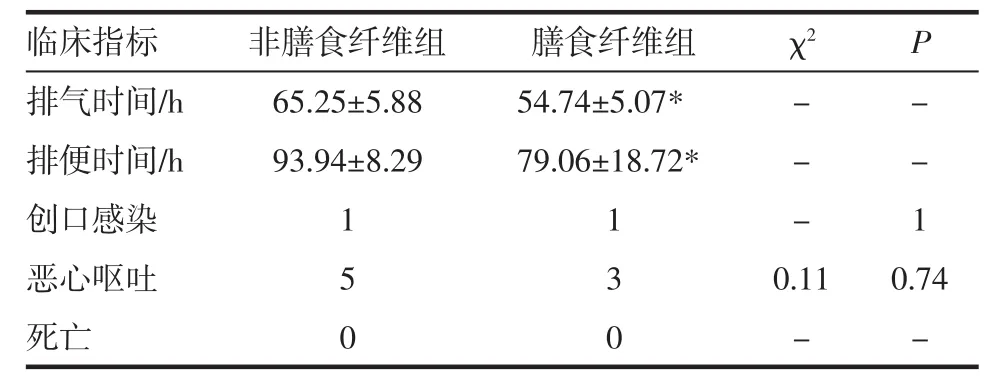
表5 两组结直肠癌患者术后情况比较Tab 5 Comparison of postoperative conditions between two groups of colorectal cancer patients
3 讨论
世界范围内,结肠直肠癌(CRC)是在癌症性疾病中导致死亡的最主要因素之一[11],每年可造成约60多万人死亡[12],近年来随着医疗技术水平的飞跃发展,结直肠癌的死亡率呈下降趋势[13]。但是近年来我国结直肠癌发病率已在恶性肿瘤中排至第5位,甚至部分地区已达第3位[14-15],形势不容乐观,目前手术切除是治疗结直肠癌的首选方式,而术前、术后辅助放、化治疗日臻完善了治疗的成功率。此外,在围手术期对CRC患者合理有效的营养支持似乎在一定程度上决定直肠癌手术治疗的成败。CRC患者存在菌群失衡,双歧杆菌与大肠杆菌比值倒置[16],肠道消化功能较常人显著降低,日常进食量下降,加之恶性肿瘤与周围正常组织竞争性消耗能量等情况,身体机能日渐衰退,加之围手术期因麻醉、手术等应激反应,致使机体处于高分解代谢的负氮平衡状态,加重营养不良,免疫功能下降,易出现术后并发症[17]。有研究发现,术后3~5 d大肠功能即可恢复正常,而小肠功能术后几小时即可恢复正常水平[18]。目前,临床上对CRC患者术后选择早期肠内营养支持已在国内外学者中得到普遍的共识[19-20]。但是关于膳食纤维肠内营养制剂术后早期干预结直肠癌的研究还鲜有关注。
肠道微生物群在调节氧化应激和炎症中起关键作用[21]。正常情况下,肠内细菌群可防止病原微生物入侵,调节免疫反应和预防癌变,而CRC患者肠道内菌群呈失衡状态,手术后肠腔内细菌移位现象会增加,损害肠黏膜屏障功能,当消化道肠黏膜出现急性病变时,肠内细菌代谢产物—D-乳酸(D-lactic acid,D-LA)在外周血中水平升高,是反应肠道屏障功能的标志物[22]。此外,消化道肠黏膜上皮细胞分泌的血浆二胺氧化酶(Diamine oxidase,DOA),也是反应消化道肠黏膜结构和功能的特异性标志物,其在外周血中活性较稳定[23]。因此,笔者对D-LA与DOA进行检测,以评估膳食纤维对保护肠道屏障功能的治疗作用;此外,CRC患者由于麻醉、手术创伤等应激,菌群失衡加重,促使肠内细菌和内毒素扩散,炎症反应加重,严重时出现多器官功能衰竭。我们除了测定常见炎性标记物CRP、WBC以及促炎细胞因子IL-6、TNF-α之外,为了测定炎症反应敏感度与特异度,对血清中PCT的含量也进行检测,PCT作为一种新的感染标志物,由于其灵敏度高于其他炎症标志物CRP、WBC与IL-6[24],可用于鉴别细菌性或病毒性感染源[25]并且与炎症的程度成正相关[26]。通过比较分析两组手术前与术后7 d时,血清中肠道屏障功能指标以及炎症因子水平的变化可知:给予肠内营养治疗后DAO与D-LA均降低,说明术后早期给予瑞先与瑞素均能保护CRC患者术后肠道屏障功能,然而,我们发现,与NDF组相比,DF组患者血清中DAO与D-LA水平下降显著,进一步说明膳食纤维(瑞先)在保护肠道屏障功能方面更为显著;另一方面,在两组中炎症反应上,肠内营养制剂对炎性因子(WBC、PCT 、CRP、IL-6与 TNF-α)的疗效均展现出与DAO与D-LA相同的治疗趋势,同时也证明了术后早期给予瑞先与瑞素均能抑制CRC患者术后肠腔内炎症反应,而含膳食纤维(瑞先)在抑制炎症反应方面较为更加显著。其机制可能是通过肠道微生物群能够通过纤维发酵产生短链脂肪酸-丁酸,在肠道内形成丁酸盐,通过作用于细胞表面G蛋白偶联受体109α(G proteine-coupled receptor 109α,GPR109α),增加抗炎 T 调节细胞(T-regulatory cells,Tregs)表达,抑制炎症反应[27],也可能是通过肠内细菌降解膳食纤维时,释放酚类化合物被肠吸收入血,从而发挥抗氧化与抗炎作用[21]。笔者认为这两种机制在膳食纤维抗炎机制中可能发挥协同作用,共同参与抗炎反应。
有研究报道,早期应用可溶性膳食纤维肠内营养可以增加营养指标,降低消化道并发症[28]。血清白蛋白、前白蛋白以及转铁蛋白(ALB、PA与TRF)是临床上重要的营养状况指标,临床上给予药物治疗促进消化道手术患者营养物质的消化、吸收,大多依赖于对胃肠黏膜细胞的结构与功能、肠道微环境以及胃肠屏障功能的良好修复,在本研究中,两组术后ALB、PA与TRF均显著增加,说明术后早期给予肠内营养(瑞先与瑞素)均能改善患者的营养状态,而DF组与NDF组相比,患者营养状况(ALB、PA与TRF)有增加趋势,但无统计学差异,由此我们认为,膳食纤维对术后患者营养状况的恢复略有优势。此外,我们对肠道功能的恢复情况也进行了比较,结果表明膳食纤维肠内营养制剂更加有利于CRC患者术后胃肠动力的改善。可能归因于两种肠内营养制剂(瑞先与瑞素)对肠道屏障功能的保护以及抑制肠道内炎症反应的作用,我们的结果得到了其他学者的支持[29]。
综上所述,结直肠癌患者术后早期给予含膳食纤维肠内营养制剂治疗,能显著改善患者肠道屏障功能、恢复胃肠动力,抑制肠道内炎症应激反应,改善患者术后状况。
