多糖硫酸酯抗凝血涂层应用于高分子医用管路
2019-05-05杨雪纯于美丽高文卿
杨雪纯 ,于美丽 ,高文卿
(1.天津医科大学三中心临床学院,天津市人工细胞重点实验室,天津300170;2.天津医科大学研究生院,天津300070;3.天津市第三中心医院,天津市人工细胞重点实验室,天津300170;4.天津市第三中心医院心脏中心,天津300170)
抗凝血涂层技术是利用化学或物理的方式,将抗凝物质牢固地结合在管路的内表面,抗凝血涂层技术的应用可以减少血液净化过程中的炎症反应,提高管路系统的生物相容性[1]。材料表面肝素化是提高材料表面血液相容性和生物相容性的有效手段。肝素是一种反应活性高、抗凝血性突出的天然抗凝剂,通过和抗凝血酶III、肝素结合蛋白和血小板因子等活性物质结合来发挥其抗凝血作用。研究显示,肝素在具有抗凝血活性的同时,也具有抗血小板活性,可引发不正常出血等副作用,且存在携带动物致敏原或病毒等安全隐患[2]。本实验目的在于寻找具有抗凝血生物活性的物质,作为肝素替代品,并试图降低材料来源和制作的成本。肝素发挥抗凝血作用与分子结构的特异性、硫酸基含量以及负电性有关。多糖的单糖分子上羟基与硫酸反应可以得到多糖硫酸酯,抗凝血机制与肝素相似,而且多糖硫酸酯还具有抗肿瘤、抗病毒、抗氧化性和调节免疫能力等[3],而且副作用低、生物相容性好、无毒无害,是一种良好的抗凝血剂。Anastase等[4]研究了葡聚糖衍生物和天然褐藻多糖中的免疫调节特性,证明了岩藻聚糖和右旋糖酐衍生物具有良好的免疫调节作用,可以作为新的抗凝血药物或用于生物相容性材料涂层。
本研究在对醛基化海藻酸钠抗凝血涂层的研究基础[5-7]上,主要选取生物相容性较好的海藻酸钠以及具有良好的抗炎性和抗病毒性的黄芪多糖和白芨多糖三种植物多糖,采用惰性化浓硫酸法对其进行硫酸化修饰,并采用共价键结合法将修饰后的多糖硫酸酯涂层物固定于体外循环管路材料表面。通过对涂层管路表面形态的分析和表面凝血时间的对比,筛选出抗凝效果较好的植物多糖硫酸酯。
硫酸酯化多糖是一类单糖分子上羟基被硫酸根取代的多糖,也称硫酸多糖或多糖硫酸酯[8]。海藻酸钠具有良好的生物相容性和抗凝血性,价格低廉,容易获得,广泛应用于医学材料和生物工程领域。以硫酸酯基取代海藻酸钠单糖上的羟基即得到海藻酸钠硫酸酯,具有良好的抗凝血活性,可以降低血脂和血液粘稠度,还具有清除血浆脂蛋白和纤维蛋白原的作用。Fan等[9]研究了影响海藻酸钠硫酸盐取代度(DS)的因素,并发现高浓度和高取代度的海藻酸钠硫酸酯能够有效抑制内源性凝血途径。黄芪多糖是一种免疫促进剂或调节剂,黄芪多糖单糖分子中的羟基与硫酸反应,在一定取代度范围内,硫酸取代度越大,抗凝血活性越强[10],同时黄芪多糖硫酸酯具有良好的抗病毒、抗肿瘤、抗辐射、抗氧化等作用[11]。白芨多糖具有收敛止血、消肿生肌等功效,俞林花等[12]发现,白芨多糖能够有效促进成纤维细胞增殖和胶原的合成,从而可以促进溃疡创面的愈合;陈景耀等[13]发现白芨多糖硫酸酯化处理后表现出很强的清除超氧阴离子自由基的作用,且在低浓度时表现出较强的清除羟基自由基的作用,而目前硫酸化白芨多糖在抗凝血方面并没有深入的研究。
1 材料与方法
1.1 材料与仪器 海藻酸钠(天津市光复科技有限公司);白芨(河南世济中药材有限公司);黄芪(四川名都药有限公司);氯化钠(天津市光复科技有限公司);乙醇(天津市中瑞洁康科技有限公司);聚乙烯亚胺(SIGMA-ALDRICH,美国);氰基硼氢化钠(SIGMA-ALDRICH,美国);98%浓硫酸(天津市光复科技有限公司);亚硝酸钠(SIGMA-ALDRICH,美国)。医用PVC(天津市塑料研究所);透析袋(天津市联星生物有限公司);24孔细胞培养板(Corning,美国);离心机(Eppendorff,德国);凝血自动分析仪(DiagnosticaStago,法国);红外分光光度计(NICOLET 6700,Thermo,美国);扫描电镜(Phenom,FEI Company,美国)。
1.2 实验方法
1.2.1 植物多糖的提取
1.2.1.1 黄芪多糖的提取与纯化:采用碱提醇沉的方法提取黄芪多糖[14]。精密称取300 g黄芪并粉碎,向三颈烧瓶中加入水2 800 mL,95%乙醇150 mL,1 mol/L NaOH溶液,调节pH至12,浸泡24 h后,加热至80~85℃,搅拌6 h后,过滤弃去残渣,将上清液蒸发浓缩至1 500 mL,冷却至室温后,倒入2倍体积的95%乙醇中,有白色絮状物析出,静置,将上层清液倒出,取出沉淀,干燥,得粗提取黄芪多糖。
1.2.1.2 白芨多糖的提取与纯化:采用水提醇沉的方法提取白芨多糖[15]。准确称取240 g白芨并打碎,向三颈烧瓶中加入5 000 mL水,缓慢加入白芨粉末,控制温度在75~80℃,搅拌4~5 h后,过滤弃去残渣,得到白芨多糖提取物。将提取物加热浓缩至3 000 mL,再倒入2倍体积的95%乙醇中,有白色絮状物析出,静置,将上层清液倒出,取出沉淀,干燥,得到粗提取白芨多糖。
1.2.2 多糖的硫酸化处理
1.2.2.1 海藻酸钠硫酸酯(SAS)的制备:将海藻酸钠脱水干燥。根据文献[2,16]的方法,按照浓硫酸和海藻酸钠物质的量之比为6:1,向浓硫酸中迅速加入海藻酸钠,0℃搅拌反应4 h后,将反应体系调节pH至弱碱性,得到淡黄色的海藻酸钠硫酸酯溶液。将所得溶液透析处理20 h,倒入2倍体积的95%乙醇中,有淡黄色沉淀析出。静置,将沉淀滤出并干燥,得到硫酸化海藻酸钠。
1.2.2.2 黄芪多糖硫酸酯(SAPS)的制备:采用与上述相同的方法制备黄芪多糖硫酸酯。
1.2.2.3 白芨多糖硫酸酯(SBPS)的制备:采用与上述相同的方法制备白芨多糖硫酸酯。
1.2.3 材料表面预处理和表面修饰
1.2.3.1 PVC管路材料酸化预处理:配制浓度分别为30%、50%和70%的酸溶液。将PVC管路材料剪成小段备用。将剪好的PVC管路材料浸入到不同浓度的酸溶液中,酸化处理5 min后,用蒸馏水冲洗干净并干燥。选取透明度好、表面形态结构完整的PVC管路待用。
1.2.3.2 酸化PVC管路材料的聚氨基化处理:将酸处理后的PVC管路材料浸入质量分数为0.05%的PEI溶液中进行聚氨基化处理20 min,将处理后的管路材料取出,用蒸馏水清洗干净并干燥。
1.2.3.3 涂层物的制备:将肝素钠(效价为197.2单位/mg)充分溶解于去离子水中,加入一定量亚硝酸钠,在酸性条件下冰浴搅拌反应2 h;调定溶液pH至中性,得到低分子肝素钠(LMWH)溶液;将所得LMWH溶液进行透析处理24 h,其间更换去离子水3次,滤出分子量过小的低分子肝素[17]。
用同样的方法对海藻酸钠硫酸酯、黄芪多糖硫酸酯及白芨多糖硫酸酯进行醛基化处理。
1.2.3.4 材料的表面修饰:配制不同浓度的多糖硫酸酯涂层物溶液。配制0.1 g/L LMWH溶液。向各反应体系中加入1.75 g NaCl和20 mg NaBH3CN充分混匀,调节溶液pH为3.5,将PVC管路材料浸没入反应液中,40℃恒温水浴震荡反应2 h。取未经处理的PVC管路材料,浸入相同体积的蒸馏水中,在相同条件下处理2 h。
1.2.4 涂层表面形貌及功能基团分析
1.2.4.1 涂层表面形貌分析:将涂层后的管路材料充分干燥,剪开管路暴露出涂层表面,样品表面喷金,通过扫描电镜观察涂层前后材料表面形貌变化。
1.2.4.2 涂层表面功能基团特性分析:将涂层后的管路材料充分干燥,剪开管路暴露出涂层表面,用红外探头扫描涂层前后材料表面,分析涂层表面的特征基团;红外扫描波长范围650~4 000 nm。
1.2.5 涂层表面凝血时间测定 取健康新鲜全血,离心处理10 min,获得贫血小板血浆(Platelet-poor plasma,PPP),测定凝血常规四项,即部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)和纤维蛋白原(FIB);将不同涂层材料剪成表面积约为0.25 cm2的碎片,置于24孔培养板内;每个涂层样品孔中分别加入PPP,37℃条件下恒温孵育反应2 h;取出孵育后的血浆,加入离心管内,再次测定四项凝血常规指标,计算并分析每组样品凝血时间差值和变化。
1.2.6 实验分组 根据涂层物类型和涂层物浓度将实验分为以下组:空白对照组(Em组)、低分子肝素组(LMWH组)、硫酸化海藻酸钠组(SAS1组、SAS2组、SAS3组)、硫酸化黄芪多糖组(SAPS1组、SAPS2组、SAPS3组)、硫酸化白芨多糖(SBPS1组、SBPS2组、SBPS3组)。为保证硫酸酯化反应过程中浓硫酸的量的充足和实验操作的安全性,初选取磺化剂中浓硫酸和多糖的物质的量之比为6:1。
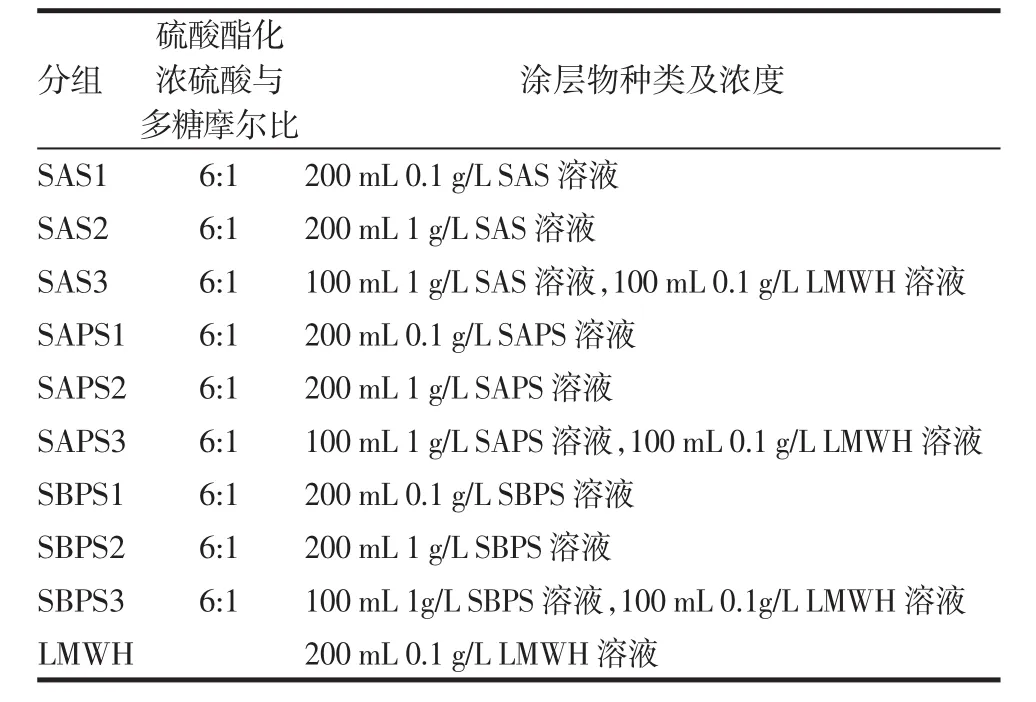
表1 不同多糖硫酸酯涂层物种类和浓度Tab 1 Variety and concentration of different polysaccharides sulphate coating
1.3 统计学方法 本文中的数据统计与分析使用SPSS 23.0软件和Origin 8.0软件完成。
2 结果
2.1 酸化预处理表面筛选 观察酸化预处理后材料透明度和表面形态的完整性,筛选出经30%酸溶液预处理的PVC管路材料。
2.2 涂层表面形貌及功能基团分析 使用扫描电镜对涂层表面形态进行分析,LMWH涂层(b)分布较均匀,海藻酸钠硫酸酯涂层(c-e)分布较不均,黄芪多糖硫酸酯涂层(f-h)和白芨多糖硫酸酯涂层(i-k)分布相比前者较均匀,管路材料表面纹理清晰可见;涂层管路和未涂层管路相比,表面可见明显涂层物,但表面结构未有明显变化,可见涂层过程未破坏管路材料表面的物理结构(见图1)。

图1 涂层管路材料表面形貌分析Fig 1 Surface morphology analysis of coated pipeline material
2.3 涂层表面功能基团特性分析 通过红外光谱法检测到多糖涂层管路组和肝素涂层管路组在波长约为3 400 cm-1处均有一个较浅的特征吸收峰,而空白对照组没有这个吸收峰,表明实验中多糖硫酸酯和低分子肝素均可以固定在管路材料表面。波长为1 020 cm-1处为硫酸根基团(-SO3)的反对称伸缩振荡吸收峰,通过红外光谱可以看出,多糖硫酸酯涂层组和低分子肝素涂层对照组具有硫酸根基团的吸收峰,而空白对照组没有,说明通过硫酸化处理后的多糖硫酸酯具有与低分子肝素抗凝血作用相同的硫酸根基团(-SO3),并且已经固定于材料表面(图 2)。

图2 涂层管路材料红外表征图Fig 2 Infrared characteristics of coated pipeline materials
2.4 涂层表面凝血功能评价 通过对反应前后以及不同涂层材料凝血常规指标的分析,空白对照组和未经涂层组对比,APTT未见明显差异,而LMWH组 APTT 明显延长(P<0.05)(表 2)。可见经过涂层的管路APTT均显著高于多糖空白对照组,说明材料表面的抗凝血性能有明显改善(P<0.05)。SAS1、SAS2 组(表 3)、SAP1、SAPS2 组(表 4)和 SBPS1、SBPS2组(表5)3种多糖硫酸酯涂层的管路之间APTT无显著性差异(P>0.05),但均显著长于空白对照组(P<0.05)。SAS3、SAPS3和SBPS3之间APTT未有明显差异(P>0.05),但均长于空白对照组和单一多糖涂层组(P<0.05),且与LMWH涂层组相比APTT无显著性差异(P>0.05)。说明多糖硫酸酯涂层组和多糖硫酸酯-LMWH复合涂层组均有良好的抗凝血性能。
表2 对照组材料表面凝血四项(±s,n=6)Tab 2 Four items of clotting routine of Material surface in control group(±s,n=6)

表2 对照组材料表面凝血四项(±s,n=6)Tab 2 Four items of clotting routine of Material surface in control group(±s,n=6)
涂层种类未涂层 空白对照 L M W H涂层P T-s e c 6 1 2.8±1.0 0 1 3.4±1.2 1 1 6.1±1.5 4 A P T T 6 3 5.9±2.3 5 3 6.9±4.1 1 7 1.6±1 6.6 T T 6 1 3.3±4.4 9 1 8.2±1.4 2 4 9.5±8.6 1 F I B-s e c 6 1 7.8±1.0 0 1 6.7±4.5 1 1 4.6±3.2 0 n
表3 海藻酸钠硫酸酯涂层凝血四项(±s,n=6)Tab 3 Four items of clotting routine of Sodium alginate sulphatecoating(±s,n=6)

表3 海藻酸钠硫酸酯涂层凝血四项(±s,n=6)Tab 3 Four items of clotting routine of Sodium alginate sulphatecoating(±s,n=6)
涂层种类S A S 1 S A S 2 S A S 3 P T-s e c 6 1 4.7±1.0 7 1 3.8 8±0.8 4 1 4.7±1.0 5 A P T T 6 4 4.6±2.8 8 4 4.1 5±1.0 6 6 4.2±1 3.6 7 T T 6 1 9.4±1.9 4 1 2.4 8±3.1 5 5 0.6±1 4.9 4 F I B-s e c 6 1 3.0±2.3 2 2 0.4 5±1.2 4 1 5.9±4.2 9 n
表4 黄芪多糖硫酸酯涂层凝血四项(±s,n=6)Tab 4 Four items of clotting routine of Astragalus polysaccharide sulfate coating (±s,n=6)

表4 黄芪多糖硫酸酯涂层凝血四项(±s,n=6)Tab 4 Four items of clotting routine of Astragalus polysaccharide sulfate coating (±s,n=6)
涂层种类S A S 1 S A S 2 S A S 3 P T-s e c 6 1 4.2±0.4 6 1 3.9 8±1.3 3 1 5.1±0.7 1 A P T T 6 4 4.6±2.8 8 4 2.1 3±3.7 1 7 9.9±8.4 1 T T 6 1 8.7±1.5 7 1 3.2 0±4.0 4 1 0 4.4±5 6.2 8 F I B-s e c 6 1 4.8±3.4 4 1 9.4 8±1.2 2 1 3.8±3.6 1 n
表5 白芨多糖硫酸酯涂层凝血四项(±s,n=6)Tab 5 Four items of clotting routine of Bletillastriata polysaccharide sulfate coating (±s,n=6)
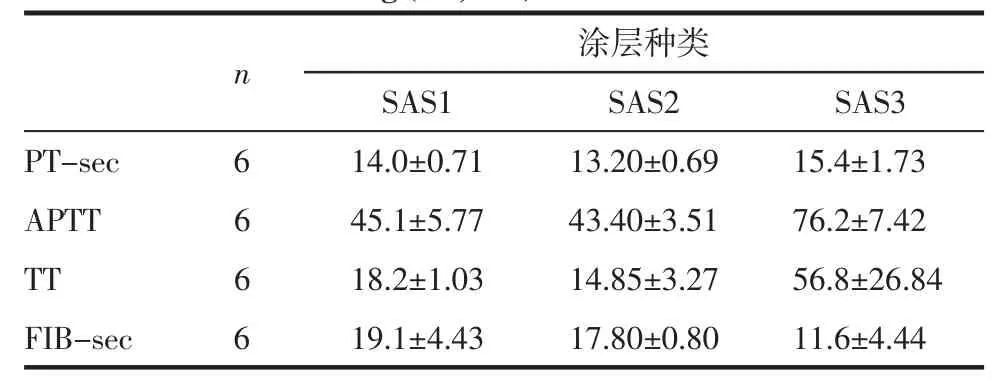
表5 白芨多糖硫酸酯涂层凝血四项(±s,n=6)Tab 5 Four items of clotting routine of Bletillastriata polysaccharide sulfate coating (±s,n=6)
涂层种类S A S 1 S A S 2 S A S 3 P T-s e c 6 1 4.0±0.7 1 1 3.2 0±0.6 9 1 5.4±1.7 3 A P T T 6 4 5.1±5.7 7 4 3.4 0±3.5 1 7 6.2±7.4 2 T T 6 1 8.2±1.0 3 1 4.8 5±3.2 7 5 6.8±2 6.8 4 F I B-s e c 6 1 9.1±4.4 3 1 7.8 0±0.8 0 1 1.6±4.4 4 n
3 讨论
高文卿[5-7]、李金友[18-19]等分别制备了醛基化海藻酸钠-肝素复合涂层和氧化海藻酸钠涂层,均取得了良好的抗凝血效果。本研究在此基础上采用浓硫酸法修饰植物多糖,并制备了多糖硫酸酯涂层。研究结果显示,天然植物多糖经硫酸酯化修饰后,可以获取植物多糖硫酸酯,具有一定的抗凝血功能。红外谱图扫描显示3种多糖硫酸酯及LMWH均已固定于材料表面,证实了经过重氮化处理可以使多糖硫酸酯及LMWH分子带有活性醛基,带有醛基的多糖硫酸酯及LMWH与经过酸化和聚氨基化预处理的聚氯乙烯管道进行了有效的共价交联。扫描电镜观察发现涂层过程并未改变材料表面的物理结构。
在血液相容性评价实验中,LMWH涂层物通过阻断内源性凝血途径可显著延长凝血时间,具有显著抗凝效果,主要表现为APTT明显延长。海藻酸钠硫酸酯涂层物、黄芪多糖硫酸酯和白芨多糖硫酸酯均可延长APTT时间,具有一定的抗凝效果,3种多糖硫酸酯涂层物的抗凝血性能并无显著性差异,考虑实验中选取的涂层浓度较低。SAS-LMNH复合涂层、SAPS-LMWH复合涂层和SBPS-LMWH复合涂层抗凝效果劣于LMWH涂层,但同样可显著延长APTT及TT时间,具有较好的抗凝效果。经涂层的材料表面主要表现为APTT明显延长,证实了多糖硫酸酯的抗凝血机制与低分子肝素相似,通过阻断内源性凝血途径保持了良好的抗凝功效。
本研究通过定性和定量分析,初步证明了植物多糖硫酸酯制备抗凝血涂层的可行性。天然植物多糖经硫酸酯化处理后,可以具有良好的抗凝血性质,并且通过共价交联的方式与管路材料有效结合,发挥抗凝血作用。对于具有促凝血作用的白芨多糖,经硫酸化处理后,被证实具有抗凝血性,为多糖修饰研究提供了新思路。浓硫酸法操作简单,不会产生有机溶剂污染,但有研究表明该方法修饰所获得的多糖硫酸酯取代度较低,因此硫酸化修饰的不同方法和条件对多糖生物活性的影响需做进一步探究。此外,多糖硫酸酯涂层在不同高分子医用材料中的应用价值,以及涂层材料的抗病毒性、抗炎性以及稳定性等安全特性,有待进一步研究验证。
